川秋葵微粉体外降血脂作用及对小鼠肠道菌群的影响
2020-09-24辛松林舒娟韦章琳徐培黄韬睿张海豹
辛松林 舒娟 韦章琳 徐培 黄韬睿 张海豹
摘要:研究川秋葵微粉体外降血脂的能力及其对小鼠肠道菌群的影响。小鼠肠道菌群试验中,将小鼠随机分为4组灌胃6周,即对照组(等体积的生理盐水[10 mL/(kg·d)]、川秋葵微粉低剂量组[450 mg/(kg·d)]、川秋葵微粉中剂量组[900 mg/(kg·d)]、川秋葵微粉高剂量组[1 800 mg/(kg·d)]),采用16S rDNA高通量测序技术分析小鼠肠道菌群的组成及其变化。体外降血脂试验中,研究不同质量浓度的川秋葵微粉对体外胆固醇、牛磺胆酸钠、甘氨胆酸钠的吸附能力。结果显示,川秋葵微粉各剂量组的小鼠肠道菌群组成的相似度较高,中剂量组的盲肠内容物菌群的OTUs数量最高,说明中劑量组小鼠盲肠菌群的特异性高;低剂量组的结肠内容物菌群的OTUs数量最高,说明低剂量组小鼠结肠菌群的特异性高;此外,秋葵微粉能提高小鼠肠道中的益生菌比例,降低有害菌比例。通过体外胆固醇吸附试验以及体外胆酸盐吸附试验,初步证实秋葵微粉具有良好的吸附胆固醇、牛磺胆酸钠以及甘氨胆酸钠的能力,且呈明显的剂量效应关系,随着质量浓度的增加其吸附量逐渐上升;秋葵微粉对牛磺胆酸钠的吸附量较甘氨胆酸钠的吸附量多,即秋葵微粉与牛磺胆酸钠的结合能力更强。结果表明,川秋葵微粉具有体外降血脂的能力,且对小鼠肠道内环境健康具有改善调节作用,低剂量更具有实际应用价值。
关键词:川秋葵微粉;小鼠肠道菌群;降血脂;OTUs
中图分类号:R285
文献标志码:A
文章编号:1002-1302(2020)16-0228-07
人类肠道内微生物的数量约是人类体细胞和生殖细胞的10倍[1],肠道菌群对人类健康有重要作用。相关研究报道,肠道微生物不仅参与宿主主要化学物质的代谢[2],还与肠道疾病密切相关[3]。
秋葵是一年生锦葵科的草本植物,在我国许多省份均有较大的种植面积[4]。秋葵作为具有保健作用的蔬菜,富含多种生物活性物质[5],如果胶、多糖等黏性物质[6],多酚[7],黄酮类物质[8]。其中,果胶、多糖不能被胃消化酶分解,可以促进肠道中某些微生物的特异性生长,有利于肠道健康[9];同时也具有降血脂[10]、降血糖[11]的作用。目前,关于秋葵微粉改善动物肠道及体外降血脂的研究报道较少。张海文等报道,黄秋葵粉添加到日粮中对肉鸡营养物质消化吸收有影响[12]。吴佳静等报道,秋葵叶粉喂养海兰褐蛋鸡后对其盲肠微生物及肠道组织结构有影响[13]。本研究采用16S rDNA克隆文库的方法,研究不同质量浓度的秋葵微粉对小鼠肠道菌群的作用;通过测定体外胆固醇、牛磺胆酸钠、甘氨胆酸钠吸附量研究不同质量浓度的秋葵微粉的体外降血脂作用,旨在为秋葵微粉在食品添加剂、医疗、保健用品等的开发利用上提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
1.1.1 动物 SPF级(无特定病原体动物,specific Pathogen Free)昆明小鼠,雄性,体质量18~22 g,购自成都达硕实验动物中心,动物证号:SCXK(川)2015-030。
1.1.2 材料与试剂 川秋葵1号,四川省植物工程研究院提供;正大鲜鸡蛋,超市购买;粪便基因组脱氧核糖核酸(DNA),天根生化科技(北京)有限公司提取试剂盒;胆固醇天津市光复精细化工研究所生产;牛磺胆酸钠、甘氨胆酸钠,上海金穗生物科技有限公司生产;其他试剂为分析级,成都市科龙化工试剂厂生产。
1.2 仪器与设备
XDW-2C小型低温超微粉碎机,济南达微机械有限公司;Sartorius BP121s电子天平,北京赛多利斯科学仪器有限公司;HX-200型高速中药粉碎机,浙江省永康市溪岸五金药具厂;TDZ5-W5型离心机,湖南湘仪实验室仪器开发有限公司;XW-80A型涡旋混合器,上海青浦沪西仪器厂;YXQG02手提式压力蒸汽灭菌器,山东新华医疗器械股份有限公司;FX101-3型电热鼓风干燥箱,上海树立仪器仪表有限公司。
1.3 试验方法
1.3.1 川秋葵微粉准备 鲜川秋葵→预处理→护色处理→热风干燥→粗粉碎→微粉碎→过筛→成品→干燥密闭保存备用。果荚长度为7.0 cm左右。预处理:选择无腐烂、无病虫害的新鲜川秋葵,清洗、沥干、去蒂,横切成0.5 cm左右的小段。护色处理:用90 ℃沸水烫漂新鲜秋葵30 s。干燥时间为 7.4 h,干燥温度为51.0 ℃。微粉粒度:150.0目。
1.3.2 动物喂养 将小鼠随机分为4组,即对照组,等体积的生理盐水;川秋葵微粉低剂量组,每天450 mg/kg;中剂量组,每天 900 mg/kg;高剂量组,每天1 800 mg/kg。每组10只小鼠。灌胃6周,1次/d,自由摄食和饮水,灌胃后观察小鼠的精神状态、活动、觅食量等指标。
1.3.3 样品采集 小鼠于末次灌胃后禁食12 h,脱颈椎法处死,分别取小鼠盲肠、结肠及其内容物。
1.3.4 DNA提取和测序 采用DNA提取试剂盒提取各组小鼠结肠及盲肠内容物中的微生物总DNA。对样品进行PCR扩增、产物纯化、文库制备与库检及Miseq上机测序。利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的有效数据。由于序列数量庞大,本试验对最终获得的有效数据进行97%的相似度聚类,为了降低假阳性率,会过滤singleton序列,获得最终的OTU丰度及代表序列,进一步进行多样性分析、菌群不加权算术平均组对方法(unweighted pair group method with arithmetic mean,UPGMA)聚类分析、主坐标分析分析(principal coordinates analysis,PCoA)及微生物菌属组成差异分析等。
1.3.5 体外降血脂功能的测定
1.3.5.1 体外吸附胆固醇能力的测定 参照钟希琼等的方法[14],鲜鸡蛋蛋黄100 g中加入900 g的蒸馏水,搅打成乳液,加入秋葵微粉,分别定容至5、10、15、20、25 mg/mL,即5个浓度组。调节蛋黄乳液pH值分别至7.0和2.0,37 ℃吸附2 h,4 000 r/min 离心20 min,吸取0.04 mL上清液,采用邻苯二甲醛法[15]在550 nm下比色测定胆固醇含量。胆固醇吸附量计算公式:吸附量(mg/g)=(吸附前胆固醇量-吸附后胆固醇量)/蛋黄质量。
在秋葵微粉浓度对胆固醇吸附能力的影响的试验基础上,选择吸附量最好的秋葵微粉浓度,研究吸附时间对胆固醇吸附能力的影响,设置5个吸附时间,分别为1.0、1.5、2、2.5、3.0 h。
1.3.5.2 体外吸附胆酸钠能力的测定 在50 mL含0.1 g牛磺胆酸钠(甘氨胆酸钠)的0.15 mol/L NaCl溶液中加入0.500 g秋葵微粉,调节pH值为6.0,此时秋葵微粉浓度相当于10 mg/mL[16]。同上配制5、15、20、25 mg/mL的秋葵微粉溶液,采用磁力搅拌使其完全分散,37 ℃吸附2 h,取出后静置。准确吸取上清液2.0 mL于具塞试管中,加入质量分数60%的硫酸溶液6 mL,70 ℃水浴20 min,冰浴 5 min,在波长387 nm处测定吸光度,根据标准曲线确定胆酸钠含量,计算秋葵微粉对牛磺胆酸钠(甘氨胆酸钠)的吸附量[17]:牛磺胆酸钠(甘氨胆酸钠)的吸附量(mg/g)=(吸附前的质量-吸附后的质量)/牛磺胆酸钠(甘氨胆酸钠)质量。
1.4 数据处理
试验数据用平均数±标准差(x±s)表示,各组间比较采用单因素方差分析,统计分析使用SPSS19.0等软件。
2 结果与分析
2.1 川秋葵微粉对小鼠体质量的影响
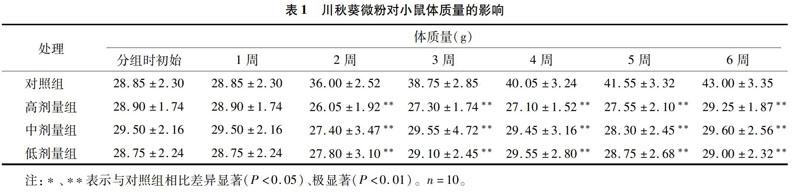
从表1可以看出,秋葵微粉灌胃小鼠1周,各剂量组小鼠体质量与对照组差异不显著;2~6周,不同秋葵微粉剂量组小鼠体质量与对照组差异极显著(P<0.01)。喂养6周,对照组小鼠增质量明显,增加49.05%;而秋葵微粉高、中、低剂量组小鼠增质量不明显,分别增加了1.21%、0.34%、0.87%。可能因为秋葵富含多糖[18]、果胶[19]等成分,能够让小鼠具有饱腹感,同时秋葵的热量较低,因此秋葵微粉组小鼠体质量增长缓慢。另外,秋葵微粉本身具有一种特殊的气味,可能会干扰小鼠的摄食;试验中发现,各剂量组小鼠的摄食量少于对照组。此结果提示秋葵微粉可作为减肥代餐,但需要做进一步试验研究证实。
2.2 秋葵微粉对小鼠肠道菌群的影响
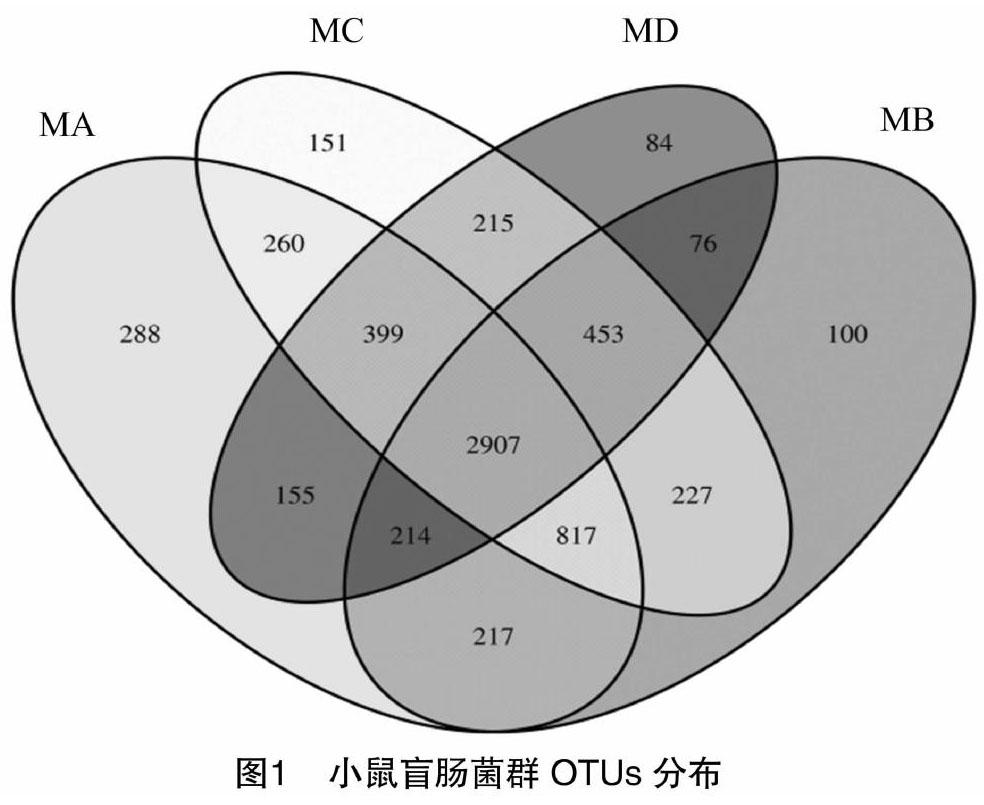
2.2.1 菌群多样性分析 序列按97%的序列相似性聚类为分类单元(operational taxonomic units,OTUs),得到每个群集的序列及其代表序列(即为OTU)。在OTU水平上对不同样本之间的异同进行统计,图中每个圈代表1个组样,圈和圈重叠部分的数字代表组样之间共有的OTUs个数,没有重叠部分的数字代表组样的特有OTUs个数。从图1可以看出,对照组盲肠内容物(MA)的OTUs个数为 5 257;低剂量组盲肠内容物(MB)的OTUs個数为 5 011;中剂量组盲肠内容物(MC)的OTUs个数为 5 429;高剂量组盲肠内容物(MD)的OTUs个数为 4 503,OTUs数量最多的为秋葵微粉中剂量组,最少的为秋葵微粉高剂量组,表明中剂量组小鼠盲肠内容物中菌群的丰度很高。低剂量组与对照组未重叠的特有OTUs个数为856,中剂量组与对照组未重叠的特有OTUs个数为1 046,高剂量组与对照组未重叠的特有OTUs个数为828,表明中剂量组小鼠盲肠内容物中菌群的特异性较高。
对照组结肠内容物(JA)、低剂量组结肠内容物(JB)、中剂量组结肠内容物(JC)及高剂量组结肠内容物(JD)的文氏图见图2。中低剂量组的结肠内容物菌群的OTUs数量均高于对照组,但差异不明显,OTUs数量最多的为低剂量组,为 5 640,最少的为高剂量组,为4 512,表明中低剂量组小鼠结肠内容物中菌群的丰度很高。低剂量组与对照组未重叠的特有OTUs个数为1 002,中剂量组与对照组未重叠的特有OTUs个数为984,高剂量组与对照组未重叠的特有OTUs个数为745,表明低剂量组小鼠结肠内容物中菌群的特异性较高。结果证实,秋葵微粉有利于肠道菌群的增值,可丰富肠道菌群数。
2.2.2 菌群UPGMA聚类分析及PCoA分析 利用UPGMA方法对样品进行聚类,样本间的分支长度越短,2个样本越相似。从图3可见,JB、JC和JD在物种组成上较为接近;MB、MC以及MD在物种组成上较为接近;而JA和MA在物种组成上较为接近。
基于上述计算获得的2种不同距离进行主坐标分析,通过PCoA分析可以观察单个样品或样品组之间的差异,不同样本间的距离代表其物种组成的差异情况,样品距离越近,说明样品之间的微生物组成结构越相似,差异性越小。从图4所示,JB和JC在物种组成上较为接近;MB和MC在物种组成上较为接近,与UPGMA聚类分析的结果一致。结果表明,秋葵微粉可改善小鼠肠道菌群组成。
2.2.3 菌群构成分析 从图5可以看出,JA、JB、JC以及JD 4组样品的微生物组成在属群的水平上,以未分类的毛螺菌科(Lachnospiraceae_unclassified)、未 分类的石斑科(Porphyromonadaceae_unclassified)、乳杆菌属(Lactobacillus)和未分类的反刍球菌科(Ruminococcaceae_unclassified)为主要物种,所占比例均在63.84%以上。肠道菌群主要归属为厚壁菌门和拟杆菌门[20-21]。乳杆菌属是对人体肠道有益的微生物,对照组(JA)中占5.74%,而低、中、高剂量组(JB、JC、JD)中的比例分别为20.73%、13.39%、24.84%,表明秋葵微粉有助于小鼠肠道中乳杆菌属的增加,其中高剂量组的增加效果最为突出。拟杆菌属(Bacteroides)在对照组中的所占比例为1.29%,而低、中、高剂量组中的所占比例有所下降,分别为0.46%、1.13%、0.76%。另枝菌属(Alistipes)可能导致肠道炎症,在对照组中的所占比例为1.71%,低剂量组、中剂量组降至1.02%和1.53%,而高剂量组升高至2.05%。异杆菌属(Allobaculum)导致人体炎症及并发症(不孕不育),在对照组中含量高达4.98%,但其含量在低剂量组中为0.70%,中剂量组中为2.90%,高剂量组中未检测出。结果表明,秋葵微粉的摄入有利于益生菌增殖;同时对病原菌的生长也有一定的抑制作用,从而改善小鼠肠道菌群。
从图5还可以看出,MA、MB、MC以及MD 4组样品的微生物组成在属群的水平上,仍以毛螺菌属、未分类的石斑属、乳杆菌属和未分类的反刍球菌属为主,所占比例均在64.02%以上。乳杆菌属在对照组(MA)中占7.31%,而低、中、高剂量组(MB、MC、MD)中的比例随秋葵微粉浓度增加而增加,分别为25.01%、26.52%、31.82%。拟杆菌属在对照组中的所占比例为0.55%,而低、高剂量组中的所占比例有所下降,分别为0.43%、0.17%,而中剂量组为0.61%,略有增加。另枝菌属在对照组中的所占比例为1.10%,低、中、高剂量组的含量均降低,分别为0.46%、0.60%、0.31%。对照组中异杆菌属含量高达5.80%,低剂量组为0.18%,中剂量组为3.62%,高剂量组为0.02%。与小鼠结肠内容物的菌群分布结果类似。
2.3 川秋葵微粉对体外胆固醇的吸附能力
为体外模拟人体胃环境和小肠环境下的胆固醇吸附情况,分别测定pH值2.0和pH值7.0条件下秋葵微粉对胆固醇的吸附量,不同质量浓度秋葵微粉对胆固醇吸附量见表2。胆固醇只有溶于混合胶束中才可以被运输到小肠中吸收。秋葵微粉富含膳食纤维、果胶,其本身是生物大分子[22],具有一定的空间网络结构,经微粉碎处理后,膳食纤维网络结构松散,比表面积增大,截留能力增强[23],故可与胆固醇竞争进入胆盐胶束并取代胆固醇,从而减少人体对胆固醇的吸收。从表2可以看出,在pH值7.0和pH值2.0的条件下,秋葵微粉对胆固醇的吸附量均随着其质量浓度的增加而增加,提示富含多糖的秋葵微粉对胆固醇具有良好的吸附作用且呈剂量依耐性。这与Zhang等的研究结果[24]一致,即苹果皮、麦麸和大豆种子壳中的各类膳食纤维对胆固醇均具有吸附能力,苹果皮中SDF显示出更好的吸附作用,且在中性肠环境中DF表现更优异。然而,在质量浓度低于20 mg/mL时,对胆固醇的吸附量随浓度增加而显著增加(P<0.05),后期吸附量變化不显著(P>0.05),可能是吸附过程达到动态平衡,即秋葵微粉中的多糖对胆固醇的吸附量接近饱和了。另外,秋葵微粉质量浓度较低时(5~15 mg/mL),同质量浓度的秋葵微粉在不同pH值条件下对胆固醇的吸附量的差异不显著(P>0.05),随着秋葵微粉质量浓度的增加,差异显著(P<0.05),即秋葵微粉在中性条件下(pH值7.0)的胆固醇吸附量优于酸性条件(pH值2.0),本结论与冯雁波等的研究结果[17]一致,即多糖在中性环境中更利于吸附胆固醇。
从表3可以看出,秋葵微粉质量浓度为 20 mg/mL 时,随着吸附时间的增加, 秋葵微粉对胆固醇吸附量呈增大趋势,提示秋葵微粉对胆固醇的吸附量与吸附时间有关,且呈时间依耐性。当 pH值7.0时,与1.0 h对应的吸附量比较,1.5 h时吸附量极显著升高(P<0.01);1.5 h对应的吸附量与2.0 h时吸附量差异不显著;与2.0 h对应的吸附量比较, 2.5 h时吸附量显著升高; 与2.5 h对应的吸附量比较,3.0 h时吸附量极显著升高。当pH值2.0时,秋葵微粉在1.0 h和1.5 h时对胆固醇的吸附量差异极显著,秋葵微粉在1.5 h和2.0 h时对胆固醇的吸附量差异显著,秋葵微粉在2.0 h和2.5 h时对胆固醇的吸附量差异显著,秋葵微粉在2.5 h和3.0 h时对胆固醇的吸附量差异不显著。结果表明,秋葵微粉对胆固醇的吸附在开始的2.5 h内基本达到吸附平衡量。另外,秋葵微粉在pH值7.0条件下对胆固醇的吸附量优于pH值2.0条件下的胆固醇吸附量,这与前面的研究结果一致;当秋葵微粉对胆固醇的吸附时间为1.0 h时,秋葵微粉在pH值7.0和pH值2.0时的胆固醇吸附量差异显著,其他吸附时间的胆固醇吸附量差异均不显著。
2.4 川秋葵微粉对体外胆酸盐的吸附能力
胆汁酸是胆固醇分解的主要产物,可通过排出体外从而保持机体内胆固醇平衡。若胆汁酸在肠道内被其他成分相结合,胆固醇就会大量降解,且增加血液中胆固醇进入肝脏的量,从而使血液中的胆固醇量减少,最终达到降血脂的作用[25-,27]。因此,在体外通过模拟人体胃肠环境进行胆酸结合试验可以初步判断秋葵微粉的降血脂效果。从表4可以看出,不同质量浓度秋葵微粉对苷氨胆酸钠均有吸附作用,呈质量浓度依赖性;5 mg/mL秋葵微粉与10 mg/mL秋葵微粉对苷氨胆酸钠的吸附量差异不显著;当秋葵微粉质量浓度达到15 mg/mL时,秋葵微粉对苷氨胆酸钠的吸附量与5 mg/mL的秋葵微粉对苷氨胆酸钠的吸附量差异显著;特别是当秋葵微粉浓度达到20、25 mg/mL,对苷氨胆酸钠的吸附量较5 mg/mL时极显著增加。
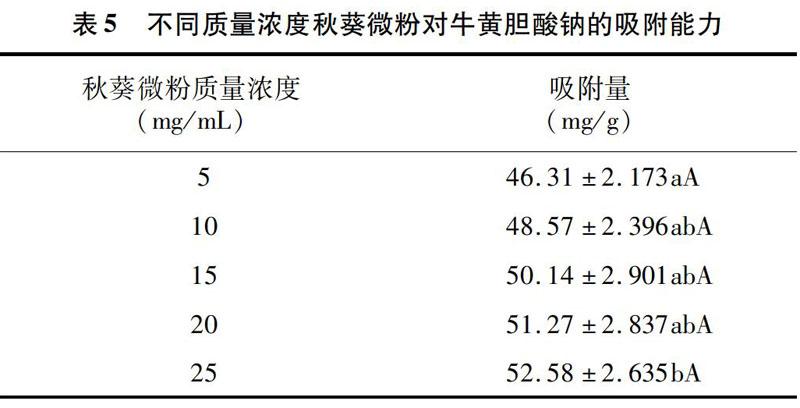
牛磺胆酸钠是肝内胆固醇衍生而来的物质,可在盲肠末端被重吸收而进入肠肝循环,导致肝脏胆固醇大量降解,从而起到降血脂作用[28]。从表5可以看出,秋葵微粉对胆固醇的吸附量和其质量浓度之间呈明显的剂量效应关系,随着质量浓度的增加其吸附量逐渐上升。当秋葵微粉质量浓度达到 25 mg/mL 时,秋葵微粉对牛磺胆酸纳的吸附量为52.58 mg/g,与5 mg/mL的秋葵微粉对牛磺胆酸纳的吸附量差异显著。
3 讨论与结论
3.1 川秋葵微粉对小鼠体质量的影响
多糖是高分子化合物,具有较多的亲水基团,有助于提高小鼠肠道内容物保水能力,增加小鼠粪便质量。试验中发现,秋葵微粉各剂量组小鼠的摄食量低于对照组;与对照组比较,秋葵微粉各剂量组的小鼠在灌胃6周后的体质量增长缓慢,差异极显著(P<0.01);小鼠盲肠、结肠的质量增长也表现为迟缓,内容物较少。这可能与秋葵微粉本身的特殊气味有关,会影响小鼠摄食。另外,可能与秋葵微粉的使用剂量有关,本试验设计了高、中、低3个剂量梯度,分别为1 800、900、450 mg/(kg·d),设计依据是鲜秋葵热风干燥得率为12%,低剂量组相当于食用鲜秋葵 3.75 g,中剂量组7.5 g,高剂量组15.0 g,而各组小鼠分组时的体质量为28 g左右,因此推测秋葵微粉用量较大,而秋葵本身能量较低,因此小鼠体质量增长迟缓。相关研究报道,微生态调节剂并不是剂量越高效果越好,过高剂量的摄入在诱导双歧杆菌增殖的同时,丁酸产生菌数量减少,菌群多样性下降[29]。因此,建议秋葵微粉用量选择低剂量为宜。
3.2 川秋葵微粉对小鼠肠道的改善
已有研究证明,多糖可改善肠道微生态[30-31],本试验使用的秋葵微粉富含多糖,且制作工艺简单、生产成本适中,动物试验表明,低剂量下即可有效改善小鼠肠道内环境健康,提高肠道菌群的多样性,低剂量组结肠内容物的物种组成与高剂量组较为接近,低剂量组盲肠内容物在物种组成上和中剂量组较为接近。综合考虑生产成本和改善肠道的效果,低剂量最为适宜。
3.3 川秋葵微粉体外降血脂的作用
已有研究证明,蔬菜类膳食纤维如新鲜果蔬、豆荚等均具有较好的降血胆固醇的功效[32],本试验通过体外降胆固醇试验以及体外降胆酸盐试验,初步证实秋葵微粉具有良好的吸附胆固醇、牛磺胆酸钠以及甘氨胆酸钠的能力,且呈明显的剂量效应关系,随着质量浓度的增加其吸附量逐渐上升。但是,秋葵微粉对牛磺胆酸钠的吸附量较甘氨胆酸钠的吸附量多,即秋葵微粉与牛磺胆酸钠的结合能力更强,这与前人对桑叶茯砖茶多糖降血脂的研究结果[33]以及粗毛纤孔菌三萜类化合物降血脂的研究结果[31]一致。可能与2种胆酸钠的结构有关,牛磺胆酸钠侧链末端为磺酸基,而甘氨胆酸钠侧链末端为甘氨酸的羧基,磺酸基的极性更大,解离性更强,这有利于与秋葵微粉多糖结合[34]。
秋葵微粉具有促进小鼠肠道内酵解作用,可提高肠道菌群的多样性,抑制另枝菌属、异杆菌属等有害菌的增殖,促进乳杆菌的增殖,3个剂量的秋葵微粉对调节小鼠肠道健康均有显著效果,其中低剂量更具有实际应用价值。另外,体外胆固醇吸附试验以及体外胆酸盐吸附试验结果提示,秋葵微粉可能具有降血脂的作用,需通过动物试验进一步证实。
参考文献:
[1]Backhed F,Ley R E,Sonnenburg J L,et al. Host-bacterial mutualism in the human intestine[J]. Science,2005,307(5717):1915-1920.
[2]Patrice D C,Nathalie M D. Gut microflora as a target for energy and metabolic homeostasis[J]. Current Opinion in Clinical Nutrition and Metabolic Care,2007,10(6):729-734.
[3]Zhu Q C,Jin Z M,Wen W,et al. Analysis of the intestinal lumen microbiota in an animal model of colorectal cancer[J]. PLoS One,2014,9(3):e90849.
[4]刘 娜. 黄秋葵的综合利用及前景[J]. 中国食物与营养,2007(6):27-30.
[5]Panneerselvam K,Ramachandran S,Sabitha V,et al. Antidiabetic and antihyperlipidemic potential of Abelmoschus esculentus (L.) Moench. in streptozotocin-induced diabetic rats[J]. Journal of Pharmacy and Bioallied Sciences,2011,3(3):397-402.
[6]张 娜. 黄秋葵果胶的提取工艺研究[J]. 安徽农业科学,2012,40(35):17319-17321.
[7]刘怡彤,段振华,马华林,等. 超声波辅助提取黄秋葵多酚和多糖的工艺研究[J]. 食品工业科技,2013,34(21):247-249,253.
[8]方晴霞,金 戈. 黄秋葵中总黄酮的含量测定[J]. 医药导报,2004,23(9):675-676.
[9]李智生,于 萍,劉儒林. 益生元对益生菌影响的实验研究[J]. 潍坊医学院学报,2010,32(4):271-273.
[10]王 宏. 黄秋葵降血脂的功能与作用机理研究[D]. 广州:华南理工大学,2013.
[11]刘雪蕊. 黄秋葵多糖的提取及其降血糖活性研究[D]. 天津:天津科技大学,2017.
[12]张海文,管庆丰,吴科榜,等. 日粮添加黄秋葵粉对肉鸡营养物质消化吸收的影响[J]. 饲料工业,2016,37(22):42-44.
[13]吴佳静,周汉林,荣 光,等. 黄秋葵叶粉对海兰褐蛋鸡盲肠微生物及肠道组织结构的影响[J]. 家畜生态学报,2012,33(3):42-47.
[14]钟希琼,胡文娥,林丽超. 膳食纤维对油脂、胆固醇、胆酸钠和亚硝酸根离子吸附作用的研究[J]. 食品工业科技,2010,31(5):134-136.
[15]朱碧云. 膳食纤维的超微化对小鼠肠道菌群及血脂质水平的影响[D]. 南昌:南昌大学,2010.
[16]李海云,王秀丽. 荔枝壳水不溶性膳食纤维吸附NO-2、胆酸钠的研究[J]. 食品研究与开发,2006,27(8):167-170.
[17]冯雁波,包怡红. 超微粉碎对松仁膳食纤维体外降血糖、降血脂功能的影响[J]. 食品工业科技,2016,37(23):342-346,350.
[18]Kahlon T S,Chapman M H,Smith G E. In vitro binding of bile acids by okra,beets,asparagus,eggplant,turnips,green beans,carrots,and cauliflower[J]. Food Chemistry,2007,103(2):676-680.
[19]任丹丹. 黄秋葵多糖提取纯化及其体外结合胆酸能力和抑制肿瘤活性分析[D]. 广州:华南理工大學,2011.
[20]Savage D C. Microbial ecology of the gastrointestinal tract[J]. Annual Review of Microbiology,1977,31(1):107-133.
[21]Li J,Jia H,Cai X,et al. An integrated catalog of reference genes in the human gut microbiome[J]. Nature Biotechnology,2014,32(8):834-841.
[22]Nsor-Atindana J,Fang Z,Mothibe K J. In vitro hypoglycemic and cholesterol lowering effects of dietary fiber prepared from cocoa (Theobroma cacao L.) shells[J]. Food & Function,2012,3(10):1044.
[23]孙 颖. 小麦麸皮膳食纤维的脱色及超微粉碎加工[D]. 无锡:江南大学,2008.
[24]Zhang N,Huang C H,Ou S Y. In vitro binding capacities of three dietary fibers and their mixture for four toxic elements,cholesterol,and bile acid[J]. Journal of Hazardous Materials,2011,186(1):236-239.
[25]胡 凯. 茶叶功能性成分体外降血脂的机理研究[D]. 广州:华南理工大学,2011.
[26]Zarras P,Vogl O. Polycationic salts as bile acid sequestering agents[J]. Progress in Polymer Science,1999,24(4):485-516.
[27]段 振. 石榴皮不溶性膳食纤维的提取,体外降血脂活性研究及咀嚼片制备[D]. 西安:陕西师范大学,2018.
[28]李德海,杜令娟,康 宁,等. 提取技术对粗毛纤孔菌三萜类化合物制备及体外降血脂作用的影响[J]. 食品科学,2018,39(10):291-297.
[29]刘 睿,潘思轶,刘 亮,等. 高粱原花青素对α-淀粉酶活力抑制动力学的研究[J]. 食品科学,2005,26(9):189-192.
[30]陈菊红,顾正彪,洪 雁. 改性马铃薯渣的功能特性研究[J]. 食品工业科技,2009,30(1):130-133.
[31]郭雅靖,颜梦婷,林圣楠,等. 几种原花青素的降血糖作用及与常见食品原料的结合研究[J]. 食品科学,2017,38(19):156-163.
[32]李 季. 柑橘皮膳食纤维对大鼠降血脂效果的研究[D]. 雅安:四川农业大学,2009.
[33]曾 桥,韦承伯,韩国锋,等. 桑叶茯砖茶多糖的响应面提取工艺优化及其体外抗氧化降血脂作用[J]. 食品工业科技,2018,39(18):193-200.
[34]刘 山,李冬梅,许 喆,等. 裙带菜孢子叶多糖体外降血脂活性的研究[J]. 食品工业,2016,37(11):177-179.