基于激光共聚焦显微技术鉴别小麦矮腥黑穗病菌和光腥黑穗病菌
2020-09-24刘俭俭张建民陈万权刘太国高利
刘俭俭 张建民 陈万权 刘太国 高利
摘要:由小麦矮腥黑穗病菌(Tilletia controversa Kühn)引起的小麦矮腥黑穗病和由小麦光腥黑穗病菌[Tilletia foetida (Walle.) Lindr]引起的小麦光腥黑穗病都是世界性的病害,小麥矮腥黑穗病是一种重要的国际检疫性病害,是麦类黑穗病中危害最大、极难防治的检疫性病害之一,小麦光星黑穗病在我国被列为北京市的检疫对象。采用激光共聚焦显微技术结合染色方法可简便快速区分小麦矮腥黑穗病菌和小麦光腥黑穗病菌,2种病原菌的冬孢子壁分别呈绿色网纹荧光及均匀平滑绿色荧光,检测可在5~7 min完成,为快速区分2种病原菌的冬孢子提供了一种新的方法。
关键词:小麦矮腥黑穗病菌;小麦光腥黑穗病菌;激光共聚焦显微技术;检测方法
中图分类号:S435.121.4+4
文献标志码:A
文章编号:1002-1302(2020)16-0126-04
由小麦矮腥黑穗病菌(Tilletia controversa Kühn)引起的小麦矮腥黑穗病是重要的检疫性病害,病原菌冬孢子可在土壤中存活10年之久,一旦发病,很难防治[1-2]。由小麦光腥黑穗病菌[T. foetida (Walle.) Lindr]引起的小麦光腥黑穗病是一种全球性的麦类黑穗病,被我国划为北京市的检疫对象[3],该病原菌冬孢子在土壤中可存活2年以上,室内干燥情况下可存活20年之久。2种病原菌的冬孢子在形态学上很相似[4],小麦矮腥黑穗病菌在1935年被Young首次鉴定,被认为是光腥黑粉菌和网腥黑粉菌(T. caries)之间的变种,随后被作为一个新物种发表[5]。国内外学者从形态学、生物学及分子生物学方面进行了大量研究工作。小麦矮腥黑穗病菌冬孢子直径为14~22 μm,光腥黑穗病菌冬孢子直径为19~24 μm[6],小麦矮腥黑穗病菌冬孢子形态上网脊较高,孢壁外由1层透明的胶质鞘包围,而光腥黑穗病菌冬孢子光滑无网脊。小麦矮腥黑穗病菌的冬孢子在5 ℃光照条件下约30 d可萌发,而小麦光腥黑穗病菌的冬孢子在15 ℃条件下约需7 d可萌发[4,7]。根据冬孢子自发荧光的特性[8],蔚慧欣等发现,激光共聚焦显微镜下可区分2种病原菌的冬孢子[9]。此外,研究者们还尝试了SCAR(特定序列扩增)、RM-PCR(DNA随机扩增多态性引物介导的不对称复性温度PCR)、Rep-PCR(基因组短重复序列PCR)以及ISSR(简单重复序列间区)等分子检测方法[10-14]。
激光共聚焦显微技术是以普通荧光显微镜为基础,添加激光发射和扫描装置、计算机图像处理系统等,通过光学断层扫描待观察样品,利用三维结构重建等得到荧光图像的一种现代光学显微镜[15],与普通显微镜相比,共聚焦和点扫面技术使图像的分辨率和准确率显著提高,其通过光线来完成对标本的切片,而不是使用传统机械方式,这种方法对标本没有损伤[16]。激光共聚焦显微镜技术具有细胞生物学功能、图像处理功能,激光共聚焦显微技术目前在细胞生物学[17]、植物学[18]等领域被广泛应用。另外,从谷物的胚中分离出的高度保守的麦胚凝集素(WGA)是一种植物凝集素,可特异性识别与结合真菌细胞壁中的几丁质[19],WGA与绿色荧光基团Alexa Fluor 488连接具有很好的荧光标记作用。目前,激光扫描共聚焦显微镜显微技术结合染色技术已被广泛应用于植物体内病原真菌,如玉米瘤黑粉菌(Ustilago maydis),禾草离蠕孢(Bipolaris sorokiniana)和印度梨形孢(Piriformospora indica)[20-22]的检测,其主要优点是可以在细胞内看到标本的三维图像[23]。Gao等曾利用激光共聚焦显微镜观察玉米瘤黑粉菌在玉米花药中的侵染过程[20]。蔚慧欣等曾利用此方法观察小麦矮腥黑穗病菌在小麦体内的侵染过程[24]。本研究应用激光共聚焦显微扫描术,实现了不分离病原菌的冬孢子,直接在小麦病粒内部快速检测和区分小麦矮腥黑穗病菌和小麦光腥黑穗病菌。
1 材料与方法
1.1 材料
1.1.1 供试种子和病原菌 供试小麦种子为东选3号,小麦矮腥黑穗病菌来自美国农业部农业研究院(United States Department of Agriculture,Agricultural Research Service),小麦光腥黑穗病菌源自河南。本试验于2019年5—9月在中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室进行。
1.1.2 主要试剂和仪器 Alexa Flour 488(AF488)标记的麦胚凝集素(wheat germ agglutinin,WGA)购自北京冰达生物科技有限公司,无水乙醇、磷酸盐缓冲液(phosphate buffer saline,PBS,pH值为7.4)购自北京广达恒益科技有限公司。
激光共聚焦显微系统采用高性能的Leica TCS SP8,整个系统主要由1台倒置荧光相差显微镜、1组由半导体激光器、氩离子气体激光器、氦氖离子气体激光器组成的多波长激光器以及1台控制系统运行的工作站构成[25]。
1.2 方法
1.2.1 小麦的种植 小麦种子用30%次氯酸钠表面消毒5 min后用灭菌蒸馏水冲洗3次,放入5 ℃培养箱中春化1个月,直到胚芽鞘长至1~3 cm。将春化好的种子播种于直径20 cm的花盆中,深度3 cm左右,每盆种10株,置于温度为5~10 ℃,24 h全光照的培养箱(LT-36VL,Percival,USA)中生长。拔节期后调节温度为15~20 ℃。
1.2.2 接种的菌悬液制备 用血球计数板在光学显微镜(Laica S6D,德国)下调整小麦矮腥黑穗病菌和小麦光腥黑穗病菌的冬孢子浓度均为1×106个/mL,200 μL/皿将其涂布于2%土壤培养基和水琼脂培养基上,分别置于4、16 ℃和相对湿度50%培养箱中培养至冬孢子萌发,以菌丝长到冬孢子直径的1/2时视为萌发,约70%的冬孢子萌发后用灭菌蒸馏水将菌丝冲洗下来,用紫外分光光度计(TU-1900,China)测得菌丝悬液D600 nm值为0.1~0.2备用。
1.2.3 接种小麦矮腥黑穗病菌和小麦光腥黑穗病菌 待小麦苗长到孕穗期即穗子发育至小麦旗叶全部从倒2叶叶鞘内伸出时用注射器将备用菌丝悬液注射入小麦旗叶与幼穗之间的空腔1 mL,接种频率1次/d,连续接种5 d。
1.2.4 样品染色 待小麦长至抽穗期采集病粒,将其放于无水乙醇中,取病粒加无菌水清洗3遍,用镊子将病粒压碎并离心(12 000 r/min,1 min),去上清。将待测样品置于20~30 μg/mL WGA-AF488染料中染色40~60 min,然后用1×PBS(pH值7.4)冲洗3~5次,并保存在1×PBS中待观察。所有操作均在室温下进行,染色后的样品要避光保存。
1.2.5 镜检观察 将染色后的含小麦矮腥黑穗病菌和小麦光腥黑穗病菌的病粒(小麦籽粒)染液放在凹玻片上,置于20倍激光共聚焦显微镜下观察,选用激发波长488 nm进行光学切片逐层扫描。
1.2.6 分析图像 根据扫描的图像,分析荧光在2种冬孢子表面成像的差异。
2 结果与分析
2.1 小麦矮腥黑穗病菌和小麦光腥黑穗病菌冬孢子的荧光成像
以488 nm的波长激发光对冬孢子进行光学扫描,可分别在波长为510~570、590~680 nm范围内得到相应发射光。小麦矮腥黑穗病菌和小麦光腥黑穗病菌冬孢子均可被WGA-AF488染成绿色(图1)。
2.2 小麦矮腥黑穗病菌和小麦光腥黑穗病菌冬孢子的扫描图片
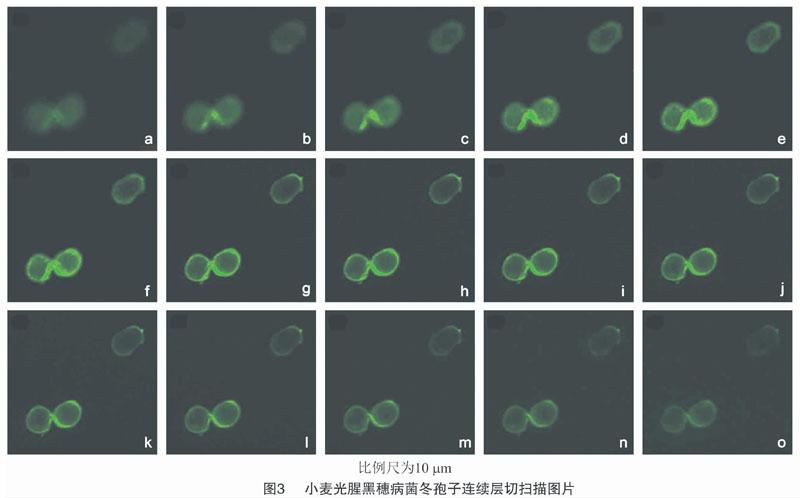
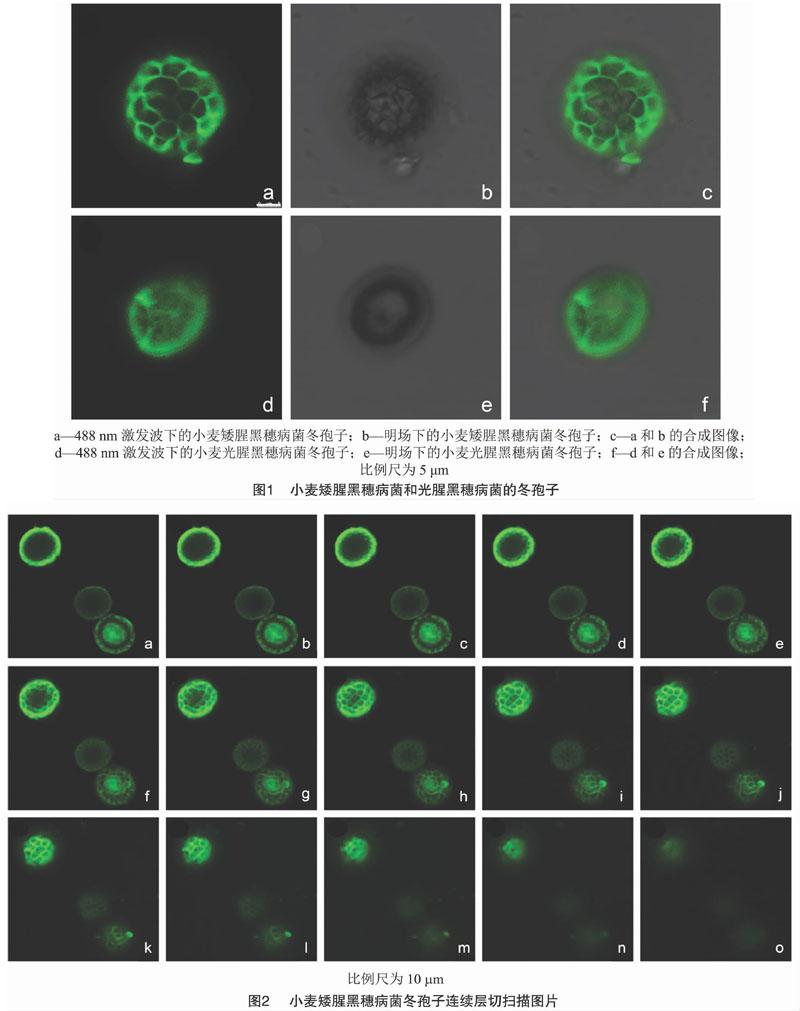
对染色后的小麦矮腥黑穗病菌和小麦光腥黑穗病菌2种冬孢子进行层切扫描,各自获得15张不同层面的连续光学切片扫描图像(图2、图3)。在2种冬孢子中,都能在488 nm的激发波下看到绿色荧光形态清楚,同时在明场下可观察到不同层面的清晰结构。层切扫描显示绿色荧光在这2种冬孢子的空间分布存在明显差异:小麦矮腥黑穗病菌冬孢子的网脊和细胞壁均被染色,光圈直径(22.99±0.29) μm,而小麦光腥黑穗病菌冬孢子显示较为平滑的绿色荧光,光圈直径(16.37±0.33) μm。
3 讨论与讨论
激光共聚焦显微技术以其成像清晰、精确、客观等特点在生物学研究方面广为应用[26]。本试验通过激光共聚焦显微镜来观察WGA-AF 488染色后的小麦矮腥黑穗病菌和小麦光腥黑穗病菌冬孢子,其结果相对基于自发荧光区分的激光共聚焦检测方法[8]更为稳定与准确,该方法可在5~7 min内得到检测结果,为小麦矮腥黑穗病菌和光腥黑穗病菌的快速检测与鉴定提供了快速、准确的方法。
在本研究中使用了几丁质特异性染料WGA-AF488,它与真菌病原体相互作用并释放绿色荧光图像。结果表明,小麦矮腥黑穗病菌冬孢子呈现网纹的绿色,而小麦光腥黑穗病菌冬孢子细胞壁呈现平滑均匀的绿色,进而根据这一特征成功区分2种病原菌的冬孢子(图2、图3)。
基于2种病原菌冬孢子的形态特征,普通光学显微镜及扫描电镜可用于区分2种病原菌的冬孢子[4],基于自发荧光特点,可采用激光共聚焦显微技术区分2种病原菌的冬孢子[9],但是以上的检测方法均要基于分离出大量冬孢子样本才可以进行检测,且冬孢子的自发荧光有强有弱,遇到自发荧光比较弱的时候就很难将二者区分开来。而本研究是用发病的植物组织(小麦籽粒)直接染色病菌冬孢子并进行层扫检测,可观察到植物组织(小麦籽粒)中肉眼看不到的少量冬孢子,进而实现病原菌的快速检测,本方法可为其他类似植物体内病原菌的检测提供可借鉴的思路及方法。
参考文献:
[1]Hoffman J A. Bunt of wheat[J]. Plant Disease,1982,66(11):979-986.
[2]Mathre D E. Dwarf bunt:politics,identification,and biology[J]. Annual Review of Phytopathology,1996,34(1):67-85.
[3]李健强,刘洪斌,刘西莉,等. 5种药剂对小麦光腥黑穗病菌的毒力和孢子萌发形态结构的影响[J]. 农药学学报,2000,2(1):41-46.
[4]Pady S M,Duran R,Fischer G W. The genus tilletia[J]. Mycologia,1961,53(2):213.
[5]Young P A. A new variety of Tilletia tritici in Montana[J]. Phytopathology,1935,25:40.
[6]Wilcoxson R D,Saari E E. Bunt and smut diseases of wheat:concepts and methods of disease management[M]. Mexico:CIMMYT,1996:16.
[7]Meiners J P,Waldher J T. Factors affecting spore germination of twelve species of Tilletia from cereals and grasses[J]. Phytopathology,1959,49(11):724-728.
[8]Stockwell V O. Distinguishing teliospores of Tilletia controversa from those of T. cariesby fluorescence microscopy[J]. Plant Disease,1986,70(10):924-926.
[9]蔚慧欣,高 利,康曉慧,等. 应用激光共聚焦显微扫描技术鉴别小麦矮腥黑穗病病菌和小麦光腥黑穗病病菌冬孢子[J]. 中国植保导刊,2016,36(2):5-8.
[10]Qing Y,Nian S,Yin Y P,et al. Development of a PCR-based diagnostic tool specific to wheat dwarf bunt,caused by Tilletia controversa[J]. European Journal of Plant Pathology,2009,124(4):585-594.
[11]Liu J H,Gao L,Liu T G,et al. Development of a sequence-characterized amplified region marker for diagnosis of dwarf bunt of wheat and detection of Tilletia controversa Kühn[J]. Letters in Applied Microbiology,2009,49(2):235-240.
[12]Zupunski V,Ignjatovic-Micic D,Nikolic A,et al. Identification of Tilletia species using rep-PCR fingerprinting technique[J]. Genetika,2011,43(1):183-195.
[13]Li G,Yu H X,Han W S,et al. Development of a SCAR marker for molecular detection and diagnosis of Tilletia controversa Kühn,the causal fungus of wheat dwarf bunt[J]. World Journal of Microbiology and Biotechnology,2014,30(12):3185-3195.
[14]Gao L,Chen W Q,Liu T G. An ISSR-based approach for the molecular detection and diagnosis of dwarf bunt of wheat,caused by Tilletia controversa Kühn[J]. Journal of Phytopathology,2011,159(3):155-158.
[15]Chuong S D X,Franceschi V R,Edwards G E. The cytoskeleton maintains organelle partitioning required for single-cell C4 photosynthesis in Chenopodiaceae species[J]. The Plant Cell,2006,18(9):2207-2223.
[16]肖艷梅,付道林,李安生. 激光扫描共聚焦显微镜(LSCM)及其生物学应用[J]. 激光生物学报,1999,8(4):305-311.
[17]李林光,王 颖,王玉霞,等. 苹果四倍体品种天星的花粉形态及胚囊发育特征研究[J]. 植物遗传资源学报,2011,12(4):662-666.
[18]任 宏,刘永胜,孙敬三. 用共聚焦扫描显微镜检术观察水稻胚囊发育[J]. 植物学报,1998,40(9):786.
[19]常慧萍,马忠友,唐欣昀. 麦胚凝集素的纯化及其与小麦根际促生细菌的亲和作用[J]. 中国粮油学报,2009,24(11):26-29.
[20]Gao L,Kelliher T,Nguyen L,et al. Ustilago maydis reprograms cell proliferation in maize anthers[J]. The Plant Journal,2013,75(6):903-914.
[21]Wei X N,Shan T L,Hong Y T,et al. TaPIMP2,a pathogen-induced MYB protein in wheat,contributes to host resistance to common root rot caused by Bipolaris sorokiniana[J]. Scientific Reports,2017,7(1):1-15.
[22]Deshmukh S,Hueckelhoven R,Schaefer P A,et al. The root endophytic fungus Piriformospora indica requires host cell death for proliferation during mutualistic symbiosis with barley[J]. Proceedings of the National Academy of Sciences,2006,103(49):18450-18457.
[23]Paddock S W,Eliceiri K W. Laser scanning confocal microscopy:history,applications,and related optical sectioning techniques[J]. Methods of Molecular Biology,2014,1075:9-47.
[24]蔚慧欣,高 利,沈慧敏,等. 小麦矮腥黑粉菌在小麦体内侵染过程的显微观察[J]. 中国科学(生命科学),2016,46(5):637-645.
[25]尚忠林. 共聚焦显微技术简介[J]. 生物学通报,2001,36(12):33-35.
[26]赵启韬,苗俊英. 激光共聚焦显微镜在生物医学研究中的应用[J]. 北京生物医学工程,2003,22(1):52-54.