甲基磺酸乙酯诱变对绿豆种子萌发及幼苗生长的影响
2020-09-24高营闫强袁星星薛晨晨陈新
高营 闫强 袁星星 薛晨晨 陈新


摘要:通过对绿豆甲基磺酸乙酯(EMS)诱变试验,为构建绿豆EMS诱变突变体群体提供参考,在拓宽绿豆的遗传基础、创造和利用新种质等方面具有重要意义。选用苏绿1号绿豆种子为试验材料,利用0、0.4%、0.8%、1.2%、1.6%不同浓度的EMS对绿豆种子进行12 h的诱变,研究不同浓度处理条件下绿豆种子萌发及幼苗生长的影响。研究结果显示,EMS浓度为0.4%处理12 h绿豆种子基本都具有萌发力,而EMS浓度为0.8%处理12 h已经使绝大多数绿豆种子丧失了萌发力;当浓度为0.6%的EMS溶液处理10 h,其萌发率为47.32%,符合半致死剂量,此时绿豆幼苗的株高、根长与对照相比分别降低了42.3%、44.8%。诱变处理后移栽20 d,出现叶片缺失、增加、卷曲皱缩、掌状、叶缘不规则状等表型。由此可见,绿豆的最佳诱变条件为:EMS浓度0.6%,处理时间10 d。
关键词:甲基磺酸乙酯(EMS);诱变;绿豆;种子萌发;半致死剂量
中图分类号:S522.035.2
文献标志码:A
文章编号:1002-1302(2020)16-0104-04
绿豆[Vigna radiata (Linn.) Wilczek]属于豆科(Leguminosae)蝶形花亚科(Papilionaceae)豇豆属(Vigna),染色体组为2n=22[1]。我国是绿豆种植的起源中心之一,在我国种植地域广泛,种植量仅次于绿豆种植大国印度,并且在云南省、广西壮族自治区、山东省、天津市等地均发现有野生绿豆生长[2]。近年来,随着社会经济的发展和人们生活水平的提高,人们对食物多样性和均衡性也有了更高的要求。绿豆因其营养成分丰富、药用价值高而愈来愈受到国内外广大消费者的欢迎。但绿豆进行科学研究的时间较短,对绿豆进行专业研究的人员较少,相比其他作物,绿豆的科研进度相对较慢[3-4]。绿豆进行种质创新和新品种选育,是未来绿豆育种工作者亟需面对和解决的重要问题。甲基磺酸乙酯(EMS)诱变通过诱发等位基因位点上某个或者多个碱基突变的一种化学诱变剂,综合诱变效果较佳。目前,已经在水稻、玉米、油菜、小麦、大豆等作物中广泛应用,对推动作物种质资源创新、作物遗传改良和基因组学研究起到了重要作用[4-5]。如利用EMS溶液處理水稻,成功获得了24份半矮化性状突变体,为水稻矮化育种提供了遗传材料[6];通过EMS诱变构建普通小麦豫农201突变体库,共包含722份突变材料,为小麦功能基因组研究和遗传改良提供了重要基础材料[7]。
不同作物的种子对诱变剂的耐受程度存在巨大差异,因此每种作物所选择的诱变剂量和处理时间很难具有广适性。国内外对绿豆遗传育种及功能基因组学的研究相对水稻等作物明显滞后。因此,明确一种行之有效创制绿豆突变体的方法,可为绿豆优异种质创制、新品种选育以及功能基因组学研究提供技术和材料支撑。本研究通过评价EMS不同浓度和时间诱变处理后绿豆苏绿1号种子萌发和幼苗生长状态,筛选出最佳诱变的条件,为后续大规模构建绿豆EMS突变体库提供指导。
1 材料与方法
1.1 材料
试验材料为苏绿1号,由江苏省农业科学院经济作物研究所豆类作物研究室所提供;化学诱变剂为甲基磺酸乙酯(EMS),从Sigma公司购入。
1.2 绿豆种子诱变处理
1.2.1 EMS溶液配制 取磷酸氢二钠(Na2HPO4·12H2O)21.8 g、磷酸二氢钠(NaH2PO4·2H2O)6.08 g,溶解定容至1 000 mL,用NaOH溶液将pH值微调至7.0。将诱导剂EMS溶于该磷酸缓冲液中,配制成0、0.4%、0.8%、1.2%、1.6%共5个浓度EMS溶液。选择适宜EMS处理浓度0.6%,进行处理时间(分别为0、6、8、10、12 h)对绿豆种子萌发影响的试验。
1.2.2 处理方法 人工挑选饱满的苏绿1号绿豆种子作为诱导剂处理材料,用以对比不同处理条件对萌发率和苗期性状的影响,每个处理约使用200粒种子,用蒸馏水浸泡种子8 h。将浸泡后的绿豆种子放入配制好的EMS溶液中,置于脱色摇床中并在85 r/min 条件下遮光振荡12 h[8]。处理结束后,倒掉容器中EMS溶液,添加5%Na2S2O3缓冲液,置于脱色摇床中冲洗10 min,该清洗步骤重复3次;重复处理结束后,用无菌水继续清洗振荡3次;将不同浓度EMS处理后的绿豆种子置于铺有湿润滤纸的培养皿中,再于25 ℃培养箱中培养3 d后观察萌发情况。EMS最佳处理时间筛选方法“同上”。将诱变处理完毕的种子移栽到含有营养土的种植盆中种植,对植株表型变异进行记录。
1.3 测定方法和指标
观察种子的萌发情况,记录每个处理的发芽数,并计算萌发率。处理后绿豆幼苗移植10 d,测量幼苗的株高、根长,拍照记录
萌发率=供试种子发芽数/供试种子总 数×100%。
1.4 数据处理
采用SPSS 23.0统计软件,对不同处理间种子萌发率、株高、根长等数据进行单因素方差分析,并进行多重比较(LSD),相关图使用Excel制作。
2 结果与分析
2.1 EMS浓度对绿豆种子萌发的影响
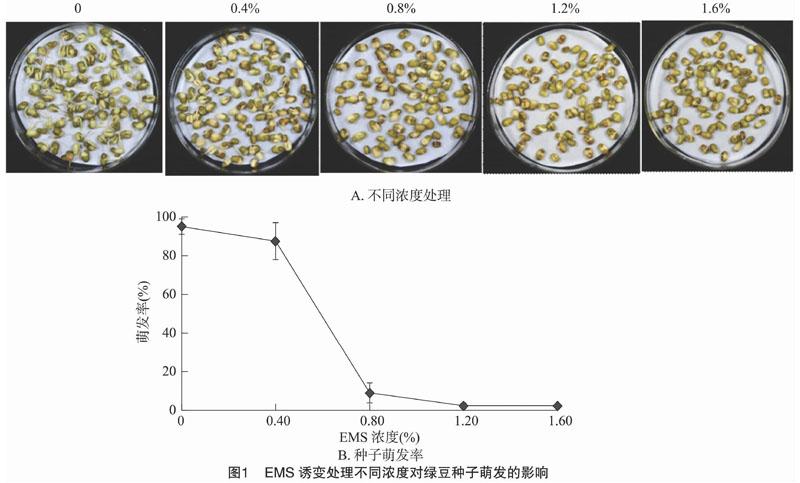
依据其他植物EMS诱导剂浓度和处理时间最佳方案,初步选定EMS浓度0、0.4%、0.8%、1.2%、1.6%(以质量分数计)5个浓度梯度和12 h作为处理条件,观察并记录绿豆种子的萌发情况(图1-A)。结果表明,0.4% EMS处理12 h后绿豆种子萌发速度变慢,但是萌发率和对照相比没有显著降低(P>0.05)。当处理浓度为0.8%时,其发芽率由对照组的95%下降至9%,显著降低了种子萌发率;而用1.2%、1.6% EMS处理种子,发芽率分别为2.35%、2.12%。试验结果表明,EMS浓度为0.4%处理12 h绿豆种子基本上具有萌发活力,而0.8%处理12 h已经使绝大多数绿豆种子丧失了萌发力(图1-B)。因此应进一步选择介于 0.4%~0.8%之间的诱变浓度0.6%进行不同时间的处理分析。
2.2 EMS处理时间对绿豆萌发的影响
以浓度为0.6%的EMS溶液处理绿豆种子, 研究不同处理时间对绿豆萌发及幼苗生长的影响(图2-A)。与对照相比,处理6 h绿豆的萌发率为83.05%。处理8、10、12 h绿豆萌发率分别为64.62%、47.32%、22.09%,且不同处理间存在极显著差异(P<0.01)(图2-B)。表明处理10 h时符合半致死剂量的条件。
2.3 EMS诱变对绿豆幼苗生长的影响
为了明确EMS诱变对绿豆幼苗生长的影响,将处理不同时间后的幼苗进行移栽,在正常环境条件下生长10 d后观察幼苗的生长状态(图3-A)。移栽后10 d,处理6 h株高、根长与对照相比均未表现出显著差异;处理8 h株高比对照降低15.6%,根长缩短36.2%,但与处理6 h差异不显著,与对照差异极显著(P<0.01)。当处理时间为10 h时,株高、根长分别降低了42.2%、44.8%(图3-B、图3-C),此时幼苗真叶展开,未见明显生长异常,继续对幼苗生长状态进行观察,发现移栽20 d后幼苗3出复叶表现出明显的变异表型。与对照相比,处理 10 h 出现叶片缺失、叶片增加、卷曲皱缩、掌状、叶缘不规则状等表型(图4),而处理12 h幼苗生长发育受到严重抑制,萌发的种子极少发育成幼苗。
3 讨论与结论
EMS浓度对绿豆种子萌发率的影响研究表明,EMS溶液处理对绿豆种子的萌发有抑制作用,且浓度越高,抑制作用越明显,该结论与EMS溶液处理广金钱草种子的结果[9]一致。浓度过高或过低均会导致诱变效果不佳,浓度过高绿豆种子发芽率极低。高浓度处理导致种子的萌发机制破坏,产生过多的有害物质,细胞渗透压不平衡,细胞失水导致种子不萌发。
确定种子的EMS诱变半致死剂量,根据设置的不同梯度的浓度和时间观察幼苗的致死率,致死率达到50%左右时为佳[10]。羊草种子的EMS诱变处理以浓度为1.5%、处理时间12 h时的剂量为半致死剂量[11]。EMS诱变处理红小豆的最佳组合为浓度0.7%、处理时间20 h[12]。通过0.6% EMS不同处理时间的试验结果显示,绿豆种子的萌发率与EMS溶液诱变处理时间呈负相关;当处理时间为 10 h 时,萌发率为47.32%,接近半致死剂量,初步断定绿豆诱变的最佳时间为10 h。
EMS诱变处理不同品种的种子,会对其萌发和生长状况造成不同程度的影响[10]。EMS诱导处理油菜种子时,对幼苗的抑制作用要弱于对根的抑制作用[13]。通过对处理后绿豆幼苗的株高、根长、叶形等表型分析可知,随着处理时间的延长,株高降低幅度增加,根长缩短幅度稍不明显,因此EMS诱变对株高的抑制效果强于根长;而且在处理时间为10 h时,出现叶片缺失、叶片增加、卷曲皱缩、掌状、叶缘不规则状等表型,变异类型最为丰富。本研究结果表明,诱变处理对绿豆种子的萌发及幼苗的生长具有抑制作用;EMS诱变处理绿豆种子的最佳条件为:浓度0.6%、处理时间10 h。
参考文献:
[1]陳 新,袁星星,陈华涛,等. 绿豆研究最新进展及未来发展方向 [J]. 金陵科技学院学报,2010,26(2):59-68.
[2]田 茜,张文兰,李 群,等. 绿豆的品质特性及综合利用研究进展[J]. 中国农学通报,2016,32(9):77-82.
[3]温日宇,刘建霞,宋亚静,等. 叠氮化钠对绿豆种子和幼苗生长的诱变效应[J]. 山西农业科学,2017(12):1933-1936.
[4]王丽侠,程须珍,王素华. 绿豆种质资源、育种及遗传研究进展[J]. 中国农业科学,2009,42(5):1519-1527.
[5]刘 翔. EMS诱变技术在植物育种中的研究进展[J]. 激光生物学报,2014,23(3):197-201.
[6]王 峰,徐 飚,杨正林,等. EMS诱变水稻矮生资源的鉴定评价[J]. 核农学报,2011,25(2):197-201.
[7]徐艳花,陈 锋,董中东,等. EMS诱变的普通小麦豫农201突变体库的构建与初步分析[J]. 麦类作物学报,2010,30(4):625-629.
[8]崔 霞,梁 燕,王玲慧. 不同浓度化学诱变剂甲基磺酸乙酯对番茄种子发芽的影响[J]. 北方园艺,2013(14):28-30.
[9]梅凌锋,唐艳梅,唐晓敏,等. 3种化学诱变剂对广金钱草种子萌发的影响[J]. 广东药学院学报,2015,31(3):310-315.
[10]崔清志,刘晓虹,陈惠明. EMS诱变技术研究进展[J]. 湖南农业科学,2013(5):7-9,13.
[11]臧 辉,武自念,孔令琪,等. 甲基磺酸乙酯(EMS)诱变对羊草种子萌发及幼苗生长的影响[J]. 分子植物育种,2018,16(17):5765-5769.
[12]刘建霞,温日宇,刘文英,等. EMS不同处理浓度和时间对红小豆诱变的影响[J]. 山西农业科学,2017,45(5):715-717,721.
[13]原小燕,李加纳,刘列钊. EMS对油菜种子萌发的影响[J]. 西南师范大学学报(自然科学版),2010,35(3):217-221.