降解霉变玉米中黄曲霉毒素B1 的复合益生菌研制
2020-09-21赵闪闪尹清强刘超齐
赵闪闪 周 璞 刘 硕 常 娟 王 平 尹清强* 刘超齐 朱 群
(1.河南农业大学牧医工程学院,河南郑州450046;2.舞钢市畜产品质量检测中心,河南舞钢462599;3.叶县动物疫病预防控制中心,河南叶县467200;4.河南德邻生物制品有限公司,河南新乡453000)
玉米是畜禽饲料中的主要原料之一,在畜禽饲料中所占比例非常高,通常可以达到50%~70%[1]。玉米在生长、收获、储存和运输过程中很容易发生霉变。据联合国粮农组织(FAO)的统计,每年全世界范围内大约有25%的农产品受到霉菌毒素的污染,造成数百亿美元的经济损失。随着我国灾害气候的频频发生,部分真菌毒素呈现污染加重的趋势[2]。玉米霉变后会被霉菌代谢产物——霉菌毒素污染。目前已知的霉菌毒素有300多种,其中对人和动物危害相对严重的有黄曲霉毒素B1(AFB1)、呕吐毒素(DON)、玉米赤霉烯酮(ZEN)[3]。AFB1 毒性最强、分布最广、危害最大、致癌力最强[4-5]。
AFB1对家禽免疫系统造成严重破坏,导致T淋巴细胞亚群减少,降低小肠中细胞因子的mRNA表达[6]。猪摄食AFB1污染饲料会出现采食量减少、体重降低、肝和免疫功能受损,以及血清生化指标的改变[7]。研究表明,肝癌高发区的地理分布与该地区食物被AFB1 污染程度呈正相关[8]。霉菌毒素污染是一个全球性的问题,不仅造成严重的经济损失,而且还关系到动物生产和食品安全,直接影响人类和畜禽的健康。
研究发现,很多种微生物都能抑制黄曲霉的生长和霉菌毒素的产生,如乳酸菌、芽孢杆菌、假单胞菌、短小杆菌、地衣芽孢杆菌等[9]。据报道,Flavobacterium aurantiacum能显著地降低液体培养基中黄曲霉毒素的含量[10]。朱新贵等[11]将枯草芽孢杆菌、乳酸菌和醋酸菌与黄曲霉毒素液体培养60 h后,3种微生物对AFB1 的降解率分别为89%、88%和81%。Swary 等[12]研究证实,酵母细胞壁对霉菌毒素有较高的吸附率。本研究旨在通过将有降解AFB1功能的有益微生物进行高效组合,研究其对霉变玉米中AFB1的降解能力,为提高受霉菌毒素污染玉米的饲用价值提供参考。
1 材料与方法
1.1 试验材料
霉变玉米来自河南省某饲料厂,产朊假丝酵母、枯草芽孢杆菌、干酪乳杆菌、丁酸梭菌均由河南农业大学饲料生物技术实验室保存。
1.2 微生物培养基
MRS培养基:胰蛋白胨15 g、酵母浸粉10 g、葡萄糖20 g、吐温80 1 ml、K2HPO42 g、乙酸钠5 g、柠檬酸铵2 g、硫酸镁0.2 g、硫酸锰0.05 g,水1 000 ml,pH值为6.2~6.6。
LB 培养基:胰蛋白胨10 g、酵母浸粉5 g、氯化钠10 g,水1 000 ml,pH值为7.0~7.2。
YPD培养基:蛋白胨20 g、酵母浸粉10 g、葡萄糖20 g,水1 000 ml,pH值为7.0~7.2。
丁酸梭菌培养基:胰蛋白胨10 g、酵母浸粉3 g、牛肉膏10 g、葡萄糖5 g、氯化钠5 g、乙酸钠3 g、可溶性淀粉1 g、L-半胱氨酸盐酸盐0.05 g,水1 000 ml,pH值为6.8。
上述培养基为固体时需再加入2%琼脂,定容后在121 ℃、0.15 MPa条件下灭菌20 min,备用。
1.3 菌种的活化
将实验室保存的枯草芽孢杆菌接种到LB 液体培养基中,放在37 ℃、180 r/min 的摇床中振荡培养24 h。产朊假丝酵母接种到YPD 培养基中,放在30 ℃、180 r/min的摇床中振荡培养24 h。干酪乳杆菌接种到MRS液体培养基中,37 ℃恒温静置培养24 h。丁酸梭菌接种到丁酸梭菌液体培养基中,37 ℃恒温静置培养48 h。菌种用平板涂布法测定活菌数后统一调整活菌数至1×109CFU/ml,菌种保存于4 ℃冰箱中备用。
1.4 响应面回归试验设计
用Design-Expert 8.0.5 软件中的Central Composite Design进行4因素3水平的设计,将产朊假丝酵母、枯草芽孢杆菌、干酪乳杆菌、丁酸梭菌4个微生物菌种作为设计的4个因素,分别定义为X1、X2、X3、X44个变量。以4 个菌种分别加入霉变玉米后对应活菌数为1×104、1×105、1×106CFU/g 3种水平作为设计的三个编码水平,并延伸了臂长(-r和+r)。试验设计见表1。
1.5 复合微生物菌群对霉变玉米中AFB1 降解的操作流程
按表1组合共有27个处理组,每个处理组3个重复。发酵时称取72 g粉碎的霉变玉米置于1 L的烧杯中,量取27 ml蒸馏水与1 ml复合菌液混合均匀,加入霉变玉米中搅拌均匀,分装到自封袋中,封口机密封,在37 ℃条件下培养4 d。另设1个不接种菌的空白对照组(3个重复)。在第4 d,分别以重复单位称取10 g玉米样品,加入到盛有50 ml 70%甲醇的100 ml 三角瓶中,提取的AFB1用德国拜发试剂盒测定,操作步骤按照说明书进行。
1.6 复合微生物菌群的优化
按Design-Expert 8.0.5软件给出的试验方案进行霉变玉米的生物降解,以复合微生物菌群对霉变玉米AFB1 的降解率作为设计的响应值Y,进行复合微生物菌群的优化。对响应值进行多元回归拟合分析,得出回归方程:Y=β0+β1X1+β2X2+β3X3+β4X4+β12X1X2+β13X1X3+β14X1X4+β23X2X3+β24X2X4+β34X3X4+β11X12+β22X22+β33X32+β44X42+β123X1X2X3+β124X1X2X4+β134X1X3X4+β234X2X3X4+β122X12X2+β132X12X3+β142X1X4+β12#X1X22+β1234X1X2X3X4+β12*X12X22。
式中:Y——预测的毒素降解率(%);
X1、X2、X3、X4——自变量,分别对应产朊假丝酵母、枯草芽孢杆菌、干酪乳杆菌、丁酸梭菌;
β0——截距;
β1、β2、β3、β4——线性系数;
β12、β13、β14、β23、β24、β34、β123、β124、β134、β234、β122、β132、β142、β12#、β1234、β12*——交叉系数;
β11、β22、β33、β44——平方系数。
对方程进行方差分析及拟合度检验,检验结果符合统计学要求后,点击软件Optimization 选项的Numerical优化功能,把Y的响应值选取最大值,利用软件优化得到4种菌的最优组合模式。
1.7 最优菌群组合方式优化与验证
根据1.6节所得的回归方程预测菌群最优组合模式,按1.5 节霉变玉米中AFB1 降解流程进行验证试验,验证试验分为试验组和对照组。分别计算出最优菌群组合模式对霉变玉米中AFB1 的降解率,与预测得到的降解率进行比较,得出相对误差。
1.8 数据统计与分析
试验数据用Microsoft Excel 2003 软件进行初步处理,用SPSS 20.0 软件进行ANOVA 方差统计分析。响应面分析采用Design-Expert 8.0.5软件进行方差分析和作图。试验结果用“平均值±标准差”表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 不同益生菌组合对霉变玉米中AFB1的降解作用
由表2 可知,不同的益生菌组合对霉变玉米中AFB1的降解率不同,最大AFB1降解率组为第12组,达到了50.24%(P<0.05),即产朊假丝酵母、枯草芽孢杆菌、干酪乳杆菌、丁酸梭菌的活菌数分别为1×106、1×106、1×104、1×106CFU/g。
2.2 响应面模型构建及方差分析
把不同微生物组合菌群组合模式对霉变玉米中AFB1 的降解率作为响应值,将试验结果填入响应值列后,利用Design-Expert 8.0.5 软件对模型进行多元四次回归分析:可得出回归方程:Y=38.82-0.14X1+4.62X2+0.86X3-0.86X4+2.84X1X2-1.17X1X3-0.20X1X4-0.74X2X3+3.83X2X4+0.58X3X4-0.24X12+0.54X22-2.46X32-2.05X42-6.02X1X2X3+4.66X1X2X4+0.58X1X3X4+1.15X2X3X4-1.38X12X2+3.45X12X3-2.44X12X4+1.01X1X22-4.93X1X2X3X4-2.54X12X22。对回归方程进行方差分析,结果见表3,该回归模型P>0.05,决定系数R2=0.98,矫正后R2=0.86,表明该模型拟合度较好。

表2 不同益生菌组合对霉变玉米中AFB1的降解率(n=3)
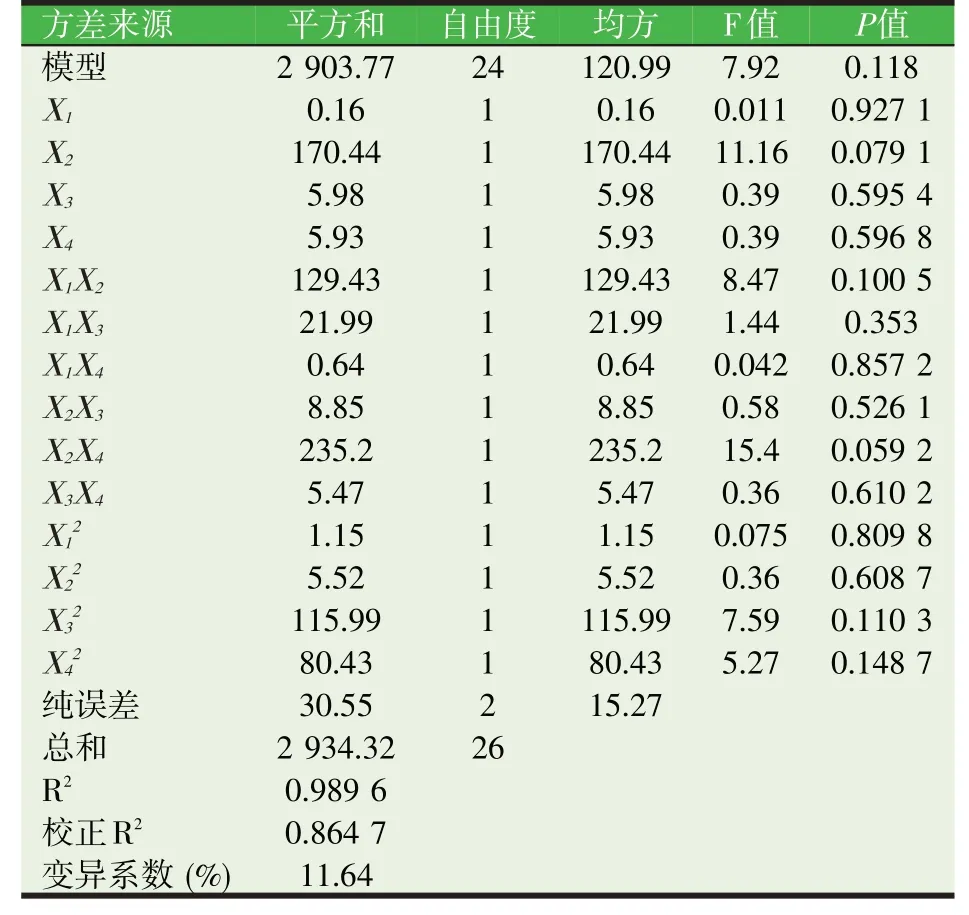
表3 响应值回归方程的方差分析
2.3 最优组合优化与验证
利用Design-Expert 8.0.5 软件分析,预测出霉变玉米中降解率最高的最优益生菌组合水平与12组重叠,换算后接种到发霉玉米中的活菌数分别为1×106、1×106、1×104、1×106CFU/g。在此条件下,经过第二次试验验证霉变玉米中AFB1 的降解率为59.18%,与第一次试验结果很接近,说明通过该响应面模型能较好地预测出复合益生菌对霉变玉米中AFB1 的降解率。
3 讨论
霉菌毒素的脱毒方法包括物理、化学和生物法。物理和化学方法由于存在较多的弊端,很少在生产中应用。生物脱毒法主要包括微生物降解和酶解两种。微生物(乳酸菌、酵母菌、枯草芽孢杆菌等)对霉菌毒素的解毒机理包括发生在菌体内的生化反应、代谢物(包括酶等)的分解作用以及菌体对毒素的吸附作用等[13]。微生物降解霉菌毒素,具有不改变饲料原料本身的营养价值和感官品质,无有害残留和成本低廉的优点,逐渐受到人们的广泛关注[14]。Peltonen等[15]将乳酸菌和一定浓度AFB1 在37 ℃培养24 h 后测定AFB1 的含量,结果表明2 株Lactobacillus amylovorus和1 株Lactobacillus rhamnosus 可以降解50%以上的AFB1。Bluma 等[16]筛选出的多株芽孢杆菌,皆对黄曲霉以及寄生曲霉类的生长有不同程度的抑制作用。研究表明,与益生菌单独培养对霉菌生长的抑制作用相比,益生菌组合对霉菌生长和霉菌毒素的产生具有更好的抑制效果,这可能与菌株的协同作用和培养过程中所产生的复杂产物有关[17]。据报道,当单一的枯草芽孢杆菌与霉变玉米液态共培养时,能较好地降解霉变玉米中的AFB1[18]。目前,关于复合益生菌固态发酵霉变玉米来降解AFB1 的报道不多,本研究获得的益生菌组合,通过降解霉变玉米中的AFB1,可提高霉变玉米的饲用价值,对于饲料资源的开发利用、畜禽健康养殖及畜产品安全生产具有重要意义。
4 结论
通过响应面的回归试验设计,获得了可降解霉变玉米中AFB1的产朊假丝酵母、枯草芽孢杆菌、干酪乳杆菌和丁酸梭菌等益生菌的最佳组合,对霉变玉米中AFB1 的降解达到59.18%,对提高霉变饲料的饲用价值意义重大。
