直喷离子化质谱法快速鉴别粉防己和广防己
2020-09-14张朝辉陈应庄陈波马铭
张朝辉 陈应庄 陈波 马铭

摘 要 采用直喷离子化质谱法,通过对粉防己中的粉防己碱和防己诺林碱、广防己中的马兜铃酸A和木兰花碱的敞开式质谱行为进行研究,获得了粉防己(Stephania tetrandra)及其有毒伪品广防己(Aristolochia fangchi)的敞开式质谱轮廓,建立了直喷离子化质谱法简单快速鉴别粉防己和广防己的方法。结果表明,在正离子模式下,从敞开式质谱轮廓上,可以利用粉防己的标志性成分粉防己碱和防己诺林碱对粉防已和广防己进行快速鉴别。此方法具有简单、快速、无需样品前处理等优点,对防己药材的质量控制具有重要参考价值。研究了马兜铃酸A在敞开式質谱条件下的电喷雾电离行为,对敞开式质谱检测技术分析马兜铃酸A有借鉴意义。
关键词 直喷离子化质谱法; 粉防己; 广防己; 防己诺林碱; 粉防己碱; 木兰花碱; 马兜铃酸A
1 引 言
防己是常用的利水消肿、祛风止痛药,有粉防己(Stephania tetrandra)、广防己(Aristolochia fangchi)、木防己等多种来源,因外观相似,混用现象严重。其中,粉防己为防己科植物粉防己的干燥根,具利水消肿、祛风止痛之功效,含粉防己碱和防己诺林碱等化学成分[1,2]。广防己为马兜铃科植物广防己的干燥根,具祛风止痛、清热利水之功效,含马兜铃酸A和木兰花碱等化学成分[3,4]。粉防己碱、防己诺林碱、马兜铃酸A和木兰花碱的结构式见图1。
因马兜铃酸A会引起人体肾脏损害,因此,广防己被归为“有毒”类中药[5~7]。自2005年起,《中国药典》就只收载了粉防己。但一直以来,广防己在市场上作为粉防己的替代品屡禁不止,因此,建立快速、简单用于粉防己和广防己的鉴别方法至关重要。
粉防己和广防己的传统鉴别方法主要有性状鉴别、显微鉴定或薄层色谱鉴别[8,9],这些方法操作简单,但存在鉴别结果准确度不高的缺点。高效液相色谱法(HPLC)[10]、超高效液相色谱法(UHPLC)[11]、液相色谱-质谱联用法(LC-MS)[12]、超高效液相色谱-电喷雾串联质谱法(UHPLC-ESI-MS/ MS)[3]、高光谱成像[4]等方法对粉防己和广防己能够进行准确鉴别,但这些方法需复杂的样品前处理过程,步骤繁琐,耗时耗力,会损失样品,也会污染环境。
2004年,Cooks课题组[13]提出了电喷雾解吸电离敞开式质谱技术,该技术作为一种在敞开的大气压环境中即可进行的质谱分析技术,具有无需或者只需简单的样品前处理、操作简单快速、可实现样品原位分析等优点,已被广泛应用于食品、医药、环境、生物及公共安全等多个领域的研究[14~20]。直喷离子化质谱技术是一种敞开式质谱技术,具有操作简单、溶剂消耗少、可用于样品直接分析等独特优势,在包括中药研究在内的很多领域得到了广泛应用[21~24],其对于中药的快速鉴定、中药资源的节约和绿色环保具有重要意义。基于直喷离子化质谱技术对粉防己和广防己两种中药材进行快速分析及鉴定的研究目前未见报道。
本研究采用直喷离子化质谱技术,对粉防己中的粉防己碱和防己诺林碱、广防己中的马兜铃酸A和木兰花碱的敞开式质谱行为进行了研究,对粉防己和广防己进行了定性分析和鉴定,获得了粉防己和广防己的敞开式质谱轮廓,提出了将粉防己碱和防己诺林碱作为粉防己标志性成分进行鉴别的方法。本方法简单、快速,对粉防己中药材及其有毒伪品广防己的鉴别具有重要意义。同时,对马兜铃酸A在敞开式质谱条件下的电喷雾电离行为进行了研究,为敞开式质谱检测技术分析马兜铃酸A提供了参考。
2 实验部分
2.1 仪器与试剂
Thermo Finnigan-LCQ离子阱质谱(英国菲尼根公司),配LCQ-tune工作站; 高压直流电源(天津东文高压电源有限公司); LC-20AT 高效液相色谱仪 (日本岛津公司); Milli-Q纯水系统(美国Millipore公司); 高速万能粉碎机(北京市永光明医疗仪器有限公司); KQ3200E型超声波发生器(昆山市超声仪器有限公司)。
马兜铃酸A标准品、粉防己碱标准品和防己诺林碱标准品(中国药品生物制品检定所); 木兰花碱对照品(上海源叶生物科技有限公司); 甲醇为色谱纯,其它试剂为分析纯,购于国药集团化学试剂有限公司; 实验用水为Milli-Q纯水系统制备的超纯水。防己科粉防己、马兜铃科广防己等药材由湖南生物机电职业技术学院藤本所专家提供并进行鉴定,喷雾纸购于美国沃特曼公司。
2.2 实验方法
2.2.1 样品前处理 取广防己0.5 g,置于具塞锥形瓶中,加入70%甲醇25 mL,密塞,称重,超声处理30 min,放冷再称重,用95%的乙醇溶液补足减失的重量,摇匀,过滤,取滤液进行液相色谱分析。
2.2.2 色谱和质谱实验条件 采用ESI离子源正离子模式,扫描范围m/z 100~900; 喷雾电压:+3.50 kV; 毛细管锥孔电压:10 V; 源温度:250℃。二级质谱碰撞能量:粉防己碱和防己诺林碱均为50%,木兰花碱和马兜铃酸A均为30%。
色谱条件:流动相A为0.2% H3PO4,流动相B为乙腈。梯度洗脱程序:0~6 min,20% B; 6~25 min,20%~80% B; 25~30 min,80% B。流速为1 mL/min; 进样量为20 L; 检测波长254 nm。
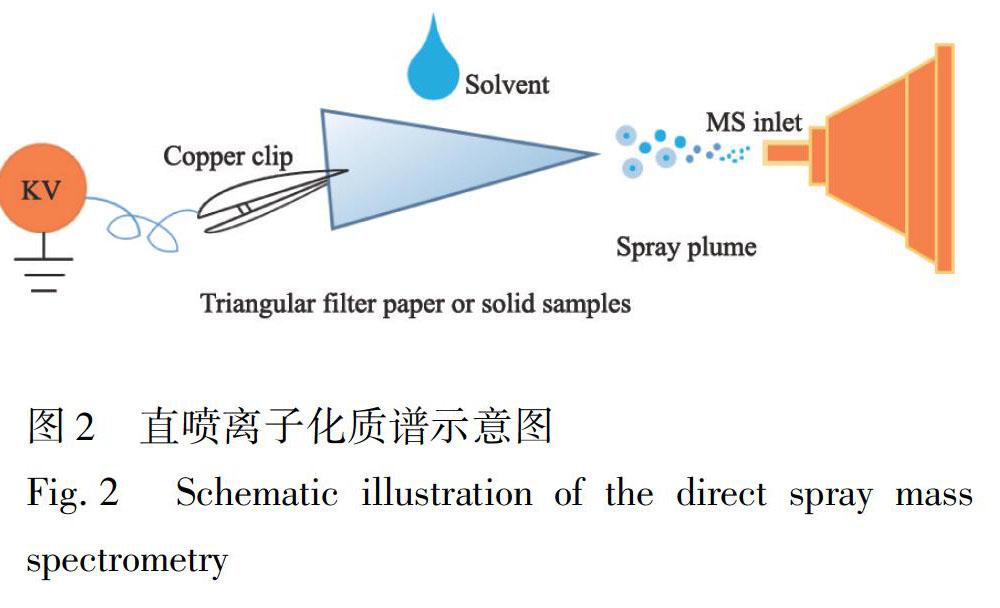
直喷离子化技术分为3个过程:样品装载、分离、离子化,示意图见图2。本研究中涉及的直喷离子化技术包括固体样品和液体样品分析,其中,固体样品如干燥中药材的进样采用直接喷雾方式,先将其裁剪成三角形,然后在其尖端滴加少量溶剂(15 μL甲醇)润湿,施加高压,再用LCQ离子阱质谱进行数据采集。液体样品的进样采用纸喷雾方式。
3 结果与讨论
3.1 粉防己和广防己药材的直喷离子化质谱分析
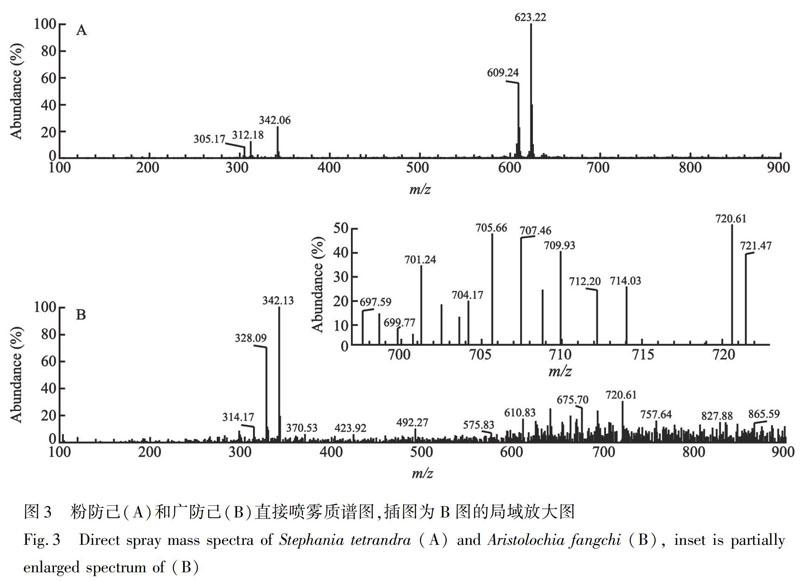
按2.2实验方法中实验条件,对粉防己和广防己两种药材在正离子模式下进行了全扫描质谱分析。在裁剪成三角形的药材上,滴加15 μL甲醇作为溶剂,直接进行喷雾和质谱分析,结果见图3。在粉防己的质谱图(图3A)中可明显观察到m/z 305、m/z 312、m/z 342、m/z 609和m/z 623的峰; 在广防己的质谱图(图3B)中可以明显观察到m/z 328和m/z 342的峰。粉防己和广防己的质谱轮廓存在明显差异。
3.2 粉防己敞开式质谱轮廓中的特征峰m/z 609和m/z 623分析
由文獻[3]可知,粉防己中含有大量双苄基异喹啉类生物碱成分,主要有粉防己碱、防己诺林碱等,根据敞开式质谱轮廓中的质荷比信息,推测粉防己中m/z 609和623峰可能分别为防己诺林碱和粉防己碱,通过一级和二级质谱进行了进一步验证,结果见图4、图5和图6。
由图4可知,防己诺林碱和粉防己碱的质谱峰分别为m/z 609和623。比较图5和图6,两图中m/z 609 峰的碎片情况几乎完全相同,其中m/z 578为基峰,各碎片离子的相对丰度基本一致。两图中m/z 623峰的碎片情况也几乎完全相同,其中m/z 592为基峰,各碎片离子的相对丰度也基本一致,与文献[12]报道相吻合。进一步推测图3A中m/z 305是防己诺林碱的双质子化分子离子峰,m/z 312是粉防己碱的双质子化分子离子峰[25],由此说明,粉防己药材中的m/z 305和609峰为防己诺林碱,m/z 312 和623峰为粉防己碱。通过对30个不同批次粉防己药材和9个不同批次广防己药材进行测定,粉防己药材中的主要质谱峰均为m/z 305、312、342、609和623,广防己药材中的主要质谱峰均为m/z 328和342,而在广防己中未检测到防己诺林碱和粉防己碱的质谱峰m/z 305、312、609和623,说明粉防己药材含有防己诺林碱和粉防己碱,而广防己中不含防己诺林碱和粉防己碱。
3.3 粉防己和广防己敞开式质谱轮廓中特征峰m/z 342分析
从粉防己和广防己敞开式质谱轮廓中可见,二者都含有特征峰m/z 342。文献[3,4]报道广防己中含马兜铃酸A和木兰花碱。马兜铃酸A (C17H11NO7,分子量341.27 )和木兰花碱(C20H24NO+4,分子量342.41)分子量非常接近,为了鉴定m/z 342峰,采用纸喷雾质谱对马兜铃酸A和木兰花碱标准溶液在同样质谱条件下进行了一级质谱分析,结果见图7。
木兰花碱的一级质谱主要谱峰为木兰花碱的分子离子峰[M]+(m/z 342)和二聚体峰[2M-H]+(m/z 683),而马兜铃酸A一级质谱主要谱峰为[M+NH4]+(m/z 358.95)、[2M+NH4]+(m/z 699.76)、[2M+Na]+(m/z 704.83)和[2M+K]+(m/z 720.74)等离子,其中[2M+Na]+离子为基峰,此结果与文献[26,27]的研究结果基本一致,据此可以判断广防己中的特征峰m/z 342不是马兜铃酸A的质谱峰,而可能是木兰花碱的质谱峰。
进一步对两种防己中的特征峰m/z 342和木兰花碱质谱峰进行了二级质谱分析,结果见图8。广防己中的特征峰m/z 342和木兰花碱标准溶液的碎片情况几乎完全一致,都以m/z 297为基峰,且各碎片离子的相对丰度基本一致,说明广防己中的m/z 342.13峰为木兰花碱。Sim等[3]采用UHPLC-ESI-MS/MS证实了广防己中确实含有木兰花碱,但该方法操作繁琐费时,相比之下,本方法简单、快速。同时,比较图8A和图8C可知,粉防己中的特征峰m/z 342不是木兰花碱。具体的归属有待后续进一步研究。研究结果表明,与广防己相比,粉防己中不含木兰花碱或木兰花碱含量极低。
3.4 广防己中的马兜铃酸A成分分析
由于马兜铃酸A具有肾毒性,广防己中马兜铃酸A的检测一直是分析难点,质谱法是常用方法。但是,可能是因为马兜铃酸A的离子化效率低[27~29],难以获得足够的质谱检测灵敏度,采用质谱法检测马兜铃酸A受到很大限制。马兜铃酸A的结构中含有羧基,理论上容易去质子化,生成带负电的阴离子,从而在ESI模式下具有较高的质谱检测灵敏度。但实验发现,马兜铃酸A在ESI模式下产生的响应很低,通常比ESI+模式低103以上[28,29]。而在ESI+模式下,马兜铃酸A结构中没有产生正离子的基团,质子亲和力低,离子化效率也偏低,加上羧基容易碎裂和易产生加合离子等原因,导致了ESI-MS法分析马兜铃酸A难以获得令人满意的灵敏度。
由图7B可知,马兜铃酸A标准溶液在ESI+模式下有明显的加合离子峰,用其中的[2M+NH4]+(m/z 699.76)和[2M+Na]+(m/z 704.83)等加合离子峰应可以对马兜铃酸A进行定量分析。但在广防己的质谱图(图3B)中,在m/z 695~725之间存在很多干扰峰,将m/z 695~725之间的质谱图充分放大(图3B插图),可以发现马兜铃酸A相应的加合离子峰[2M+NH4]+(m/z 699.77)、[2M+Na]+(m/z 705.66)和[2M+K]+(m/z 720.61),但这些加合离子峰均被淹没在噪音信号峰之中,说明广防己中的基质干扰马兜铃酸A,容易造成复杂基质中马兜铃酸A的漏检。文献[28]也报道了马兜铃酸A质谱检测灵敏度低与样品基质的复杂程度有关。
为了进一步考察影响马兜铃酸A质谱响应低的原因,对含马兜铃酸A和木兰花碱均为10 mg/L的混合标准溶液及广防己提取液进行液相色谱和紫外光谱分析,结果见图9。广防己中含有约1.1 mg/g马兜铃酸A和0.9 mg/g 木兰花碱。木兰花碱和马兜铃酸A的混合标准溶液的质谱图见图10,明显可见木兰花碱的分子离子峰[M]+(m/z 342.19)和二聚体峰[2M-H]+(m/z 683.26),其中,分子离子峰[M]+(m/z342.19)质谱响应信号很强。相反,马兜铃酸A质谱响应则相对较弱,通过放大质谱中m/z 350~750间的质谱图(图10B),可见马兜铃酸A的加合离子峰[M+NH4]+(m/z 358.86)、[2M+Na]+(m/z 704.71)和[2M+K]+(m/z 720.91)。因此,相对于木兰花碱的强质谱响应,马兜铃酸A的质谱响应很弱,这主要是因为木兰花碱为季铵碱,在水溶液中即刻解离成正离子,相对离子化效率不高的马兜铃酸A而言,木兰花碱的质谱响应非常强。因此,在木兰花碱存在的情况下,采用质谱检测马兜铃酸A易受到木兰花碱强质谱信号的影响,造成漏检。
综上,在直喷离子化质谱条件下,可利用防己诺林碱和粉防己碱作为标志性成分,快速鉴别粉防己和广防己。虽然广防己含有马兜铃酸A,但由于马兜铃酸A离子化效率低,易受复杂基质如木兰花碱的干扰等,利用直喷离子化质谱无法快速检出广防己中的马兜铃酸A,易造成马兜铃酸A的漏检。今后可在去除干扰和提高马兜铃酸加合离子的直喷离子化质谱灵敏度方面开展更深入的研究。
4 结 论
采用直喷离子化质谱检测技术,在无需样品预处理的前提下,通过对粉防己和广防己药材进行直接喷雾质谱分析,获得其正离子模式下的指纹图谱,并对此条件下马兜铃酸A的电喷雾质谱行为进行了讨论,建立了简单快速鉴别粉防己和广防己的分析方法,成功应用于粉防己与广防己的有效鉴别。本方法简单、快速、准确,样品的平均分析时间在1 min以内,可为粉防己药材的质量控制提供新方法,也为直喷离子化质谱检测技术分析马兜铃酸A提供了参考。
References
1 Yu Y,Hu B,Bao J X,Mulvany J,Bielefeld E,Harrison R T,Neton S A,Thirumala P,Chen Y Y,Lei D B,Qiu Z Y,Zheng Q Y,Ren J H,Perez-Flores M C,Yamoah E N,Salehi P. JARO-J. Assoc. Res. Oto.,2018,19(6): 653-668
2 XING Zhi-Bo,WANG Feng-Mei,WANG Cui-Ping,MU Qiang,WANG Qi-Tang.Chin. J. Exp. Tradit. Med. Form.,2014,20(9): 241-246
邢志博,王凤梅,王翠平,慕 强,王启堂. 中国实验方剂学杂志,2014,20(9): 241-246
3 Sim H J,Kim J H,Lee K R,Hong J. Molecules,2013,18(5): 5235-5250
4 Tankeu S,Vermaak I,Chen W Y,Sandasi M,Viljoen A. Phytochemistry,2016,122: 213-333
5 Debelle F D,Vanherweghem J L,Nortier J L. Kidney Int.,2008,74: 158-169
6 LIANG Qi,NI Cheng,YAN Xian-Zhong,XIE Ming,ZHANG Yan-Xia,ZHANG Qi,YANG Mei-Juan,PENG Shuang-Qing,ZHANG Yu-Zhong. Chin. J. Chin. Mater. Med.,2010,35(21): 2882-2888
梁 琦,倪 誠,颜贤忠,谢 鸣,张艳霞,张 琪,杨美娟,彭双清,张宇忠. 中国中药杂志,2010,35(21): 2882-2888
7 Wang Y,Mamat X,Li Y T,Hu X,Wang P,Dong Y M,Hu G Z. Electroanalysis,2019,31(7): 1390-1400
8 LUO Qiong. Hunan J. Tradit. Chin. Med.,2003,19(3): 52-53
罗 琼. 湖南中医杂志,2003,19(3): 52-53
9 TU Mei-Fang,LI Shui-Fu. Chin. Tradit. Herbal Drugs,2005,36(2): 286-288
屠梅芳,李水福. 中草药,2005,36(2): 286-288
10 Chou C J,Lin L C,Peng C,Shen Y C,Chen C F. J. Chin. Med.,2002,13(1): 39-48
11 Kim J H,Sim H J,Lee K R,Hong J. Bull. Korean Chem. Soc.,2013,34(3): 975-978
12 Koh H L,Wang H,Zhou S,Chan E,Woo S O. J. Pharm. Biomed. Anal.,2006,40(3): 653-661
13 Takats Z,Wiseman J M,Gologan B,Cooks R G. Science,2004,306(15): 47l-473
14 Lu H Y,Zhang H,Chingin K,Xiong J L,Fang X W,Chen H W. TrAC-Trends Anal. Chem.,2018,107: 99-115
15 Tang F,Guo C G,Ma X X,Zhang J,Su Y,Tian R,Shi R,Xia Y,Wang X H,Ouyang Z. Anal. Chem.,2018,90(9): 5612-5619
16 Feng B S,Zhang J L,Chang C L,Li L P,Li M,Xiong X C,Guo C G,Tang F,Bai Y,Liu H W. Anal. Chem.,2014,86(9): 4164-4169
17 ZHANG Xing-Lei,ZHANG Hua,WANG Xin-Chen,HUANG Ke-Ke,WANG Dan,CHEN Huan-Wen. Chinese J. Anal. Chem.,2018,46(11): 1703-1713
张兴磊,张 华,王新晨,黄科科,王 丹,陈焕文. 分析化学,2018,46(11): 1703-1713
18 ZHU Teng-Gao,HAN Jing,SHU Jun-Wen,KE Mu-Fang,WANG Dan,LIU Wen-Jie,LIN Nian-Xiang,CHEN Huan-Wen. Chinese J. Anal. Chem.,2018,46(3): 400-405
朱腾高,韩 京,舒俊文,柯牡芳,王 丹,刘文杰,林年香,陈焕文. 分析化学,2018,46(3): 400-405
19 ZENG Kai,CHEN Huan-Wen,LUO Ming-Biao,ZHANG Hui,YU Wen-Ting. Chinese J. Anal. Chem.,2019,47(3): 429-438
曾 凯,陈焕文,罗明标,张 慧,余文婷. 分析化学,2019,47(3): 429-438
20 Thomas P F,Edward S. Analyst,2018,143(9): 1948-1969
21 Liu X M,Gu Z X,GUO Y,Liu J J,Ma M,Chen B,Wang L P. J. Pharm. Biomed. Anal.,2017,137: 204-212
22 ZHANG Zhao-Hui,GU Zhi-Xin,LIU Jing-Jing,CHEN Ying-Zhuang,CHEN Bo,MA Ming. Chinese J. Anal. Chem.,2017,45(8): 1143-1148
張朝辉,谷陟欣,刘婧靖,陈应庄,陈 波,马 铭. 分析化学,2017,45(8): 1143-1148
23 Liu J J,Gu Z X,Yao S Z,Zhang Z H,Chen B. J. Pharm. Biomed. Anal.,2016,124: 93-103
24 Liu J J,Wang H,Cooks R G,Ouyang Z. Anal. Chem.,2011,83(20): 7608-7613
25 Chen J F,Zhao Q,Si D D,Nie A Z,Wang Y Y,Deng Z F,Wen Y B,Chen F M,Zhang L,Dong B W,Yang J H. J. Pharm. Biomed. Anal.,2020,185: 1-16
26 Yuan J B,Liu Q,Wei G B,Tang F,Ding L,Yao S Z. Rapid Commun. Mass Spectrom.,2007,21(14): 2332-2342
27 Chan S A,Chen M J,Liu T Y,Fuh M R,Deng J F,Wu M L,Hsieh S J. Talanta,2003,60: 679-685
28 Kite G C,Yule M A,Leon C,Simmonds M S J. Rapid Commun. Mass Spectrom.,2002,16(6): 585-590
29 Chan C K,Pavlovic N M,Chan W. Food Chem.,2019,289: 673-679