四电极系统下辅酶Q10在氧化锌纳米棒修饰电极上的光电检测
2020-09-14罗贵铃牛燕燕邵波张晓萍赵常志孙伟
罗贵铃 牛燕燕 邵波 张晓萍 赵常志 孙伟

摘 要 采用电沉积法制备了ZnO纳米棒修饰氧化铟锡(ITO)电极(ZnONR/ITO),利用四电极系统建立了一种高灵敏检测辅酶Q10(UQ10)的光电化学分析新方法。利用玻碳电极为第二工作电极,将溶液中UQ10预还原为UQ10H2,可作为电子供体在ZnONR/ITO上发生氧化反应,电子跃迁至导带后,光电流降低,进而用于检测UQ10。对电沉积ZnO纳米棒和光电化学检测条件进行了优化,在最优测定条件下,UQ10浓度的对数与光电流成反比,线性检测范围为1.0×1012~1.0×105 mol/L,检出限为3.3×1013 mol/L(S/N=3)。
关键词 辅酶Q10; 光电化学分析; 四电极系统; 氧化锌纳米棒
1 引 言
光致电化学(PEC)分析通常是借助具有光电响应的纳米材料修饰电极,以具有氧化还原性质的小分子化合物(如抗坏血酸、多巴胺和过氧化氢)作为电子受体或电子供体,建立对被测物质敏感的PEC分析系统[1,2],目前已广泛应用于蛋白质、免疫、DNA等生化分析领域[3~6]。例如,郑晨琰等[7]通过电沉积和水热法在氟掺杂SnO2导电玻璃(FTO)表面修饰纳米金(AuNPs)和三氧化钨(WO3),制备WO3/AuNPs/FTO,用于自来水和维生素B12中Co2+的检测。Zhu等[8]制备了三维CdS纳米片包裹的碳纤维骨架光电极,用于PEC免疫分析检测利钠肽的含量。Li等[9]利用AuNPs敏化的垂直排列的板状WO3修饰光电极,用于食用酒中乙醇含量的PEC检测。
辅酶Q(Coenzyme Q)又称泛醌(Ubiquinone,UQ),广泛存在于生物膜中,是一类含不同长度聚异戊烯侧链的醌类化合物的总称[10]。根据UQ侧链异戊烯单位的数目不同,其命名也不同,人类和哺乳动物含有的是10个异戊烯单位的UQ,称为UQ10。人体中UQ10主要来源于生物合成以及饮食摄入,广泛分布在人体组织中,尤其是线粒体的内膜中,从而影响内膜的流动性和渗透性。在线粒体电子传输链和氧化磷酸化生成ATP的过程中,UQ10是必不可少的电子载体,具体作用机制为:UQ10可接受两个氢,并获得两个电子,生成还原型UQ10(UQ10H2),进而参与体内的各种氧化还原反应。UQ10H2还可将所含的一个氢原子传递给自由基,将自由基还原,自身被氧化为半还原态; 被氧化的UQ10再经过酶催化作用,恢复为还原态[11~13]。同时,UQ10在维持细胞氧化还原状态中起关键作用,具有抗氧化、抑制自由基的作用[14]。缺乏UQ10可能引起心力衰竭、高血压、神经退行性疾病和糖尿病等疾病,因此检测UQ10的含量至关重要。目前,测定UQ10的方法主要有高效液相色谱法和质谱法[15]等,这些方法能够有效地进行UQ10的定性和定量分析,但存在设备昂贵、灵敏度低、操作复杂、成本高等缺点,因此,亟需建立设备简单、灵敏度高的快速检测UQ10的方法。
纳米ZnO的禁带宽度为3.37 eV,具有电荷传输快、制备成本低、光电性能好等优点,并能在生长高质量单晶衬底的同时进行同质外延,广泛应用于压电材料、气体传感和生物传感器等领域[16~20]。ZnO纳米材料的可控生长是实现其性能调控和实际应用的基础,已报道的ZnO纳米材料包括纳米棒[20]、纳米线[21]、纳米管阵列[22]和空心纳米球[23]等,其中,ZnO纳米棒(ZnONR)具有合成成本低、无毒、电子通路大、表面积大和电子传输率高等优良性能,已被用于构建PEC生物传感器[24~26]。Kang等[24]在还原石墨烯层(rGO)上直接合成ZnONR阵列,ZnO/rGO基光阳极用于谷胱甘肽的自供电PEC生物传感研究,检测线性范围为10~200 mmol/L,检出限为2.17 mmol/L,表现出良好的选择性、可重复性和稳定性。韩志钟等[26]在导电玻璃表面利用水相法制备ZnO纳米花-棒立体结构作为电极,固定探针基因制得ZnO纳米花-棒立体结构基PEC生物传感器,并用于无标记检测DNA。
本研究以UQ10作为电子供体设计PEC反应系统,构建了一种基于四电极系统的PEC分析平台。四电极系统中,通过UQ10在第二工作电极(玻碳电极)表面预还原成UQ10H2,并作为第一工作电极(ZnONR/氧化铟锡导电玻璃,ZnONR/ITO)的电子供体而被氧化,电子跃迁至导带,从而降低了光电流信号,通过光电流的降低值与UQ10浓度的关系,实现对UQ10的定量分析。
2 实验部分
2.1 仪器与试剂
CHI 832B型双通道电化学工作站(上海辰华仪器有限公司); PEAC 200A型光电化学反应仪(天津艾达恒晟科技发展有限公司,激發光波长为365 nm); 以ITO导电玻璃(8.0 mm×5.0 cm,深圳南玻集团伟光公司)为基底制备的ZnONR/ITO作为第一工作电极,Ag/AgCl电极(饱和KCl溶液)为参比电极,铂丝为对电极,玻碳电极(GCE,直径3.0 mm)为第二工作电极(还原电极),组成四电极工作系统; JSM-7100F扫描电子显微镜(SEM,日本电子株式会社)。
Zn(NO3)2·6H2O、无水乙醇(EtOH)和UQ10(阿拉丁(上海)试剂有限公司); LiClO4(成都化工试剂厂); 0.1 mol/L 磷酸盐缓冲溶液(PBS)为支持电解质; 其它试剂均为分析纯。实验用水为超纯水。
2.2 ZnONR/ITO的制备
采用电沉积的方法制备ZnONR/ITO[27]。将ITO导电玻璃依次在丙酮、乙醇和超纯水中各超声清洗15 min,氮气吹干后,在一端留出约1.0 cm作为电极的端子,在另一端表面留出长度为5.0 mm的空白作为ITO电极的工作面,其它部分用绝缘胶带封住。采用三电极体系镀膜,电解液的组成为2.5~5.0 mmol/L Zn(NO3)2和0.1 mol/L KCl,以ITO导电玻璃为工作电极,Pt板为对电极,Pt丝为参比电极,恒温60℃,设置Pt板的电极电势为1.20~1.50 V,沉积时间设置为1500~5000 s,记录时间-电流曲线,电沉积完成后,用超纯水洗去表面吸附的杂质,干燥后即得到ZnONR/ITO。
2.3 实验方法
采用四电极双通道系统,ZnONR/ITO为第一工作电极,GCE为第二工作电极。将GCE的还原电位设定为0.35 V,ZnONR/ITO的偏压为0.1 V,以0.5 mol/L LiClO4-EtOH-PBS混合液为支持电解质。考察ZnONR/ITO的基线电流稳定性,GCE活化60 s后,以40 s为一个循环单位控制光电化学反应仪光闸的开/关,记录空白光电流曲线。然后向电解池中加入40 μL 1.0×103 mol/L UQ10溶液,电解液的总体积为4.0 mL。采用上述相同的方法,记录样品的电流-时间曲线,以样品和空白光电流的差值定量检测UQ10。
3 結果与讨论
3.1 四电极系统的测试原理和电解池的构造
UQ10分子结构中存在共轭双键,具有良好的电化学活性。由于UQ10的氧化电位低于氧的还原电位[28],在水溶液中,UQ10通常以氧化态存在,无法作为电子供体,在光激发的ZnONR/ITO上失去电子发生PEC反应。因此,必须借助于第二工作电极将UQ10还原,继而才能被光激发的ZnONR氧化而产生光电流。四电极系统示意图和四电极电解池如图1所示。在四电极工作模式下,两个工作电极的电位可分别设定,输出电流可分别观察记录。
3.2 ZnONR/ITO的表征
采用SEM对ZnONR/ITO的形貌进行表征。如图2所示,在最优电沉积条件下,制备的ZnONR呈六棱棒状,均匀地生长在ITO电极表面,纳米棒的六棱柱直径约320 nm。
3.3 ZnO纳米棒电沉积条件
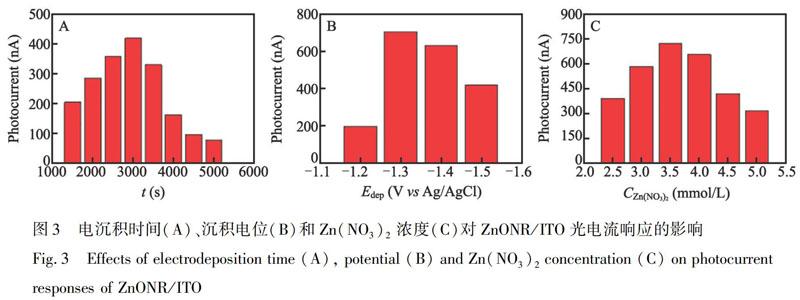
考察了电沉积时间(t)、沉积电位(Edep)和Zn(NO3)2浓度(C)对制备ZnONR/ITO的光电流(Photocurrent)响应的影响,结果如图3所示。在电解液Zn(NO3)2溶液的初始浓度为3.5 mmol/L、电沉积电位为1.30 V和电沉积时间为3000 s条件下,制得ZnONR/ITO的光电响应最好。实验过程中发现,过长的沉积时间、过低的沉积电位或较高的Zn(NO3)2浓度,都会导致沉积层过厚,在长时间的光电测试过程中,会有明显的脱落现象,导致修饰电极ZnONR/ITO的稳定性降低; 而过短的沉积时间或过低的沉积温度,又会导致ITO表面沉积的ZnONR柱高过低,光电流响应极弱。
3.4 UQ10的电化学行为
采用GCE为工作电极,Ag/AgCl电极为参比电极,铂丝为对电极的三电极系统,考察UQ10的电化学行为。由于UQ10水溶性较差,加入EtOH以改善UQ10的溶解度; LiClO4是水和非水溶液共用的支持电解质,选择LiClO4-EtOH-PBS作为电解液。取1.0×105 mol/L UQ10和1.0 mol/L LiClO4-EtOH-PBS混合液于电解池中,记录循环伏安(CV)曲线,如图4A所示,通过CV图确定了UQ10还原电位区间。UQ10在GCE表面0.30 V开始发生还原,0.45 V完成还原反应。本研究引入GCE作为第二工作电极,进一步采用四电极系统考察还原电位(Ered,0.5~ 0.1 V)对光电流响应的影响,结果如图4B所示,可见在GCE上的最佳还原电位为0.35 V。
3.5 ZnONR/ITO对UQ10的PEC响应
采用计时电流法考察了ZnONR/ITO对UQ10的PEC响应,结果如图5所示。在0.5 mol/L LiClO4-EtOH-PBS溶液中,ZnONR/ITO的光电流值为800 nA(图5曲线a); 而在含2.0×105 mol/L UQ10的0.5 mol/L LiClO4-EtOH-PBS溶液中,ZnONR/ITO的光电流值为301 nA(图5曲线b),说明UQ10的存在减弱了ZnONR/ITO的PEC响应。随着实验的进行,GCE上的还原电流(图5曲线c)均比较稳定,说明GCE对UQ10有电化学响应,在0.35 V电位下,能够很好地将UQ10还原为UQ10H2。
推测此反应的机理如图6所示,ZnONR受到光的激发后,外层电子从价带跃迁至导带,电子转移到半导体电极从而产生光电流(图6A)[29,30]; UQ10经过第二工作电极GCE还原后形成UQ10H2,电子转移到半导体电极的导带,从而降低了光电流(图6B)。通过测量光电反应的电信号的变化,对底物实现快速检测。
3.6 UQ10光电响应条件优化
UQ10的还原过程与电解液的pH值有关,进而会影响PEC响应。设置第一工作电极偏压为0.10 V,第二工作电极的还原电位为0.35 V,考察不同pH值(6.0~8.0)对光电响应的影响。采用计时电流法分别以不同pH值的含2.0×105 mol/L UQ10的0.5 mol/L LiClO4-EtOH-PBS和0.5 mol/L LiClO4-EtOH-PBS为电解液,以光电流响应差值表征不同pH值对UQ10还原反应的影响(图7A),并进一步考察电解质中PBS体积(V)对UQ10光电响应的影响(图7B),当pH=6.5,PBS加入量为400 μL时,电解质体系中酸碱度适中,既能提供足够的质子参与反应,也能保持光电信号稳定。
ZnONR是一种具有光电活性的无机纳米材料,其电子状态受电极电位的影响,考察偏压(Ebias)对光电响应的影响(图7C)。在0.5 mol/L LiClO4-EtOH-PBS(含2×105 mol/L UQ10)混合液中,当偏压为0.1 V时,光电流响应最大。设置偏压为0.10 V,考察激发光强度对光电流响应的影响(图7D),在实验过程中,通过改变光程(s)调整光强度。随光程的增大,光电流强度显著增强,在7 cm(对应的光照强度为316 μW/cm2)时达到最大值; 随着光程继续增大,光电流逐渐减小,说明光强对光电响应有显著影响。这是由于过长的光程导致光照强度降低,从而使ZnONR受光照产生电子-空穴对的效率降低,光电流下降。
3.7 ZnONR/ITO对UQ10的光电流响应
在最优的实验条件下,分别测定ZnONR/ITO在不同浓度UQ10(C)的0.5 mol/L LiClO4-EtOH-PBS混合液中的光电流响应(图8A),发现随着UQ10浓度增加,光电流逐渐减小。由图8B可知,光电流响应在1.0×107 mol/L UQ10时出现拐点后下降趋势渐缓。UQ10的浓度在1.0×1012~1.0×105 mol/L范围内,其浓度的对数与光电流呈良好的线性关系,线性回归方程为I(nA)=64.28 lg(C (mol/L))-230.0(R2=0.998),检出限為3.3×1013 mol/L(S/N=3)。与文献报道的检测UQ10方法(表1)相比,本方法的检出限低于色谱法和光学法。
3.8 常见干扰物质对光电流的影响
在最佳的实验条件下,考察了常见共存物质对UQ10光电流响应的影响,结果见表2。在2.0×106 mol/L UQ10的0.5 mol/L LiClO4-EtOH-PBS混合液中,当允许误差<5%时,等浓度的黄素腺嘌呤二核苷酸(FAD)和维生素K3(VK3)会明显干扰UQ10的测定; Fe3+、K+、Cl、Zn2+、NO3和丙氨酸不会干扰测定。这是由于FAD和VK3与UQ10的还原电位相近,还原后,电子跃迁到半导体的导带上,光电流响应增强,干扰UQ10的测定; 其它无机离子和氨基酸与UQ10的还原电位差距大,因此不会产生干扰。
3.9 ZnONR/ITO光电极的重现性和稳定性
连续8次测定同一浓度的UQ10后,GCE的还原电流无明显波动,表明第二工作电极GCE在还原UQ10时没有产生钝化。平行制备5支工作电极,测定相同浓度UQ10光电流响应的RSD<1.7%。ZnONR/ITO在干燥避光的环境下保存10天后,对同浓度的UQ10的光电流响应减小0.8%; 保存20天后,光电流的响应为初始光电流的81%。结果表明,ZnONR/ITO具有良好的稳定性,说明电化学沉积法在ITO电极表面制备ZnONR过程中具有独特优势,并且ZnONR/ITO对UQ10的定量分析具有良好的稳定性。
3.10 实际样品分析
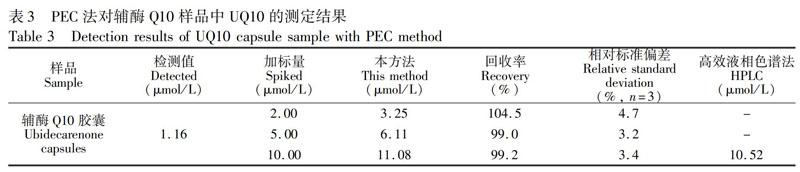
将ZnONR/ITO用于辅酶Q10胶囊(上海衡山药业有限公司)的定量检测。取3粒辅酶Q10胶囊的内容物,混匀,称取250 mg内容物,在40 mL无水乙醇中超声处理10 min,然后将混合物离心分离,取上清液,用乙醇定容至100 mL。进一步取0.5 mL 样品溶液稀释并定容至10 mL,制得辅酶Q10胶囊样品液。取40 μL样品液,注入电解池(总体积为4.0 mL)中进行光电检测,采用标准加入法计算回收率,结果见表3,回收率在99.0%~104.5%之间。利用高效液相色谱法检测辅酶Q10胶囊样品中的UQ10含量[34],与PEC检测结果相近。结果表明,此四电极系统光电传感器可用于辅酶Q10胶囊样品中UQ10的含量分析。
4 结 论
采用电沉积的方法,将具有光电活性的ZnONR修饰在ITO电极表面,成功制备了ZnONR/ITO,此修饰电极同时具有光敏性和电子受体的功能,可大大提高光电转换的效率。利用四电极双通道电化学系统,以第二工作电极GCE作为还原电极,在0.35 V的电位下,可将溶液中的UQ10还原为UQ10H2,基于此建立了高灵敏检测UQ10的新方法。本方法的检测范围为1.0×1012~1.0×105 mol/L,检出限为3.3×1013 mol/L。
References
1 Shu J,Tang D P. Anal. Chem.,2020,92(1): 363-377
2 ZHANG Zhao-Xia,ZHAO Chang-Zhi. Chinese J. Anal. Chem.,2013,41(3): 436-444
张兆霞,赵常志. 分析化学,2013,41(3): 436-444
3 Zhang X R,Guo Y S,Liu M S,Zhang S S. RSC Adv.,2013,3(9): 2846-2857
4 Zhao Y,Gong J,Zhang X B,Kong R M,Qu F L. Sens. Actuators B,2018,255: 1753-1761
5 Zhao C Z,Liu L C,Ge J Y,He Y Y. Microchim. Acta,2017,184(7): 2333-2339
6 Xu R,Jiang Y D,Xia L,Zhang T X,Xu L,Zhang S,Liu D L,Song H W. Biosens. Bioelectron.,2015,74: 411-417
7 ZHENG Chen-Yan,LI Bai-Chuan,CHEN Xiao-Mei,CHEN Xi. Chinese J. Anal. Chem., 2020,48(3): 371-377
郑晨琰,李百川,陈晓梅,陈 曦. 分析化学,2020,48(3): 371-377
8 Zhu Y C,Li Z,Liu X N,Fan G C,Chen H Y. Biosens. Bioelectron.,2019,148: 111836
9 Li B C,Chen Y F,Peng A H,Chen X M,Chen X. J. Colloid Interf. Sci.,2019,537: 528-535
10 REN Yan-Gang,BAI Guang-Jun,SONG Yu-Qi,WEI Hong-Ping. Bull. Biology,2016,51(2): 59-62
任衍钢,白冠军,宋玉奇,卫红萍. 生物学通报,2016,51(2): 59-62
11 Offermanns S,Rosenthal W. Coenzyme Q10 M. Encyclopedia of Molecular Pharmacology. Berlin,Heidelberg; Springer Berlin Heidelberg. 2008: 380-381
12 Isobe C,Abe T,Terayama Y. J. Neurol.,2010,257(3): 399-404.
13 Maali N A E,Berg H. Electroanalysis,2010,8(8-9): 808-812
14 Bentinger M,Tekle M,Dallner G. Biochem. Biophys. Res. Commun.,2010,396(1): 74-79
15 Galinier A,Carrière A,Fernandez Y,Bessac A M,Caspar-Bauguil S,Periqueb T,Comtat M,J Thouvenot P,Casteilla L. FEBS Lett.,2004,578(1-2): 53-57
16 Arya S K,Saha S,Ramirez-Vick J E,Gupta V,Bhansali S,Singh S P. Anal. Chim. Acta,2012,737: 1-21
17 Yang P,Yan H,Mao S,Russo R,Johnson J,Saykally R,Morris N,Pham J,He R,Choi J H. Adv. Funct. Mater.,2010,12(5): 323-331
18 Hegazy M A,Elhaes S H,El-Khodary S A,Morsy M,Yahia I S,ZahranN H Y,Alfaify S,Ibrahim M A. Sensor Lett.,2018,16(1): 71-75
19 Syafinaz R N,Khairunisak A R,Lockman Z. Solid State Phenom.,2019,290: 280-285
20 Tam K H,Cheung C K,Leung Y H,Djurisic A B,Ling C C,Beling C D,Fung S,Kwok W M,Chan W K,Phillips D L. J. Phys. Chem. B,2006,110(42): 20865-20871
21 Kilic B. J. Mater. Sci. Mater. Electron.,2019,30: 3482-3487
22 Yu Q,Lin R,Jiang L,Wan J,Chen C. Sci. China Mater.,2018,61(7): 1007-1011
23 He X,Yue C,Zang Y,Yin J,Sun S,Li J,Kang J. J. Mater. Chem. A,2013,1(47): 15010
24 Kang Z,Gu Y S,Yan X Q,Bai Z M,Liu Y C,Liu S,Zhang X H,Zhang Z,Zhang X J,Zhang Y. Biosens. Bioelectron.,2015,64: 499-504
25 Lee C T,Chiu Y S,Ho S C,Lee Y J. Sensors,2011,11(5): 4648-4655
26 HAN Zhi-Zhong,LUO Min,CHEN Jing-Hua,LI Chun-Yan. China Patent,CN105241937A,2016
韩志钟,罗 敏,陈敬华,李春艳. 中国专利,CN105241937A. 2016
27 ZHENG Zhong-Hua,LIN Jian-Ping,SONG Xiao-Hui,XIONG Jian-Hui. Semiconduct. Optoelectron.,2019,40(3): 385-389
郑中华,林建平,宋孝辉,熊建辉. 半导体光电,2019,40(3): 385-389
28 Michalkiewicz S. Bioelectrochemistry,2008,73(1): 30-36
29 Sun B,Ai S. Prog. Chem.,2014,26(5): 834-845
30 HE Yan-Yan,GE Jun-Ying,ZHAO Chang-Zhi. Chem. J. Chinese Universities,2016,12: 2144-2149
何艳艳,葛军营,赵常志. 高等学校化学学报,2016,12: 2144-2149
31 Yamashita S,Yamamoto Y. Anal. Biochem.,1997,250(1): 66-73
32 Tripodi V,Flor S,Contin M,Lucangioli S. J. Liq. Chromatogr. Relat. Technol.,2009,32(6): 860-873
33 Karpie S J,Mikou B E,Piotrowsk-Jastrzbska J. J. Pharmaceut. Biomed. Anal.,1998,17(8): 1345-1350
34 L Si-Min,ZHANG Li-Ting,HE Xiao-Bing,DING Hong-Yan,TIE Wu. Guangzhou Chem. Ind.,2019,47(22): 101-104
呂思敏,张丽婷,何小冰,丁鸿燕,铁 吴. 广州化工,2019,47(22): 101-104