南、北山楂水提液对人体内源胰脂肪酶的作用研究
2020-09-10祁静汪启珍杨娟蔡炳民于迪
祁静 汪启珍 杨娟 蔡炳民 于迪



摘 要:目的:以南、北山楂和胰脂肪酶为研究对象,测定胰脂肪酶分别与南、北山楂水提液作用后的酶活,探究山楂能否通过抑制胰脂肪酶的活性来达到降血脂作用。方法:通过体外模拟肠液的条件,考察不同温度下制备的南、北山楂水提液分别对胰脂肪酶活性的影响,并考查三种金属离子对山楂抑制胰脂肪酶活力的影响。结果:不同温度下制备的南、北山楂水提液,在不同反应温度和pH条件下对胰脂肪酶均表现出活性抑制作用,抑制作用表现最强的为80 ℃提取的南山楂水提液,且反应条件为pH为7.20、温度为25 ℃。Ca2+的存在会削弱山楂对胰脂肪酶的抑制作用,而Zn2+和Mg2+能增强山楂对胰脂肪酶的抑制作用。结论:山楂在一定程度程度上可以通过抑制胰脂肪酶的活性来达到降血脂的效果。为获得良好的降血脂效果,在开发山楂功能性食品时,尽量避免富含Ca2+的食材。
关键词:南、北山楂;胰脂肪酶;降血脂
山楂果实和叶片中营养成分丰富[1-2],可起到消食健胃、消炎止咳、降血压、降血脂、增进冠状动脉血流量和防治冠心病、心绞痛等作用[3] 。Jurikova T等[4]研究表明,山楂在心脑血管系统、消化系统以及血脂调节、糖代谢等方面均具有较强的药理作用。大量研究证明,山楂中的黄酮、三萜酸、植物甾醇和果胶等物质有显著的降血脂功效[5-8] 。血脂异常通常表现为血脂浓度过高,高脂血症是指血浆脂原浓度超过正常范围[9] 。过多的膳食脂肪摄入积累是导致人体血浆脂原浓度超过正常范围的主要原因,而胰脂肪酶是将食物中的脂肪分子降解为甘油单酯和游离脂肪酸的一种重要的消化道内源酶[10] 。大多数膳食脂肪是在人体内源消化酶中胰脂肪酶的作用下降解为小分子物质后才被人体吸收利用的,因此,抑制胰脂肪酶活性,可以有效抑制脂质代谢过程,降低人体对膳食脂肪的消化率和代谢产物的吸收率,从源头上控制血浆脂原浓度的升高,达到降血脂的功效。
研究表明,胰脂肪酶的活性能够有效地被一些植物抑制,如葡萄籽[11]、刺玫果果肉[12]、鼠尾草叶[13]、苦丁茶冬青[10]和高吸附性米糠纤维[14] 。有学者通过小鼠实验表明,山楂具有一定的降血脂作用,如李贵海等[15]通过对小鼠高脂血症模型进行酶反应终点法测定试验,发现山楂中的熊果酸和金丝桃苷具有明显的降低胆固醇、调节血脂的功效。Lin Yuguang等[16]通过小鼠实验发现,山楂三萜酸能显著降低极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)水平,有一定的降血脂作用。林秋实等[17]通过对大鼠高脂血症模型进行血脂测定实验,发现山楂及山楂黄酮具有调节脂质代谢紊乱及增强体内胆固醇清除的功能。从人体内源消化酶中胰脂肪酶的角度研究山楂降血脂功效的报道尚未见有,本研究以人体内源消化酶中胰脂肪酶为研究对象,通过体外模拟肠液的条件,考察不同提取温度条件下制备的北山楂水提液和南山楂水提液在不同条件下对胰脂肪酶活性的影响,进而为山楂降血脂的功效提供科学依据,帮助人们合理调整饮食结构和有效指导人们开发出具有更高经济价值的山楂功能性食品。
1 材料与方法
1.1 材料与试剂
南山楂片(产自广东);北山楂片(产自山东济南);CAS9001-62-1胰脂肪酶,美国Sigma-Alorich公司;橄榄油(分析纯),上海麦克林生化科技有限公司;聚乙烯醇(分析纯),天津市光复精细化工研究所;氢氧化钠(分析纯)、酚酞(分析纯)、95%乙醇(分析纯),天津市光复科技发展有限公司;磷酸氢二钠(分析纯)、磷酸二氢钠(分析纯),天津市大茂化学试剂厂;氯化镁(分析纯)、氯化锌(分析纯),成都金山化学试剂有限公司;无水氯化钙(分析纯),成都市科龙化工试剂厂。
1.2 仪器与设备
BSA224S万分之一天平,德国Sartorius公司;FJ-200高速分散均质机,上海标本模型厂;雷磁PHS-3C型pH计,上海仪电科学仪器股份有限公司;ZHWY-200B恒温培养振荡器,上海智城分析仪器制造有限公司;50 mL酸碱滴定管,天津市天玻玻璃仪器有限公司;DHG-9053电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
1.3 方法
1.3.1 试剂的制备
(1)4%聚乙烯醇溶液的制备:称取40 g聚乙烯醇加入900 mL沸騰蒸馏水中,于电磁炉上水浴搅拌加热至聚乙烯醇溶解,冷却后定容至1 000 mL,储存备用。
(2)橄榄油乳液的制备:量取50 mL橄榄油于烧杯中,加入150 mL 聚乙烯醇溶液(4%,w/v),使用高速分散均质机在23 000 r/min 的条件下分散6 min。分2次进行,3 min/次,间隔1 min。
(3)0.1 mol/L pH为7.2的磷酸盐(PBS)缓冲液的配制:首先配制0.2 mol/L NaH2PO4和0.2 mol/L Na2HPO4溶液,然后按一定比例混合并稀释配制成0.1 mol/L pH为7.2的PBS缓冲液。称取NaH2PO4·2H2O 31.2 g(或NaH2PO4·H2O 27.6 g)加蒸馏水加热溶解,冷却后定容至1 000 mL即得0.2 mol/L NaH2PO4溶液。称取61.632 g Na2HPO4·12H2O(或72 g Na2HPO4·2H2O)加蒸馏水溶解并定容至1 000 mL 即得0.2 mol/L Na2HPO4溶液。分别移取0.2 mol/L NaH2PO4 28 mL和72 mL 0.2 mol/L Na2HPO4溶液混匀后,加蒸馏水定容至200 mL即获得0.1 mol/L pH为7.2的PBS缓冲液。
(4)0.02 mol/L NaOH溶液的制备:依据《GB/T 601—002 化学试剂标准滴定溶液的配制》进行配制。①NaOH溶液的制备:精密称取NaOH 1.200 0 g,加入煮沸后冷却的蒸馏水1 500 mL配成0.02 mol/L NaOH溶液。②邻苯二甲酸氢钾基准物溶液的配制:精密称取0.5~0.55 g于105~110 ℃干燥至恒重的邻苯二甲酸氢钾,溶于少量新煮沸冷却的蒸馏水中,最后定容至250 mL容量瓶中,此溶液供标定NaOH溶液用。③NaOH的标定:移液管平行移取20.00 mL 上述邻苯二甲酸氢钾溶液3份,置于洗净的锥形瓶中,滴加酚酞指示剂(1%,95%乙醇溶解)2滴,用待标定的NaOH溶液滴定至溶液呈浅红色,且30 s不褪色为终点。记录所耗用NaOH溶液的体积。计算NaOH溶液的准确浓度并写在标签上。标定好的NaOH溶液保存于塑料瓶中储存备用。计算公式如式(1):
式(1)中,CNaOH——NaOH溶液的浓度(mol/L);m邻——称取邻苯二甲酸氢钾的质量(g);VNaOH——滴定时消耗的NaOH溶液的体积(mL);M邻——邻苯二甲酸氢钾的摩尔质量(g/mol)。
(5)1%酚酞指示液:制备方法依据《GB/T 603—2002化学试剂试验方法中所用制剂及制品的制备》。称取1 g酚酞,用少量 95%乙醇溶解,然后继续用95%乙醇稀释至100 mL,储存备用。
(6)0.20 mg/mL胰脂肪酶溶液的制备:取适量胰脂肪酶于研钵中迅速研细后,准确称取0.020 g胰脂肪酶溶解于0.1 mol/L pH为7.2的PBS缓冲液中,定量滤纸过滤后,用上述缓冲液定容至100 mL,现配现用。
(7)不同温度下山楂水提液的制备:分别称取50 g南山楂片和北山楂片,按料液比1∶ 4(w/v)加入蒸馏水(蒸馏水预热至提取温度),分别于不同温度(常温、60 ℃、80 ℃)下浸提30 min,采用滤棉过滤2次、定量滤纸过滤2次,然后定容至250 mL,即得不同温度提取的南、北山楂水提液,储存备用。
1.3.2 不同温度下制备的山楂水提液在不同条件下对胰脂肪酶的作用
(1)不同pH的山楂水提液对胰脂肪酶的作用:在干净锥形瓶中准确移入8 mL橄榄油乳液、5 mL 0.1 mol/L pH为7.2的PBS缓冲液,然后分别准确移入提前调至pH为6.80、6.90、7.00、7.10、7.20的3 mL山楂水提液,置于磁力搅拌器上充分搅拌均匀,最后准确移入1 mL 0.20 mg/mL的胰脂肪酶液,再次充分搅拌均匀。将上述反应液置于37 ℃下的恒温培养振荡器中反应1.5 h,然后加入15 mL 95%乙醇终止酶反应。于反应液中滴加2滴酚酞指示剂,使用0.02 mol/L NaOH滴定体系中产生的脂肪酸量。实验做2个平行并设置对照组,其中对照组实验为不添加山楂的反应体系,对照组做1个平行。
(2)山楂水提液在不同反应温度下对胰脂肪酶的作用:在干净锥形瓶中准确移入8 mL橄榄油乳液、5 mL 0.1 mol/L pH为7.2的PBS缓冲液、pH为7.00的3 mL山楂水提液,置于磁力搅拌器上充分搅拌均匀,然后准确移入1 mL 0.20 mg/mL的胰脂肪酶液,再次充分搅拌均匀。将反应液分别置于25、37、45 ℃下的恒温培养振荡器中反应1.5 h,然后加入15 mL 95%乙醇终止酶反应。于反应液中滴加2滴酚酞指示剂,使用0.02 mol/L NaOH滴定体系中产生的脂肪酸量。实验做2个平行并设置对照组,其中对照组实验为不添加山楂的反应体系,对照组做1个平行。
1.3.3 金属离子对山楂抑制胰脂肪酶活力的影响
(1)Ca2+对山楂抑制胰脂肪酶活力的影响:在干净锥形瓶中准确移入8 mL橄榄油乳液、5 mL 0.1 mol/L pH为7.2的PBS缓冲液、pH为7.00的3 mL山楂水提液,置于磁力搅拌器上充分搅拌均匀,然后准确移入1 mL 0.2 mg/mL的胰脂肪酶液,充分搅拌均匀,最后准确移入1 mL 5 mmol/L的Ca2+,充分搅拌均匀。将上述混合液置于37 ℃的恒温振荡摇床中反应1.5 h后加入15 mL 95% 乙醇终止酶反应。于反应液中滴加2滴酚酞指示剂,用0.02 mol/L NaOH滴定体系中产生的脂肪酸量。实验做2个平行并设置对照组,其中对照组实验为不添加Ca2+的反应体系,对照组做1个平行。
(2)Zn2+对山楂抑制胰脂肪酶活力的影响:在干净锥形瓶中准确移入8 mL橄榄油乳液、5 mL 0.1 mol/L pH为 7.2的PBS缓冲液、pH为7.00的3 mL山楂水提液,置于磁力搅拌器上充分搅拌均匀,然后准确移入1 mL 0.2 mg/mL的胰脂肪酶溶液,充分搅拌均匀后准确移入1 mL 10 mmol/L的Zn2+,继续充分搅拌均匀。然后置于37 ℃的恒温振荡摇床中反应1.5 h,最后加入15 mL 95% 乙醇终止酶反应。于反應液中滴加2滴酚酞指示剂,用0.02 mol/L NaOH溶液滴定体系中产生的脂肪酸量。实验做2个平行并设置对照组,对照组实验为不添加Zn2+的反应体系,对照组做1个平行。
(3)Mg2+山楂抑制胰脂肪酶活力的影响:在干净锥形瓶中准确移入8 mL橄榄油乳液、5 mL 0.1 mol/L pH为 7.2的PBS缓冲液、pH为7.00的3 mL山楂水提液,置于磁力搅拌器上充分搅拌均匀,继续准确移入1 mL 0.2 mg/mL的胰脂肪酶液,充分搅拌均匀后准确移入1 mL 10 mmol/L的Mg2+,再次搅拌均匀,然后置于37 ℃的恒温振荡摇床中反应1.5 h,最后加入15 mL 95% 乙醇终止酶反应。于反应液中滴加2滴酚酞指示剂,用0.02 mol/L NaOH滴定体系中产生的脂肪酸量。实验做2个平行并设置对照组,其中对照组实验为不添加Mg2+的反应体系,对照组做1个平行。
(4)胰脂肪酶的酶活计算方法:胰脂肪酶的酶活计算采用胰脂肪酶的活力测定公式如式(2)、胰脂肪酶的活性抑制率计算公式如式(3):
式(3)中,抑制率——胰脂肪酶的活性抑制率(%);X1——对照组酶活(μmol/min·mg);X2——样品组酶活(μmol/min·mg)。
1.3.4 山楂总黄酮的提取及测定
(1)山楂总黄酮的提取:分别精密称取10 g北山楂和南山楂粉末,置于三角瓶中,分别用30、60、80 ℃的60%乙醇为溶剂,按料液比为1∶ 6,超声提取40 min后,抽滤,再分别用30、60、80 ℃的60%乙醇定容至100 mL 容量瓶中,摇匀,备用。
(2)山楂总黄酮的测定:精密量取上述滤液1 mL至25 mL 量瓶中,加5%的亚硝酸钠溶液1 mL,摇匀,放置6 min;然后加入10%硝酸铝溶液1 mL,摇匀,继续放置6 min;再加4% NaOH溶液10 mL,最后加60%乙醇定容至刻度,摇匀,进行显色处理。放置15 min后,以乙醇为空白,在507 nm 的波长处测定吸光度。该方法的精密度、重现性良好,加样回收率高[18] 。
2 结果与分析
2.1 山楂总黄酮的测定结果
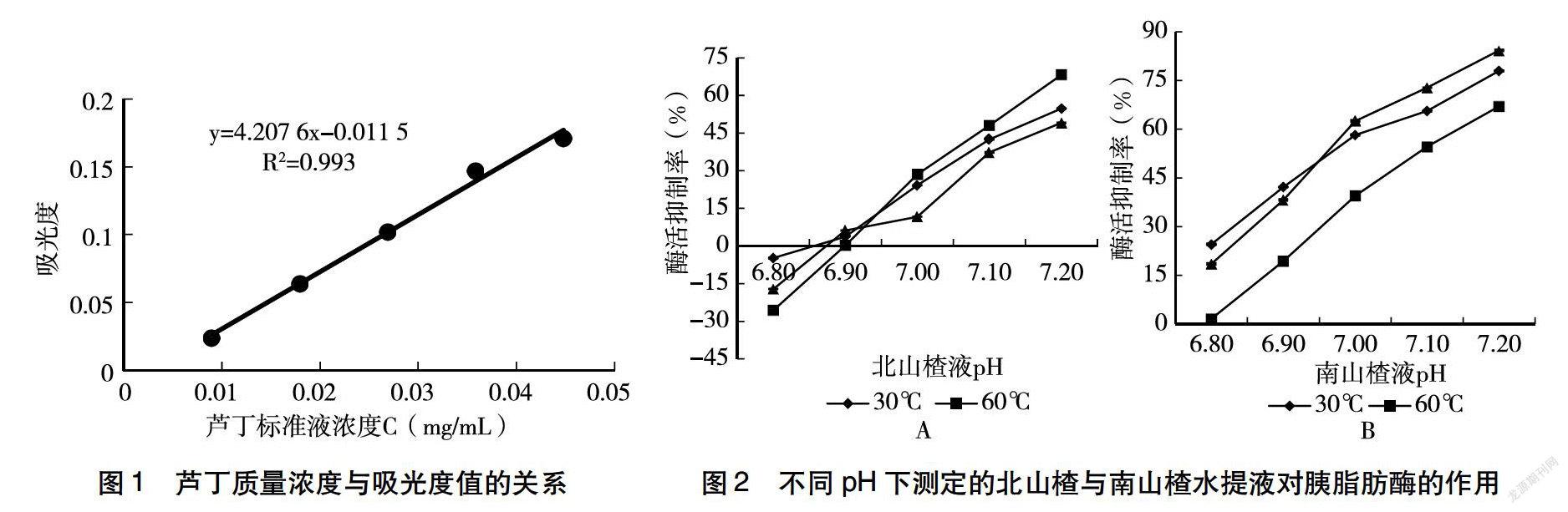
如图1 所示,吸光度值与芦丁质量浓度的回归方程为y = 4.207 6x -0.011 5,相关系数R2 = 0.993。经过测定,得到30、60、80 ℃提取的北山楂溶液的总黄酮含量分别为0.69、0.54、0.48 mg/g;在上述3个温度下提取的南山楂溶液总黄酮含量分别为1.15 、1.00、0.77 mg/g,由此可见,南山楂总黄酮含量高于北山楂,此结果与何心亮[19]的研究结果一致。
2.2 不同pH的山楂水提液对胰脂肪酶的作用
如图2A所示,不同pH(6.80~7.20)的北山楂水提液与胰脂肪酶反应后,在pH为6.90前表现出促进胰脂肪酶活性的作用,而在pH为6.90后表现出活性抑制作用,且山楂液的酶活性抑制能力随pH的增大而增强,推测此现象是由于山楂总黄酮含量突然大量增多所致 [19] 。其中,60 ℃提取条件下制备的北山楂水提液对胰脂肪酶的活性抑制作用最强。如图2B所示,不同pH(6.80~7.20)的南山楂水提液与胰脂肪酶反应后,南山楂水提液对胰脂肪酶的活性具有抑制作用,且山楂液的酶活性抑制能力随pH的增大而增强,但并未呈现线性趋势。其中,80 ℃提取条件下制备的南山楂水提液对胰脂肪酶的活性抑制作用最强。
将图2A和图2B的结果进行对比可发现,在一定pH范围内,北山楂水提液和南山楂水提液均对胰脂肪酶的活性具有抑制作用,且活性抑制能力随着山楂液pH的增大而增强,同时在pH为7.20时表现出最高的抑制能力,此现象与山楂中起抑制脂肪消化作用的黄酮类物质随pH的增加提取量增大有关[20] 。通过图2A和图2B可见,60 ℃提取条件下的北山楂水提液对胰脂肪酶的抑制效果最好,80 ℃提取条件下的南山楂水提液对胰脂肪酶的抑制效果最好。整体结果顯示,不同pH的南山楂水提液对胰脂肪酶的活性抑制作用强于北山楂水提液。
2.3 山楂水提液在不同反应温度下对胰脂肪酶的作用
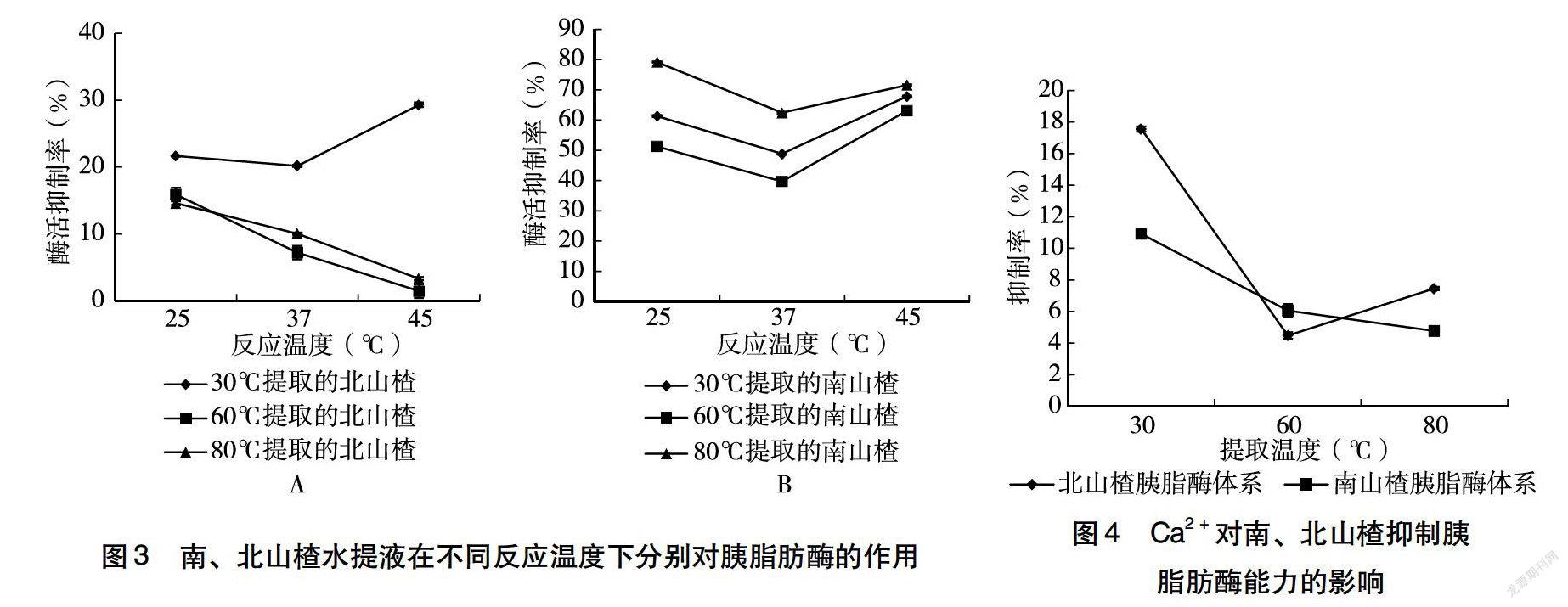
如图3A所示,北山楂水提液与胰脂肪酶在25~45 ℃内相互作用后,北山楂水提液对胰脂肪酶的活性具有抑制作用。常温条件下制备的北山楂水提液,在25~45 ℃反应温度范围内,随反应温度的升高,对胰脂肪酶的活性抑制能力呈现先下降后上升的趋势。其中,在37 ℃下对胰脂肪酶的活性抑制作用最弱。60 ℃和80 ℃条件下制备的北山楂水提液,在25~45 ℃反应温度范围内,随反应温度的升高,对胰脂肪酶的活性抑制能力呈现不断下降的趋势。整体结果显示,常温条件下制备的北山楂水提液表现出最高的胰脂肪酶活性抑制率,原因可能是由于较高温度下提取的山楂液中含有较多有机酸导致pH降低,使得山楂液中某些活性成分产生凝聚作用[21],而常温提取条件下山楂提取液中含有的果胶以及多种有机酸含量较少,酸凝聚作用较小,其他活性成分与胰脂肪酶的接触几率更大,从而增强了山楂对胰脂肪酶的活性抑制作用。如图3B所示,南山楂水提液与胰脂肪酶在25~45 ℃内相互作用后,南山楂对胰脂肪酶的活性具有抑制作用,且随反应温度的升高,抑制作用呈现先下降后上升趋势。其中,在37 ℃下对胰脂肪酶的活性抑制作用最弱,25 ℃下对胰脂肪酶的活性抑制作用最强,此现象可能由于常压下胰脂肪酶活性在37 ℃时酶活最高,所以山楂的抑制作用相对较弱[22] 。整体结果显示,80 ℃提取条件下制备的南山楂水提液表现出最高的胰脂肪酶活性抑制率。
对比图3A和图3B可发现,3个提取温度下制备的南山楂水提液和常温条件下制备的北山楂水提液,在25~45 ℃反应温度范围内与胰脂酶反应后,随反应温度的升高,对胰脂肪酶的活性抑制能力均呈现先下降后上升的趋势,且25 ℃下南山楂和北山楂水提液均表现出最高的胰脂肪酶活性抑制率。整体结果显示,南山楂水提液在不同反应温度下对胰脂肪酶的活性抑制作用强于北山楂水提液。
2.4 金属离子对山楂抑制胰脂肪酶能力的影响
2.4.1 Ca2+对山楂抑制胰脂肪酶能力的影响 图4显示,在反应体系中加入Ca2+后,北山楂和南山楂水提液对胰脂肪酶的活性抑制作用均被削弱,且常温下提取的山楂溶液对胰脂酶的抑制作用被削弱的程度最大。Ca2+对北山楂抑制胰脂肪酶能力的削弱作用随北山楂溶液提取温度的升高,呈现先下降后上升的趋势,当提取温度为60 ℃时削弱作用最弱。Ca2+对南山楂抑制胰脂肪酶能力的削弱作用随南山楂溶液提取温度的升高而减弱,当提取温度为80 ℃时削弱作用最小。整体结果显示,Ca2+对北山楂抑制胰脂肪酶能力的削弱作用更强。
2.4.2 Zn2+对山楂抑制胰脂肪酶能力的影响 如图5所示,在反应体系中加入Zn2+后,北山楂和南山楂水提液对胰脂肪酶的活性抑制作用均被增强。Zn2+对北山楂和南山楂抑制胰脂肪酶能力的强化作用随山楂水提液提取温度的升高,呈现先上升后下降的趋势,当提取温度为60 ℃时强化作用最大。
2.4.3 Mg2+对山楂抑制胰脂肪酶能力的影响 如图6所示,在反应体系中加入Mg2+后,北山楂和南山楂水提液对胰脂肪酶的活性抑制作用均被增强。Mg2+对北山楂抑制胰脂肪酶活力的强化作用随山楂水提液提取温度的升高,呈现先上升后下降的趋势,当提取温度为60 ℃时促进作用最强。Mg2+对南山楂抑制胰脂肪酶能力的增强作用随山楂水提液提取温度的升高而增强,当提取温度为80 ℃时促进作用最强。整体结果显示,Mg2+对北山楂抑制胰脂肪酶活力的促进作用更强。
3 结论与讨论
从不同反应pH和不同反应温度的实验结果可发现,相同反应条件下的南山楂水提液对胰脂肪酶的抑制能力强于北山楂水提液对胰脂肪酶的抑制能力,认为此结果可能是由于南山楂中的黄酮类成分含量较高的原因,因为黄酮类成分是促成山楂降血脂功效的成分之一 [23] 。通过对胰脂肪酶的活力进行测定,证明北山楂水提液和南山楂水提液在一定条件下对胰脂肪酶均有一定的活性抑制作用,能够降低脂肪的消化吸收率,从而具有一定的降血脂功效。其中,抑制作用表现最强的为80 ℃提取的南山楂溶液,反应条件为pH为7.20、温度为25 ℃。通过对金属离子的作用考查,表明在一定条件下Ca2+会削弱山楂对胰脂肪酶的抑制作用,而Zn2+和Mg2+对提升山楂对胰脂肪酶的抑制效果,能够进一步增强山楂的降血脂功效。因此,在研发山楂降血脂功能性食品的配伍食材时,应更多考虑富含Zn2+和Mg2+的食材,避免使用富含Ca2+的食材。◇
参考文献
[1]柴军红,任荣,柴小军,等.山楂的应用研究进展[J].中国林副特产,2010,105(2):98-101.
[2]孟庆杰,王光全.山楂种质果实营养成分分析及其资源利用研究[J].河北农业大学学报,2005,28(1):20-23.
[3]孟庆杰,王光全,张丽.山楂功能因子及其保健食品的开发利用[J].食品科学,2006,27(12):873-877.
[4]Jurikova T,Sochor J,Rop O,et al.Polyphenolic proile and biological activity of Chinese hawthorn(Crataegus pinnatii da BUNGE)fruits[J].Molecules,2012,17(12):14490-14509.
[5]唐世英,胡桂才,李来,等.山楂降血脂作用有效部位的研究[J].云南中医学院学报,2009(5):43-45.
[6]林科,张太平,张鹤云.山楂中熊果酸的提取及其对小鼠的降血脂作用[J].天然产物研究与开发,2008,19(6):1052-1054.
[7]董贺,等.山楂谷甾醇的提取及降血脂和增强免疫的研究[J].天然产物研究与开发,2009,2l(5):60-63.
[8]Zhu Rugang,et al.Pectinpentasacehnride from hawthorn(Crataegua pinnatifida Bunge.var.major)ameliorates disorders of cholesterol metabolism in high·fat dietfed mice[J].Food Research International,2013,54(1):262-268.
[9]范婷婷.荷叶生物碱类物质降脂减肥活性研究[D].杭州:浙江大学,2013.
[10]耿江枫.苦丁茶冬青胰脂肪酶抑制活性成分研究[D].贵阳:贵州师范大学,2016.
[11]高德艳.葡萄籽原花青素分离及其对胰脂酶活性抑制功能的研究[D].济南:齐鲁工业大学,2014.
[12]李小第,姜会敏,霍雅玉,等.刺玫果果肉石油醚层化学成分及胰脂酶和α-糖苷酶抑制活性研究[J].天然产物研究与开发,2015,27(6):1011-1015.
[13]霍世欣,等.荷叶黄酮化合物对胰脂肪酶抑制作用的研究[J].天然產物研究与开发,2008(2):328-331.
[14]祁静.高吸附性米糠纤维的制备及其吸附特性的研究[D].江苏无锡:江南大学,2016.
[15]李贵海,孙敬勇,张西林,等.山楂降血脂有效成分的实验研究[J].中草药,2002,33(1):50.
[16]Liu Yuguang,et al.Triterpenic acids present in hawthorn lower plasma cholesterol by inhibiting intestinal ACAT activity in hamsters[J].Evidence—Based Complementary and Alternative Medicine,2011(2011):1-9.
[17]林秋实,陈吉棣.山楂及山楂黄酮预防大鼠脂质代谢紊乱的分子机制研究[J].营养学报,2000,22(2):131.
[18]张旭,等.甘肃山楂与山里红总黄酮的提取及含量测定方法研究[J].中国兽药杂志,2018,52(6):34-39.
[19]何心亮.北山楂与南山楂化学成分的比较[J].中草药,1990,21(4):4-6、46.
[20]侯桂兰,高敏,童丽姣,等.山楂叶总黄酮的理化性质研究[J].中华中医药学刊,2012,30(8):1766-1768.
[21]崔亮,华二伟,薛洁.山楂对消化系统影响的研究进展[J].新疆中医药,2012,30(1):78-79.
[22]张中义,等.超高压下猪胰脂肪酶催化橄榄油水解特性的研究[J].食品科技,2009,34(1):10-13.
[23]朱彦陈,胡慧明,邵峰,等.南山楂化学成分与药理作用研究进展[J].江西中医药,2014,45(12):67.
Abstract:Objective To explore whether Hawthorn can reduce blood lipid by inhibiting the activity of pancreatic lipase,Crataegus cuneata Sieb.et Zucc.,Crataegus pinnatifida Bge.and pancreatic lipase were used as the research objects.Themechanism of hypolipidemic effects of Crataegus cuneata Sieb.et Zucc.and Crataegus pinnatifida Bge.was investigated by measuring the enzyme activity of pancreatic lipase after it interacted with thewater extract of Hawthorn.Method By simulating the conditions ofintestinal fluid in vitro,the effects of aqueous extracts of Crataegus cuneata Sieb.et Zucc.and Crataegus pinnatifida Bge.prepared at different temperatures on the activity of pancreatic lipase were investigated.In addition,the effects of three metal ions on the inhibition of pancreatic lipase activity with Hawthorn were also investigated.Result Results proved that the aqueous extracts of Crataegus cuneata Sieb.et Zucc.and Crataegus pinnatifida Bge.,which were prepared at different temperatures,exhibited inhibitory activity against pancreatic lipase at different reaction temperatures and pH values.The aqueous extract of Crataegus cuneata Sieb.et Zucc.prepared at 80 ℃ had the strongest inhibitory effect under the reaction conditions of pH=7.20,25 ℃.The inhibition of hawthorn on pancreatic lipase could be weakened by Ca2+,while it could be enhanced by Zn2+ and Mg2+.Conclusion Aqueous extracts of Crataegu cuneata Sieb.et Zucc.and Crataegus pinnatifida Bge.have certain inhibitory effects on pancreatic lipase under certain conditions.Moreover,in order to achieve a better hypolipidemic effect,the materials rich in Ca2+ should be avoided when developing the functional foods of Hawthorn.
Keywords:Crataegus cuneata Sieb.et Zucc.and Crataegus pinnatifida Bge.;pancreatic lipase;hypolipidemic
