蜂胶灵芝毒理学安全性评价研究
2020-09-10陈晨公维一毛宏梅李岩
陈晨 公维一 毛宏梅 李岩

摘 要:目的:对蜂胶灵芝毒理学安全性进行评价,为蜂胶灵芝食用安全提供科学依据。方法:通过急性经口毒性试验、Ames试验、骨髓细胞微核试验、精子畸形试验和大鼠30d喂养试验等毒理学评价试验,评估蜂胶灵芝的食用安全性。结果:蜂胶灵芝对大鼠经口急性毒性的最大耐受量大于20.0g/kg·BW。遗传毒性试验——小鼠骨髓微核试验、Ames试验和精子畸形试验结果未观察到受试物引起致突变作用,大鼠30d喂养试验结果未观察到毒性反应。结论:蜂胶灵芝急性毒性分级属无毒级,无遗传毒性,在该试验研究剂量和条件下,蜂胶灵芝未见明显毒性作用。
关键词:蜂胶灵芝;急性毒性;遗传毒性;30d喂养试验
蜂胶是蜜蜂从树干破皮伤口处或植物芽孢中采集的树脂(树胶),混入蜜蜂口器腺体的分泌物,与花粉、蜂蜡等加工而成的一种胶状物质。蜂胶含有树脂、蜂蜡和黄酮类化合物,具有抗癌性、抗氧化性、抑菌活性和抗病毒等生物学功能[1-3]。作为一种重要的药食用真菌,灵芝具有降血糖、调节免疫、抗肿瘤、抗肝损伤的作用[3-4]。市场上有很多灵芝和蜂胶复合产品,关于这个产品的研究多为降血糖[5]和降血脂[6]等方面,安全性评价的研究较少。本研究以灵芝和蜂胶组成的复合物为原料,通过急性经口毒性试验、Ames试验、骨髓细胞微核试验、精子畸形试验和大鼠30d喂养试验等毒理学评价试验,评估蜂胶灵芝的食用安全性,为其进一步在保健食品中使用提供科学依据。
1 材料与方法
1.1 材料
受试物:蜂胶灵芝胶囊内容物为棕色粉末,阴凉干燥處保存。该受试物人体食用的推荐量是1.2g/d,成人按60kg体重计,推荐摄入量为每天0.02g/kg·BW。
1.2 实验动物和实验条件
SPF级健康昆明种小鼠和SPF级SD大鼠,均购买自中国人民解放军军事医学科学院实验动物中心,其生产许可证号为SCXK(军)2012-0004。急性毒性试验选用SD大鼠20只,雌雄各半,体重180~220g;50只昆明小鼠,雌雄各半,用于微核试验,体重25~30g;雄性昆明小鼠用于精子畸形试验,共30只,体重25~35g;大鼠30d喂养试验选用断乳SD大鼠80只。饲养地点:中国疾病预防控制中心动物房,级别:屏障环境,温度20~24℃,相对湿度40%~70%,许可证号:SYXK(京)2014-0043。Co60辐照处理的SPF级鼠维持饲料,购自北京科澳协力饲料有限公司,许可证号:SCXK-(京)2014-0010。根据30d喂养试验设计饲料中受试物掺入剂量,委托北京科澳协力饲料有限公司配制饲料后,经Co60辐照处理,许可证号:SCXK-(京)2014-0010。
1.3 实验菌株
鼠伤寒沙门氏菌组氨酸缺陷型TA97、TA98、TA100、TA102是Ames试验所使用的菌株,经过鉴定菌株符合要求。
1.4 主要仪器与试剂
电子天平、AC2-YSI生物安全柜、SPX-250恒温培养箱、WNB29恒温水浴锅、HVE-50蒸汽压力消毒器、生物显微镜、全自动血细胞分析仪(XT-1800i)、日立7080全自动生化分析仪、离心机、病理设备(全自动脱水机VIP-E150F、自动包埋机TEK-CC/TEK-EC、石蜡切片机、全自动染色机ST5010、全自动封片机SCA-5600)、ZEISS生物显微镜等。AMES实验阳性物为2-氨基芴(北京索莱宝科技有限公司)、甲基磺酸甲酯(百灵威科技有限公司)、1,8-二羟基蒽醌(百灵威科技有限公司)、敌克松(Sigma)。
1.5 试验方法
1.5.1 大鼠急性毒性试验 按照最大耐受量法进行,试验用20只SD大鼠,雌雄各半,体重为180~220g。称取受试物50.0g,加蒸馏水至100mL,终浓度为0.5g/mL。实验前动物隔夜空腹(禁食16h,不限制饮水),以20.0mL/kg·BW灌胃量进行,1日灌胃2次,2次灌胃之间间隔4h,受试物给予剂量是20.0g/kg·BW。连续观察14d,同时记录大鼠中毒表现及死亡情况。
1.5.2 遗传毒性试验
(1)Ames试验:鼠伤寒沙门氏菌组氨酸缺陷型TA97、TA98、TA100、TA102用于试验,并经过鉴定是符合要求的,S-9混合液是体外代谢活化系统,试验条件分为加与不加S-9。试验设8、40、200、1 000、5 000μg/皿5个剂量组。试验还包括阳性对照组、溶剂对照(DMSO)组以及空白对照组。按照平板掺入法进行试验,每个组别需要3个平行皿,计数每皿的回变菌落数。如果试验结果发现受试物回变菌落数达到溶剂对照菌落数的2倍以上,并且存在剂量-反应关系的时候则结果定为阳性。整个试验需要在相同条件下重复进行2次。
(2)骨髓嗜多染红细胞微核试验:试验需向小鼠间隔24h两次经口灌胃受试物。昆明小鼠50只,雌雄各半,体重25~30g,根据体重将小鼠随机分成5组,每组10只。受试物分成3个剂量组,分别是2.5、5.0、10.0g/kg·BW,试验还设有环磷酰胺阳性对照组(40mg/kg·BW)以及蒸馏水阴性对照组。高剂量组试验称取20.0g受试物溶于蒸馏水至40mL,中、低剂量组试验以蒸馏水2倍倍比稀释高剂量组受试物,终浓度分别为0.50、0.25、0.125g/mL,小鼠灌胃量为20mL/kg·BW。末次给予受试物后的6h处死小鼠,取小鼠胸骨骨髓,使用小牛血清涂片、由甲醇固定、进行Giemsa染色。在显微镜下,对每只动物计数200个嗜多染红细胞(PCE),并且计算嗜多染红细胞与成熟红细胞的比值(PCE/NCE);然后每只动物需计数嗜多染红细胞(PCE)1 000个,以含微核的PCE千分率计为微核发生率,并对各个组进行泊松分布的统计分析。如果试验组微核率和阴性对照组微核率相比升高有统计学意义,还具有剂量-反应关系,那么结果判定为阳性。
(3)小鼠精子畸形试验:30只性成熟雄性小鼠,体重25~35g,按体重随机分成5组,每组6只小鼠。受试物的3个剂量组分别是2.5、5.0、10.0g/kg·BW,试验还设有环磷酰胺阳性对照组(40mg/kg·BW)以及蒸馏水阴性对照组。高剂量组将20.0g样品溶于蒸馏水至40mL,中、低剂量组依次使用蒸馏水做2倍倍比稀释,试验的终浓度分别是0.50、0.25、0.125g/mL,灌胃量为20mL/kg·BW,每天灌胃1次,灌胃5d。第1次灌胃后的第35天,在每组中随机选取5只小鼠,颈椎脱臼处死后,取小鼠两侧附睾的精子滤液,进行常规的制片和镜检。对每只动物进行1 000个结构完整精子的计数,并且计算各组的精子畸形率(百分率表示),然后使用χ2检验进行统计处理。如果试验组小鼠精子畸形率与阴性对照组相比升高有统计学意义,并有剂量-反应关系,则判定为阳性结果。
1.5.3 大鼠30d喂养试验
(1)剂量选择与受试物给予方式:选用断乳SD大鼠80只,雌雄各半,适应环境后随机分为4组,低、中、高3个剂量组和对照组,每组20只大鼠。低、中、高3个剂量组按照样品的人体推荐量而设立,分别是0.5、1.0、2.0g/kg·BW(即人体推荐量25、50、100倍)。按大鼠每日100g体重进食10g饲料计算,低、中、高剂量组分别取75、150、300g的受试物添加鼠维持饲料至15kg。对照组大鼠给予基础饲料喂养。大鼠自由饮食,单笼喂养,试验观察30d。
(2)试验方法:试验每天观察和记录动物生长状况,大鼠体重每周称1次,进食量每周记录。试验结束,动物空腹过夜,称解剖前体重,腹主动脉采血2份,1份是抗凝血,使用全自动血细胞分析仪检测大鼠白细胞计数及其分类、红细胞计数、血红蛋白;另一份为非抗凝血,分离血清,使用全自动生化分析仪来检测大鼠血清谷草转氨酶、谷丙转氨酶、胆固醇、尿素氮、甘油三酯、肌酐、白蛋白、总蛋白、血糖。对动物进行大体观察,取肝、脾、肾以及睾丸进行称重,计算脏/体比(按百克体重来计算),取肾、脾、肝、胃和十二指肠、卵巢或睾丸进行组织病理学检查。对各剂量组大鼠做大体检查并未观察到明显的病变和生化指标的改变情况下,试验仅做高剂量组和对照组动物主要脏器病理组织学的检查,如果发现有病理学的改变,然后再进行中、低剂量组大鼠相应器官的组织学检查。
1.6 数据统计分析
数据分析使用 SPSS软件进行,使用泊松分布进行微核试验结果的统计分析,使用χ2检验进行小鼠精子畸形试验结果的统计分析。30d喂养试验数据首先做方差齐性检验,如果各个组的方差齐,那么使用单因素方差分析进行总体的比较,显著性水平α=0.05,当发现差异时则使用Dunnett法进行各个剂量组与对照组之间的比较。如果方差不齐,那么对原始数据进行变量转换,转换后若满足数据方差齐性后,则用转换后数据进行统计;若转换后方差齐性仍不能满足,则使用其他统计方法如 Brown-Forsythe检验或Welch检验等。
2 结果与分析
2.1 大鼠经口急性毒性试验
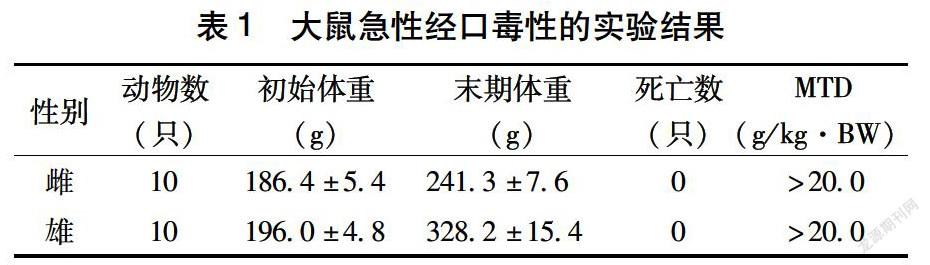
大鼠灌胃给予受试物20.0g/kg·BW,观察14d,未观察到明显的中毒症状,14d内没有大鼠死亡。表1显示,该受试物对雌雄大鼠急性经口最大耐受量(MTD)大于20.0g/kg·BW。由急性毒性分级标准得出,这个样品是属于无毒级。
2.2 遗传毒性试验
2.2.1 Ames试验 对照平皿的回变菌落数是在正常范围内,两次试验中各个剂量受试物组的回变菌落数未超过自发回变菌落数的2倍,没有剂量-反应关系,也未见某一测试点可重复的并有统计学意义的阳性反应,所以在加与不加S-9的时候,均未观察到这个样品对鼠伤寒沙门氏菌TA97、TA98、TA100和TA 102四株试验菌株有致突变作用。
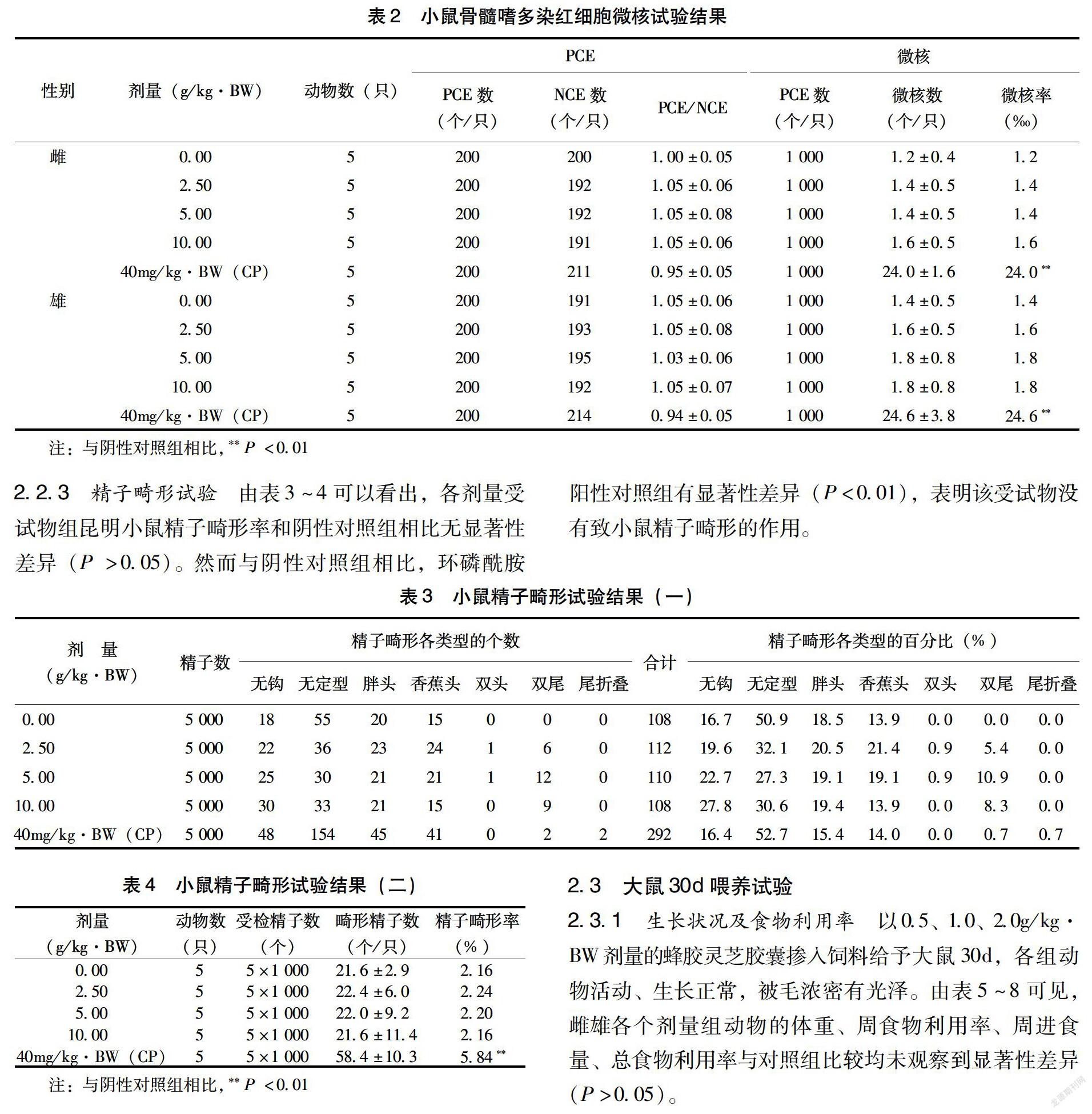
2.2.2 小鼠骨髓嗜多染红细胞微核试验 由表2可以看出,各剂量受试物组的PCE与成熟红细胞比例不低于阴性对照组的20%,表明受试物在实验剂量下无细胞毒性;阳性对照组雌、雄小鼠的微核发生率显著高于阴性对照组(P<0.01),而与阴性对照组相比,受试物各个剂量组微核率无显著性差异(P>0.05),表明该受试物对小鼠骨髓嗜多染红细胞没有致突变作用。
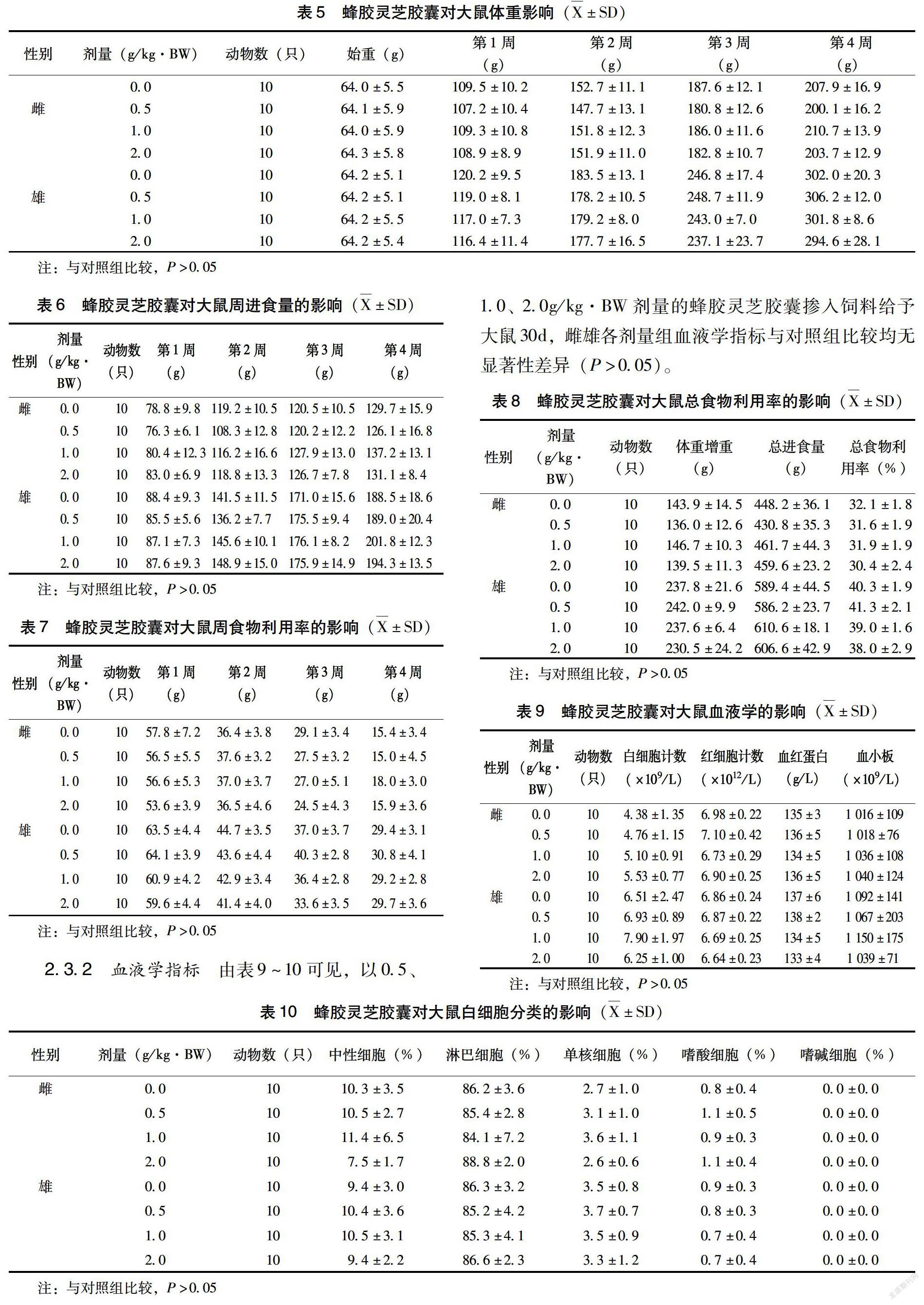
2.2.3 精子畸形试验 由表3~4可以看出,各剂量受试物组昆明小鼠精子畸形率和阴性对照组相比无显著性差异(P >0.05)。然而与阴性对照组相比,环磷酰胺阳性对照组有显著性差异(P<0.01),表明该受试物没有致小鼠精子畸形的作用。
2.3 大鼠30d喂养试验
2.3.1 生长状况及食物利用率 以0.5、1.0、2.0g/kg·BW剂量的蜂胶灵芝胶囊掺入饲料给予大鼠30d,各组动物活动、生长正常,被毛浓密有光泽。由表5~8可见,雌雄各个剂量组动物的体重、周食物利用率、周进食量、总食物利用率与对照组比较均未观察到显著性差异(P>0.05)。
2.3.2 血液学指标 由表9~10可见,以0.5、1.0、2.0g/kg·BW剂量的蜂胶灵芝胶囊掺入饲料给予大鼠30d,雌雄各剂量组血液学指标与对照组比较均无显著性差异(P>0.05)。
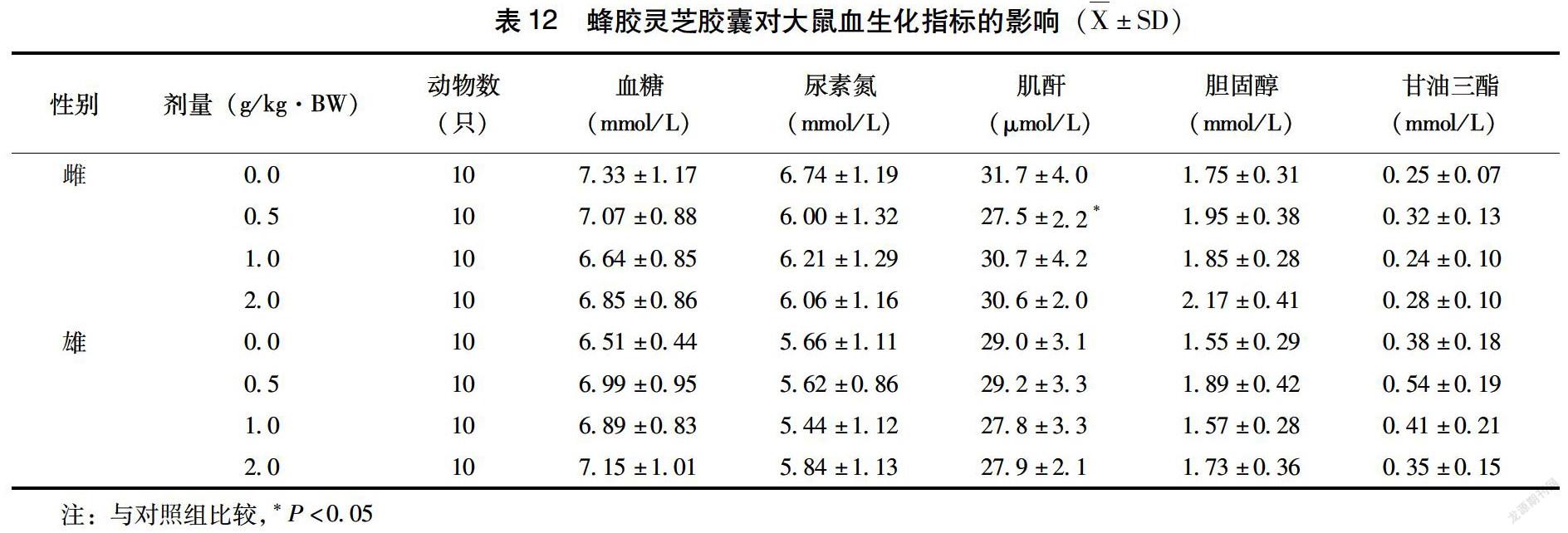
2.3.3 血生化指标 由表11~12可见,以0.5、1.0、2.0g/kg·BW剂量的蜂胶灵芝胶囊灌胃给予大鼠30d,雄性2.0g/kg·BW剂量组谷草转氨酶显著低于对照(P<0.01),雌性0.5g/kg·BW剂量组肌酐显著低于对照(P<0.01),但是上述指标的降低并没有生物学意义。除此之外,与对照组比较,其余雌雄大鼠各个剂量组血生化指标均没有显著性差异(P>0.05)。
2.3.4 组织病理学检查结果 对照组和高剂量组大鼠的脾、肾、肝、胃和十二指肠、卵巢、睾丸等脏器进行组织病理学检查。检查结果为:(1)肝:对照组和高剂量组所有动物的肝脏正常结构能够清晰辩识出来,肝小叶排列整齐,并且肝细胞以中央静脉为轴心呈大致辐射状走向。个别动物出现了肝细胞的点状坏死(对照组2/20例、高剂量组2/20例)。上面所述肝脏的病理学改变是动物自身常见的病变,并且高剂量组和与对照组大鼠检查结果无明显差异,故认为该病变与受试物是无关的。(2)肾:肾脏的结构能够清晰识别,肾单位呈均匀分布。部分标本(对照组3/20例,高剂量组3/20例)局灶性肾小管变性及再生。上述肾脏病理学改变对照组和高剂量组之间無显著差别,考虑为动物自发病变。(3)脾:正常脾组织结构易于辩认,脾组织未见明显病理变化。(4)胃及十二指肠、睾丸和卵巢:对照组和高剂量组所有动物胃及十二指肠各层组织可清晰辨认,粘膜和粘膜下层等各层结构正常,未见出血、坏死或炎性渗出;睾丸结构正常,可见各级生精细胞,未见出血、坏死及精细胞发育异常;卵巢结构正常,可见各阶段卵泡和成熟黄体,未见卵泡的发育异常以及组织内出血和炎症。综上认为,肾、脾、胃及十二指肠、睾丸(或卵巢)均未出现明显病理变化。故未观察到由蜂胶灵芝引起的脾、肝、肾、胃和十二指肠、卵巢(或睾丸)等脏器毒性病理改变。
3 讨论
Zhang等[7]研究表明,灵芝多糖没有致突变性,30d喂养试验未见明显毒性。Ramadan等[8]研究表明,蜂胶和番茄花的乙醇提取物连续灌胃大鼠8周并未发现肝肾毒性,对小鼠未发现毒性作用。程浩[9]研究表明,蜂胶软胶囊急性毒性属实际无毒级,无遗传毒性试验。灵芝和蜂胶复合产品有降糖和降血脂的功效,但是安全性评价资料较少。在本实验条件下,蜂胶灵芝对大鼠急性经口最大耐受量是大于20.0g/kg·BW的。由急性毒性分级标准得出,该样品是属于无毒级的。小鼠骨髓嗜多染红细胞微核试验、Ames试验和精子畸形试验均未观察到这个样品具有致突变的作用。大鼠30d喂养试验观察到各组动物生长发育、活动正常,动物周进食量、体重、食物利用率、血液生化、血液学指标与对照组比较均没有显著性差异(P>0.05)。组织病理学检查没有观察到摄入受试物而引起的异常改变。在本次实验的条件下,蜂胶灵芝没有观察到明显的毒性作用,本项研究为蜂胶灵芝用于保健食品研发提供了科学依据。
参考文献
[1]霍丽斯,刘嘉亮,陈颖芯.高效液相色谱法测定蜂胶中的六种黄酮[J].农产品加工,2019(6):54-55、58.
[2]薛云浩,李娜娜,王雯颖.蜂胶软胶囊对小鼠免疫调节功能的影响[J].中国卫生检验杂志,2018,28(13):1568-1570、1588.
[3]陈丽芳,王会宾,叶克难.灵芝孢子粉蜂胶复合物对小鼠免疫功能的影响[J].食品工业科技,2019,40(6):294-297、302.
[4]查良平,刘爽,赵玉洋,等.灵芝精氨酸甲基转移酶基因鉴定及表达分析[J].中国实验方剂学杂志,2016,22(15):28-32.
[5]丁云录,初洪波,刘艳华.复方蜂胶灵芝片对2型糖尿病大鼠的降糖作用[J].吉林中医药,2016,36(11):1138-1141.
[6]周波.蜂胶灵芝复方降血脂作用的研究[D].福州:福建农林大学,2013.
[7]Zhang Jianjun,Gao Xia,Pan Yaogang,et al. Toxicology and immunology of Ganoderma lucidum polysaccharides in Kunming mice and Wistar rats[J].International Journal of Biological Macromolecules,2016(85):302-310.
[8]A Ramadan,G Soliman,Sawsan S Mahmoud,et al. Abdel-Rahman.Evaluation of the safety and antioxidant activities of crocus sativus and propolis ethanolic extracts[J].Journal of Saudi Chemical Society,2012(16):13-21.
[9]程浩.蜂胶软胶囊增强免疫功能和毒理性研究[D].南京:南京农业大学,2010.
Abstract:Objective To comprehensively assess the toxicological safety of propolis and Ganoderma lucidum.Method The safety of propolis and Ganoderma lucidum was assessed through acute toxicity test,Ames test,Mouse Bone Marrow Polychromatic Erythrocyte Micronucleus Test,Mouse Sperm Abnormality Test and rat 30d feeding test.Result Rat acute toxicity test showed that the maximum tolerated dose(MTD)of propolis and Ganoderma lucidum in female and male rats was greater than 20.0g/kg·BW,and the sample was non-toxic according to the acute toxicity grading criteria.The results of three genotoxicity tests showed no mutagenic effect.Rat 30d feeding test showed that animal activity and growth were not abnormal.In addition,no adverse effects of propolis and Ganoderma lucidum were observed on animal weight,food intake,food utilization,blood routine,blood biochemistry,organ weight,organ/weight ratio,and histopathological examination results.Conclusion No obvious adverse effects of propolis and Ganoderma lucidum were observed.
Keywords:propolis and Ganoderma lucidum;acute toxicity;genotoxicity;30d feeding test
(責任编辑 唐建敏)