一种新型氟化物单体和聚合物19F-MRI成像性能对比
2020-09-03王昱青黄平升郭宏博胡西学王东亮王婷何芳菲
王昱青 黄平升 郭宏博胡西学王东亮王 婷何芳菲*
(1 国家纳米科学中心纳米技术发展部 北京 100190,2 中国医学科学院北京协和医学院生物医学工程研究所 天津 300192)
19F原子体内丰度极低(<10-6M)、活体成像时特异性高、便于建立标准曲线定量计算、成像灵敏度达到1H原子的83%,近年来19F核磁成像技术(19F magnetic resonance imaging,19F-MRI)受到广泛关注[1,2]。由于19F-MRI是在19F原子进动频率范围内直接对氟化物进行成像,因此成像信号强度(signal intensity, SI)与化合物中可成像的19F原子丰度密切相关。
由氟含量最高的超疏水全氟化合物,如全氟化碳(PFC)、全氟聚醚(PFPE)及全氟冠醚(PFCE)等制备的纳米乳造影剂,被率先用于19F-MRI成像研究[3-9]。但是其在肝脏和脾脏中快速富集以及长期滞留,为实现其临床应用增加了安全性障碍。为了提高生物安全性,由两亲性氟化分子自组装构建的“智能”纳米探针,被应用于蛋白质、酶、pH、氧化还原微环境、离子和活性氧等生物活性分子/生物信号检测和肿瘤诊断研究[10-15]。但是分子结构中可检测的氟含量不足,成为制约自组装智能纳米造影剂体内成像效果的瓶颈。另外,一些研究组利用磁性离子顺磁弛豫增强效应调控19F弛豫率的方式,将几个19F化合物分子与金属离子配形成螯合物,通过自组装方式形成团簇等,旨在通过加快成像速度提高单位时间内采集到的信号强度[16,17]。但是自组装团簇和金属螯合物横向弛豫率过高,在成像信号采集之前,已经严重衰减,难以获得理想的成像结果。针对这些问题,本团队提出了超亲水19F-MRI造影剂的设计和制备策略;合成了具有羧酸甜菜碱两性离子结构的N-(2-甲基丙烯酸乙酯) -N-(3, 3,3-三氟丙基)-N-甲基甘氨酸分子(CBF3),分子结构式如图1(左)所示,分子式为C12H19F3NO4+,分子量为298.28;具有分子量小,超亲水,代谢速度快等特点[18]。但其纵向弛豫率低,成像速度慢,成像时间窗较短,制约其作为19F-MRI造影剂的活体成像性能。为此,我们利用可逆加成断裂链转移(reversible addition-fragmentation chain transfer, RAFT)聚合制备均聚物(PCBF3),分子结构式如图1(右)所示,此方式不会降低分子结构中的氟含量。期望利用PCBF3结构中19F的自旋-自旋耦合作用,显著提高其纵向弛豫率和横向弛豫率,有效地提升成像速度和延长成像时间窗,改善成像性能。
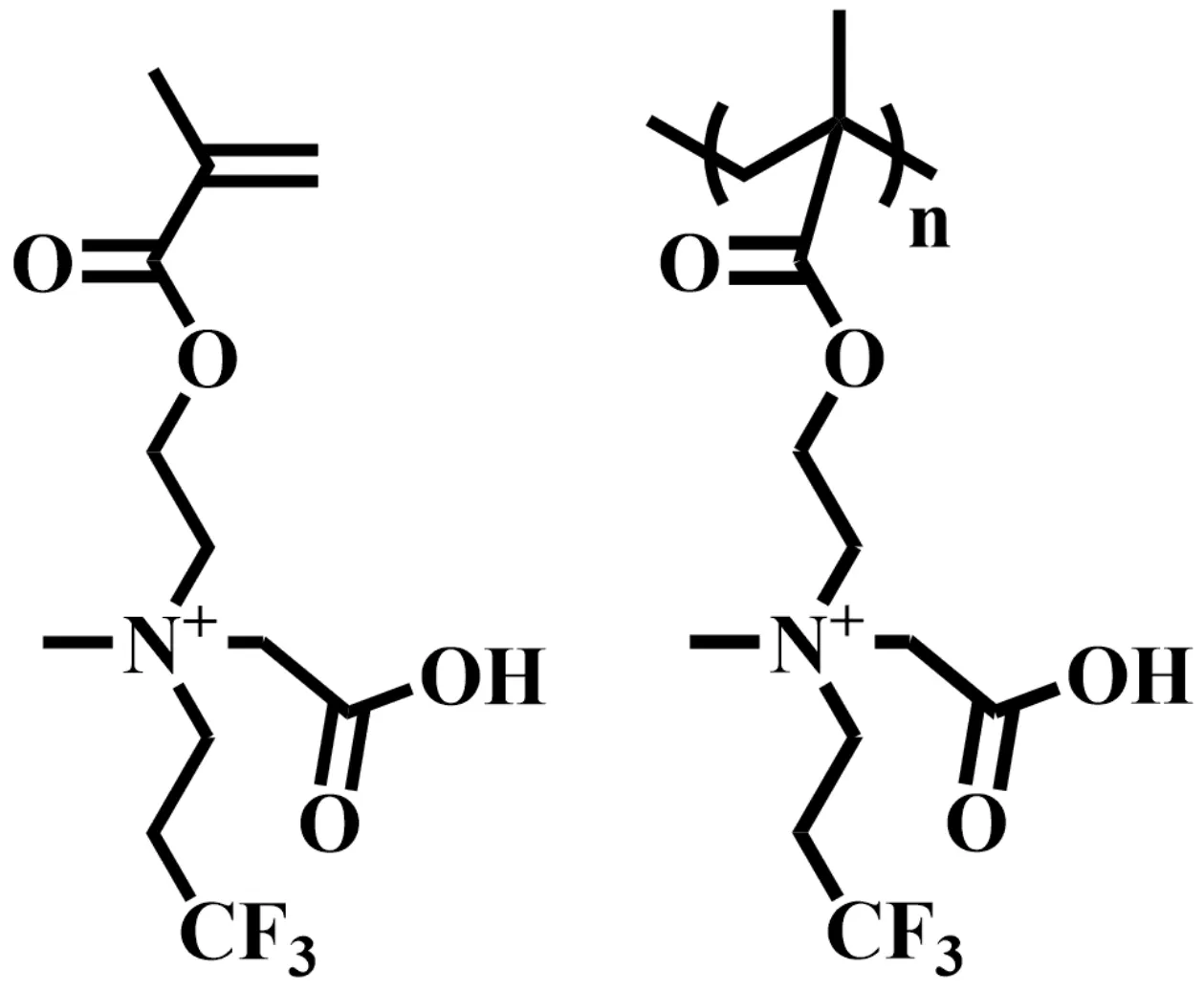
图1 氟化物单体和聚合物结构式 (左).单体分子结构;(右).聚合物分子结构
评价CBF3或PCBF3的成像性能包括体外和活体成像两部分。首先,采用多反转恢复时间(multi-TI-IR-SE)方法,定量计算下列成像参数:纵向弛豫值(R1)、横向弛豫值(R2)、磁化矢量(M19F),评估CBF3和PCBF3的体外成像性能并建立浓度相关标准曲线[19,20]。然后,通过标准曲线计算CBF3和PCBF3的活体浓度,评估CBF3或PCBF3的活体成像性能[21-23]。为了能够综合评估造影剂总注射量、代谢速度等因素对成像性能的影响,我们引入:活体成像利用率(imaging availability in-vivo, IAIV)。该参数主要衡量19F化合物注入体内后,某一时间点活体成像时,总注射剂量的实际可利用比率,比例越高表明该种19F化合物作为造影剂的成像利用率越高、成像时间窗越长,有望获得更好成像性能。
19F-MRI作为一种新兴的核磁成像技术,可对进入体内的外源含氟分子进行专一性可视化研究,在疾病精准诊断、量化示踪生物活性分子和细胞等方面具有重要的意义。因此,本研究中设计的化合物以及建立的评价方法,对优化19F化合物作为造影剂的成像性能,促进19F-MRI在生物医学领域应用具有重要作用。
1 实验方法
1.1 材料
CBF3由中国医科院生物医学工程研究所提供,分子式为C12H19F3NO4+,PCBF3由RAFT聚合制备。RAFT聚合合成方法:在shlenk反应管中依次加入RAFT转移剂苯基-(2-羟乙基)硫代碳酸酯(0.1 mM)、N-(2-氟乙基)-N-(2-甲基丙烯酸乙酯)-N-甲基甘氨酸单体(20 mM)、引发剂偶氮二异丁腈(0.01 mM)和溶剂二甲基甲酰胺(3 mL),抽真空/通氩气3个循环后,密闭反应管, 在68~72℃的油浴中反应24 h。反应结束后,加入DMF溶解,装入透析袋中(截留分子量3500 Da),用去离子水透析72 h,每12 h更换一次。之后,冷冻干燥得到PCBF3聚合物。可以通过调整单体和链转移剂的摩尔比,进而调控聚合物的聚合度。
1.2 体外37oC条件下19F-MRI成像
采用国家纳米科学中心小动物核磁共振谱像系统(Bruker Biospec 70/20 USR)对CBF3或PCBF3进行成像。将CBF3或PCBF3水溶液置于0.5 mL离心管中,浓度分别为20、401、680和100 mg/mL,利用循环水浴加热恒温至37℃,放入19F/1H双频鸟笼线圈中进行波谱检测和体外成像。采用multi-TI-IR-SE序列测量样本的19F-MRI图像,参数如下:TE/TR=1.88/5000 ms,TI=100/300/…/1100 ms, FA=90°, FOV=50×50mm, MTX=100×100, slice thickness=4mm, slice number=1, NEX=10。
体外成像参数R1、R2、M19F值的计算公式如下:
SI=M19F×(1-2×e(-TI×R1)+e(-TR×R1))×e(-TE×R2)
(1)
SI:采集的CBF3或PCBF3的信号强度;TI:反转时间;TR:重复时间;TE:回波时间。利用Levenberg-Marquardt算法进行曲线拟合,计算37oC时所有浓度CBF3或PCBF3的R1、R2、M19F值及它们与浓度的对应关系r1、r2、m19F值。
1.3 活体成像
Balb/c小鼠(雌,6~8周)尾静脉注射200 μL浓度100 mg/mL的CBF3或PCBF3,2小时后水合氯醛腹腔麻醉后,将小鼠放入19F/1H双频鸟笼线圈中,通氧气和循环水维持小鼠生理状态,检测CBF3或PCBF3在活体水平上的波谱。然后,将成像的工作频率与体外测量工作频率调节一致,进行活体19F-MRI图像采集,采用IR-SE序列,参数如下:TE/TR=1.88/5000 ms, TI=0ms, FA=90°, FOV=50×50mm, MTX=100×100, slice thickness=4mm, slice number=5, NEX=10。相应的,测量1H-MRI图像作为背景图,采用TSE序列,参数如下:TE=4.64ms, TR=300ms, FA=90°, FOV=50×50 mm, MTX=256×256, slice thickness=1mm, slice number=20, ETL=2。
1.4 活体成像速度计算
活体成像速度与MTX中的相位编码数量和TR参数相关,当TI=0、MTX值固定时,活体成像速度仅由TR决定。根据公式(1),在保持T1成分(1-e(-TR×R1))不变的情况下,根据R1值可以计算出对应的TR值。
1.5 活体浓度和活体成像利用率定量计算
定量计算CBF3或PCBF3活体浓度包括两个步骤,第一步:通过体外成像建立CBF3或PCBF3的SI与浓度对应的标准曲线;第二步:将活体成像采集的SI代入标准曲线,计算CBF3或PCBF3活体浓度分布[24-26]。选取活体成像时背景噪声的平均SI为阈值,计算对应的浓度阈值。然后将高于阈值的浓度分布图叠加到小鼠的1H-MRI图像上观察浓度分布。活体成像利用率IAIV计算公式如下:
(2)
C:体素i的浓度;V:体素i的体积;n:高于浓度阈值的体素个数;M:总注射量。然后计算活体成像时CBF3或PCBF3工作频率的谱峰信噪比与体外成像时同浓度同体积CBF3或PCBF3的谱峰信噪比的比值(RIA),将波谱结果与成像结果进行比较。
2 实验结果
2.1 R1值
37℃时PCBF3的R1值比CBF3的R1值显著升高(p=3.363*10-15< 0.001), R1值平均升高了约125.9%。如图2所示,PCBF3浓度与R1之间的相互关系r1=0.00003(p=0.0577>0.05),表明PCBF3的R1值与浓度之间无显著的线性关系,在该浓度范围内PCBF3的R1值为一个常数1.83 s-1;CBF3浓度与R1之间的相互关系r1=0.000015(p=0.0749>0.05),表明CBF3的R1值与浓度之间无显著的线性关系,在该浓度范围内CBF3的R1值为一个常数0.81 s-1。
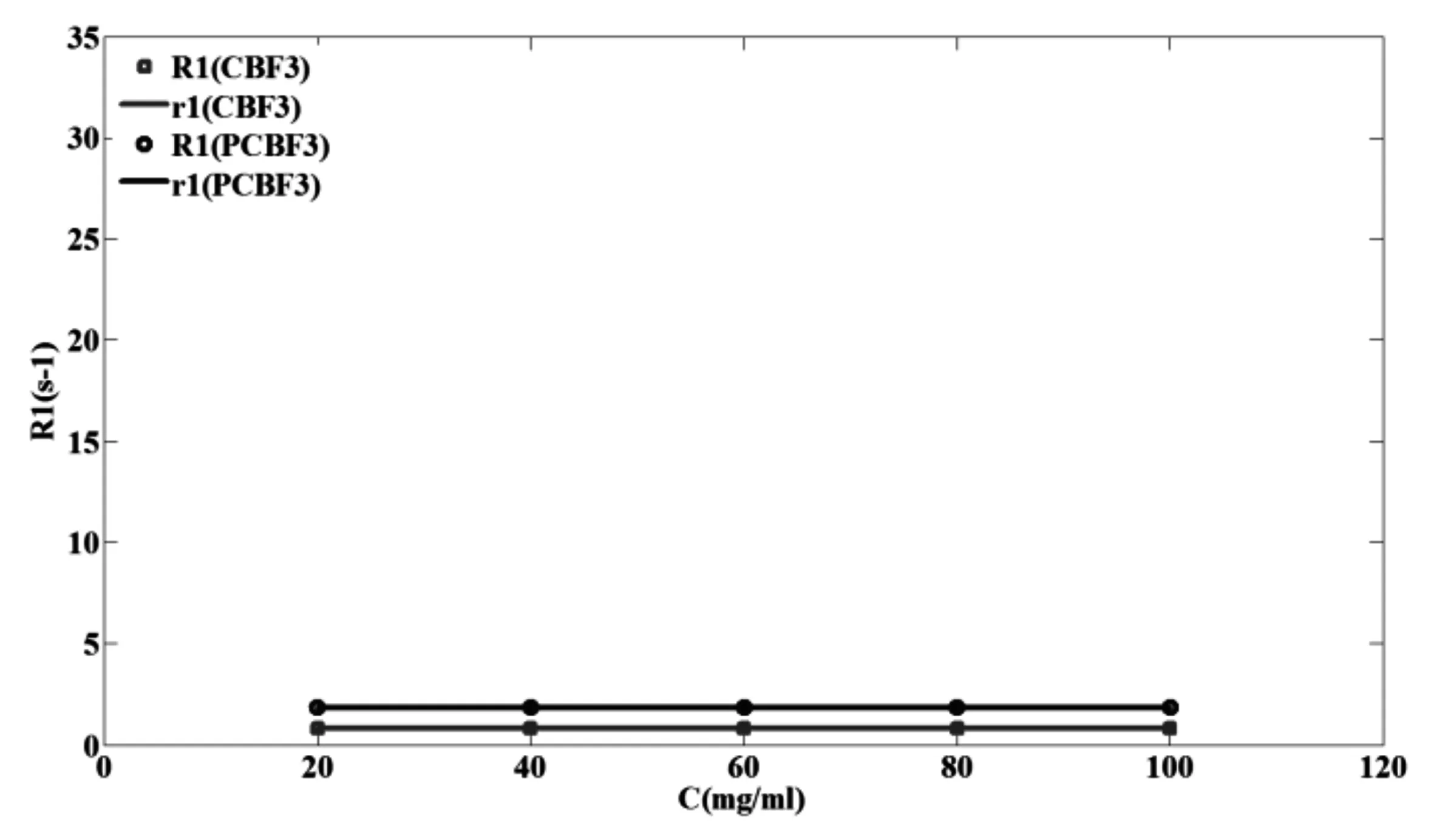
图2 CBF3和PCBF3的R1与浓度的线性关系r1
2.2 R2值
37℃时PCBF3的R2值比CBF3的R2值显著升高(p=4.192*10-19<0.001), R2值平均升高了约1126.9%。如图3所示,PCBF3浓度与R2之间的相互关系r2=0.00001(p=0.1393>0.05),这表明R2值与浓度之间无显著的线性关系,在该浓度范围内PCBF3的R2值为一个常数20.49 s-1;CBF3浓度与R2之间的相互关系r2=0.000001(p=0.1423>0.05),这表明R2值与浓度之间无显著的线性关系,在该浓度范围内CBF3的R2值为一个常数1.67 s-1。

图3 CBF3和PCBF3的R2与浓度的线性关系r2
2.3 M19F值
37℃时PCBF3的M19F值比CBF3的M19F值显著升高(p=0.005<0.01),M19F值平均升高了约32.3%。如图4所示,PCBF3浓度与M19F之间的相互关系m19F=0.316 (p=4.18*10-6<0.001),这表明M19F值与浓度之间存在显著的线性关系;CBF3浓度与M19F之间的相互关系m19F=0.241 (p=4.1*10-6<0.001),这表明M19F值与浓度之间存在显著的线性关系。根据公式(1),当TI时间固定后,CBF3或PCBF3的SI仅与M19F呈线性关系。

图4 CBF3和PCBF3的M19F与浓度的线性关系m19F
2.4 建立标准曲线
将公式(1)中TI/TE/TR分别设定为0/1.88/5000 ms时,根据上述参数计算结果,PCBF3的M19F值与SI之间的线性关系为:SI= 0.9621*M19F,浓度与M19F值的线性关系为:C= 3.169*M19F-2.701(R2=0.9995);CBF3的M19F值与SI之间的线性关系为:SI=0.9795*M19F,浓度与M19F值的线性关系为:C= 4.146*M19F-1.961。将PCBF3和CBF3各自的两组线性关系结合,PCBF3的标准曲线为:C= 3.294*SI-2.701(R2=0.9994),即CBF3的标准曲线为:C= 4.233*SI-1.961。
2.5 活体成像速度
CBF3活体成像时参数如下:R1=0.81s-1, NEX=10, TI=0, TR=5000 ms, acquired time=1140 s,CBF3活体成像时间为1140s。根据公式(1)如果PCBF3和CBF3的T1成分(1-e(-TR×R1))相同,则PCBF3活体成像时参数如下:R1=1.83 s-1, NEX=10, TI=0, TR=2213 ms, acquired time=505s, 即PCBF3活体成像时间为505s。
2.6 活体浓度及活体成像利用率
将活体成像时采集到的CBF3或PCBF3的SI分别代入各自的标准曲线计算,获得活体浓度分布图,结果如图5所示。体外、活体19F-MRS结果如图5右侧所示。图5a为CBF3的注射后2小时活体浓度分布图;图5b为PCBF3的注射后2小时活体浓度分布图。CBF3或PCBF3的活体成像利用率IAIV值和波谱分析结果RIA值,结果如表1所示。如图5a所示,尾静脉注射后2小时后其他脏器组织廓清,CBF3全部汇聚于膀胱。表1显示,CBF3注射后2小时的IAIV为8.3%,波谱分析计算出的RIA为8.1%,结果基本一致。如图5b所示,PCBF3注射后2小时广泛地分布在血管、各脏器、肌肉等区域。表1显示,PCBF3注射后2小时的IAIV为84.7%,波谱分析计算出的RIA为84.3%,两者基本一致。

表1 CBF3和PCBF3的IAIV和RIA

图5 CBF3和PCBF3的活体浓度分布图和波谱图左侧图a表示CBF3注射后2小时活体浓度分布图;左侧图b表示PCBF3注射后2小时活体浓度分布图;右侧上两幅图分别表示CBF3的体外和体内波谱图;右侧下两幅图分别表示PCBF3的的体外和体内波谱图。
3 讨论
本研究利用multi-TI-IR-SE方法在体外37oC温度条件下分别计算了CBF3和PCBF3的R1、R2、M19F值,并建立了CBF3和PCBF3的SI与浓度的标准曲线,依据各自的标准曲线,分别计算CBF3和PCBF3的活体成像利用率。
计算结果表明,PCBF3的R1、R2、M19F值均比CBF3的明显升高。PCBF3的R1值升高是因为其分子结构由CBF3重复单元通过碳碳键链接形成,分子量大,其进动频率与周围晶格的进动频率更接近,高能级19F原子更容易向周围晶格释放能量,纵向弛豫时间变短[27]。PCBF3的R2值升高是因为19F原子间自旋-自旋耦合作用更强,19F原子散相速度更快,横向弛豫时间更短[28]。虽然PCBF3的氟含量与CBF3相同,但CBF3分子量小,37℃时在主磁场中处于低能级的19F原子更容易跃迁至高能级。相比之下,PCBF3分子量大,37℃时在主磁场中处于低能级的19F原子不易跃迁至高能级。总的表现是PCBF3中低能级与高能级19F原子数量比值,相比CBF3增加,因而PCBF3的M19F更高[16-19]。
从信号强度贡献度来看,PCBF3或CBF3的SI均由T1、T2和M19F 3个成分组成。与同浓度的CBF3相比,R1值升高使得PCBF3的SI的T1成分增强了1.76%,R2值升高使得PCBF3的SI的T2成分减弱了3.48%,M19F值升高使得PCBF3的SI的M19F成分增强了约32.3%。因此,同浓度的PCBF3与CBF3之间的SI差别主要来源于M19F值。此外,如果和CBF3保持相同的T1成分信号强度贡献度,由于PCBF3的R1值升高活体成像速度可以提高约2.26倍。
从浓度依赖性来看,无论是PCBF3还是CBF3,仅M19F值具有浓度依赖性。37℃时,PCBF3或CBF3的R1值在20 ~ 100 mg/mL浓度范围内均为常数,其原因是在该温度下不同浓度两者的分子运动自由度差异很小[29]。PCBF3或CBF3的R2值在20 ~ 100 mg/mL浓度范围内均为常数,这是因为不同浓度PCBF3或CBF3的溶解性很好,没有分子间自旋耦合现象发生[29]。PCBF3和CBF3的M19F值与浓度均存在显著线性关系,这是因为M19F值是用来定量描述某一温度下处于主磁场中单位体积溶液里低能级比高能级多出来的19F原子总数,即成像可利用的19F原子密度,因而化合物浓度越高则19F原子密度越高,即M19F值越高[2]。
从活体成像来看,如图5a所示,活体浓度分布图表明CBF3在注射后2小时后,全部汇聚于膀胱,在其它组织很难检测到信号。图5中活体19F-MRS谱图显示,工作频率谱峰的信噪比很低,与单体的生物分布结果一致。表1结果显示,CBF3的活体成像利用率IAIV仅8%左右,表1波谱计算结果RIA为8.1%,与成像方法计算的结果基本吻合。综合表明CBF3在体内代谢速度很快,并未与体内蛋白或细胞等发生结合;该结果可归因于CBF3的分子结构,其分子量仅298,亲水性好,代谢速度非常快,因此各脏器的成像时间窗很短。如图5b所示,活体浓度分布图表明PCBF3在注射后2小时主要分布在腹主动脉、各脏器、肌肉等区域。PCBF3浓度的生物分布结果表明其较为稳定,代谢过程较长(代谢动力学分析和活体成像结果显示48小时后基本代谢完成)。表1结果显示PCBF3的活体成像利用率达到84%左右,波谱计算结果RIA与成像方法计算的结果基本吻合。从结构上来说,PCBF3的活性官能团得到保护,其结构稳定性高,分子量较大,代谢速度降低,成像时间窗更长。
综上所述,PCBF3的活体成像性能更好,但是也存在进一步优化的地方。比如19F-MRS谱图显示PCBF3的谱峰半高宽较宽,这将导致其19F原子在工作频率内吸收射频能量效率不一致,成像性能比理论水平有所降低;此外,PCBF3的R2值增高会带来成像信号的T2成分衰减。因此,下一步研究将重点探讨聚合度对PCBF3成像效能的影响,以及通过序列优化消除T2成分衰减的问题。
4 结论
本研究采用19F-MRS/MRI相结合的方法,定量分析了CBF3和PCBF3的成像性能。相比之下,PCBF3的活体成像利用率更高,可以延长成像时间窗、提升成像速度,成像性能更好;作为19F-MRI造影剂在活体核磁成像方面更具潜力。
