玉米淀粉在水-离子液体混合溶液中的相转变机制研究
2020-08-24项丰娟王书军秦仁炳
项丰娟,王书军,*,秦仁炳
(1.天津科技大学食品营养与安全国家重点实验室,天津300457;2.天津科技大学食品科学与工程学院,天津300457)
原玉米淀粉(native maize starch,NMS)是一种半结晶聚合物,主要由基本的线性直链淀粉和高度分支的支链淀粉分子组成。尽管其成分简单,淀粉颗粒呈现十分复杂的分层结构,对淀粉尺度大小的研究从纳米到微米都有相关研究报道[1-2]。淀粉颗粒中有序的多尺度结构,决定了淀粉可适合作为不同用途和功能及生物降解材料的优良原料,在食品工业中发挥重要作用[3]。对于开发新颖和环境友好的溶剂或增塑剂的研究,吸引了科研和相关企业工作者极大的兴趣,将新颖和环境友好的溶剂或增塑剂用于原生淀粉,使得淀粉颗粒转化为理想的具有独特的功能产品成为目前淀粉研究的热点之一[4-5]。淀粉的溶解或塑化的试剂有多种类型,淀粉增塑剂通常包括:多元醇(例如甘油、乙二醇、山梨糖醇)或含胺化合物(尿素、氨化物)[4-5]。淀粉的溶解溶剂主要有:二甲基亚砜(dimethyl sulfoxide,DMSO)和无机强碱(如KOH和NaOH)[6]。而一些新型溶剂,如:n-甲基吗啉-n-氧化物(n-methylmorpholinen-oxide,NMMO)和熔融咪唑也具有较好的溶解淀粉颗粒能力[6-9]。在这些新型溶剂体系中,研究淀粉相转变过程中的结构变化规律,深入开发具有良好特性的淀粉产品,将为制备不同凝胶化程度的淀粉原料开辟道路。
离子液体(ionic liquid,IL)是一类熔点低于100℃的有机盐[9]。它们主要由有机阳离子和有机或无机阴离子组成,可以作为传统有机溶剂的替代品[10-11]。离子液体能够有效的溶解碳水化合物类物质,如:纤维素[12-14],木质素[15-17],淀粉[18-21]和甲壳素以及壳聚糖等[22],引起了人们的广泛关注。在25℃条件下,一些离子液体(含Cl-或[OAc]-阴离子)能破坏淀粉侧链羟基之间的氢键,从而破坏了原淀粉颗粒的半晶体结构[20,23-26]进而导致淀粉的溶解。
目前已经有多篇关于离子液体或离子液体和水混合溶液对淀粉凝胶化行为影响的报道[7,27-28]。这些研究主要集中在淀粉在不同离子液体:水混合物中的差示扫描量热法(differential scanning calorimetry,DSC)相转变规律,对于在相变过程中的分子机制(即相变过程中的多尺度结构变化)还缺乏深入探讨。因此,本研究的目的是通过研究玉米淀粉(maize starch,MS)在不同摩尔比的水和离子液体溶液中相转变规律,并结合玉米淀粉在相转变中的多尺度结构变化,揭示淀粉相转变过程中的分子机制,为离子液体在淀粉中的应用提供理论指导。
1 材料与方法
1.1 材料与仪器
玉米淀粉(一级)、烯丙基氯、N-甲基咪唑:美国Sigma公司;氯化钠、无水乙醇(分析纯):国药集团化学试剂有限公司;乙酸乙酯(分析纯):天津市科密欧化学试剂有限公司。
BT25S分析天平(精确至0.1 mg)、BL610分析天平(精确至 1 mg):美国 Sartotius公司;RVA-techmaster快速黏度分析仪:澳大利亚博通公司;OMH100电热恒温干燥箱:美国Thermo公司;Scientz-10N真空冷冻干燥机:宁波新芝生物科技股份有限公司;Vortex涡流混匀器:海门市其林贝尔仪器制造有限公司;JSMIT300LV扫描电子显微镜:日本电子公司;DSC200 F3差示扫描量热仪:德国NETZCH公司;TENSOR II傅立叶变换红外光谱仪:德国布鲁克公司;D:max-2500kv/pc广角X射线衍射仪:日本岛津公司;inVia Reflex激光共聚焦拉曼光谱:英国雷尼绍公司。
1.2 试验方法
1.2.1 离子液体[AMIM]Cl的制备
添加 N-甲基咪唑(4.11 g),烯丙基氯(4.60 g)和20 mL乙酸乙酯到一个三口的圆底烧瓶中,反应过程中伴随着磁力搅拌和循环冷凝水,在氮气的保护条件下,于60℃反应6 h。反应结束后,通过旋转蒸发除去过量的烯丙基氯,用乙酸乙酯萃取除去未反应的N-甲基咪唑。然后真空干燥48 h得到具有黏性的黄色离子液体[29-30]。
1.2.2 差示扫描量热法
差示扫描量热法(DSC)测量是使用差示扫描量热仪(200F3,Netzsch,德国),并配备了热分析数据站。准确称量玉米淀粉3.0 mg,放入DSC铝坩锅中。在DSC锅中加入水和离子液体混合溶液,水和离子液体混合溶液:淀粉的比例为3∶1(质量比)。轻轻摇动坩埚,以确保混合溶液与淀粉充分接触,并完全浸入,密封,然后用DSC仪器立即检测。测试条件是以10℃/min的速度从20℃加热到120℃。用空坩埚作对照,吹扫氮气流速设为50 mL/min,保护氮气流速设为100 mL/min。使用仪器自带软件Proteus61分析计算淀粉的凝胶化起始温度(To)、峰值温度(Tp)、终止温度(Tc)和凝胶化焓值(ΔH)[31]。
对水和离子液体的摩尔比为3∶1和2∶1,玉米淀粉呈现比较复杂的热分析图。在热分析图上,对于这些复杂的相转变,定义并且确定了5个温度点。To定义为初始放热的起始温度,Tc被定义为随后吸热的凝胶化终止温度,Tp1代表了放热峰的峰值温度,Tp2代表了吸热峰的峰值温度,Tm代表了Tp1和Tp2的中间温度。
1.2.3 淀粉样品的制备
为了满足样品材料表征淀粉在DSC相转变过程中的结构变化,因此样品的制备采用快速黏度分析仪(rapid visco analyser,RVA),模拟 DSC 加热水:离子液体-淀粉系统,无机械搅拌,运用程序与上述DSC仪器上测量的加热条件相同[32-33]。由于RVA仪器的加热温度最高设置为95℃,所以对于淀粉-纯离子液体的混合溶液,使用油浴锅来制备淀粉在Tc时的样品。精确称量大约1 g原淀粉到RVA容器中,用移液枪吸取水和IL的混合溶液,获得混合溶液∶淀粉比为3∶1(质量比)。在RVA容器中用玻璃棒轻轻搅拌混匀,然后分别加热到To,Tp和Tc。对于摩尔比为3∶1和2∶1的水∶离子液体混合溶液,淀粉样品同时也被加热到了Tp1,Tm和Tp2。加热到指定的温度后,淀粉样品用25 mL的无水乙醇洗涤,搅拌,6 800×g离心15 min,除去离子液体。重复两次洗涤,在通风橱中过夜蒸发除去残留的乙醇。然后淀粉样品再加入3倍的去离子水(与淀粉-纯水系统保持一致),冷冻干燥,研磨成粉末,通过100 μm筛。淀粉-纯水系统,加热后的淀粉样品没有用乙醇中洗涤,直接冷冻干燥过筛。
1.2.4 傅里叶转换红外光谱
采用红外光谱仪(TENSOR II)检测RVA加热后的冷冻干燥的淀粉样品,光谱的扫描范围在4 000 cm-1~400 cm-1,扫描累加64次,分辨率为4 cm-1。试验前,先用干燥后的150 mg溴化钾压片,作为背景扫描。然后称取2 mg的淀粉样品于150 mg的溴化钾中研磨,压片(20MPa,1min),检测。所有光谱在 1200cm-1~800cm-1的范围进行基线校正,所有的光谱采用OMNIC 8.0进行处理。设定样品光谱的半峰宽为19 cm-1和增强因子为1.9。用1 047∶1 022 cm-1的比值估计淀粉的短程有序结构[34]。
1.2.5 激光共聚焦显微拉曼光谱
淀粉样品的激光共聚焦显微拉曼光谱图是通过拉曼光谱仪获得,将少量冻干研磨过筛的淀粉样品用载玻片压至紧实平整,在莱卡显微镜视野中选择清晰界面进行激光测试,激光光源为波长785 nm的绿色二极管。具体测试参数为:扫描范围为100 cm-1~3200 cm-1,激光功率为50%,每个样品至少采集6个不同的点,根据拉曼光谱中波数480 cm-1的半峰宽代表着的淀粉分子的短程有序性结构[11,35],使用仪器自带软件WIRE 2.0处理样品图谱,并记录半峰宽数据[36]。
1.2.6 广角X-射线衍射
用D/max-2500 kv/pc X射线衍射仪进行X射线衍射图谱分析。为了使淀粉样品在测量前达到恒定的湿度,将所有的样品,储存在一个盛有饱和NaCl溶液的密闭器内平衡 7 d。XRD 的扫描范围是 5°~35°(2θ),扫描速度为1°/min和步长为0.02°。计算相对结晶度是结晶区的面积与 5°~35°(2θ)之间总面积的比例,所得的图谱是采用 Origin 8.0(Version 8.0,Microcal Inc.,Northampton,MA,USA)进行处理。淀粉相对结晶度=结晶区面积÷总面积×100[33,37]。
1.2.7 扫描电子显微镜
将冷冻干燥的样品固定在导电胶上,喷金,然后放置在样品室中,在5 kV的电压下,用扫描电子显微镜观察淀粉颗粒的微观结构。
1.3 数据处理
所有的分析都至少做3个平行处理。数据结果的表示方法为平均值±标准偏差。运用SPSS 17.0统计分析软件程序,采用Duncan’s多重比较进行方差分析,p<0.05的说明平均值之间的显著差异。所有的图均用Origin 8.0制作。
2 结果与分析
2.1 玉米淀粉的热力学特性
玉米淀粉在水和离子液体不同摩尔比的混合溶液中的DSC相转变图见图1所示。
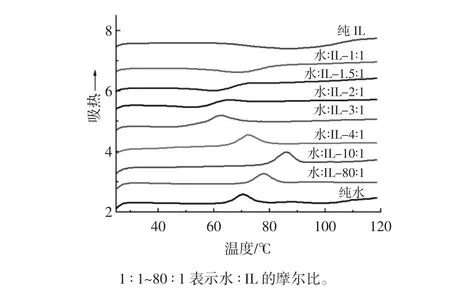
图1 玉米淀粉在水-IL混合溶液中的凝胶化图Fig.1 Thermograms of maize starch in water-IL mixtures
从图1可以观察到不同摩尔比的水-离子液体溶液对玉米淀粉的相转变产生了规律性的影响。结果表明,随着水和IL摩尔比逐渐下降,玉米淀粉的凝胶化峰从一个单一的吸热峰到先有一个放热峰随后伴随着一个吸热峰,最后是一个单一的放热峰逐步过渡的变化趋势。当水和IL摩尔比逐渐下降到10∶1,玉米淀粉单一凝胶化吸热峰逐渐转移到更高的相转变温度。然而随着水和IL摩尔比的进一步下降,导致玉米淀粉凝胶化吸热峰转移到较低的温度,这仍然高于淀粉水混合物吸热凝胶化温度。在水和IL的摩尔比为3∶1和2∶1时,观察到玉米淀粉的一个复杂的DSC吸热谱图(图1)。在水和IL的摩尔比为3∶1,先有一个小的放热峰到紧接着一个明显的吸热峰。在水和IL摩尔比为2∶1的情况下,观察到一个大的放热峰,然后紧接着与之重叠的一个吸热峰。随着水和IL摩尔比的进一步下降,只有一个单纯的放热峰。
玉米淀粉在水和离子液体不同摩尔比的混合溶液中的DSC相转变相转变参数见表1。
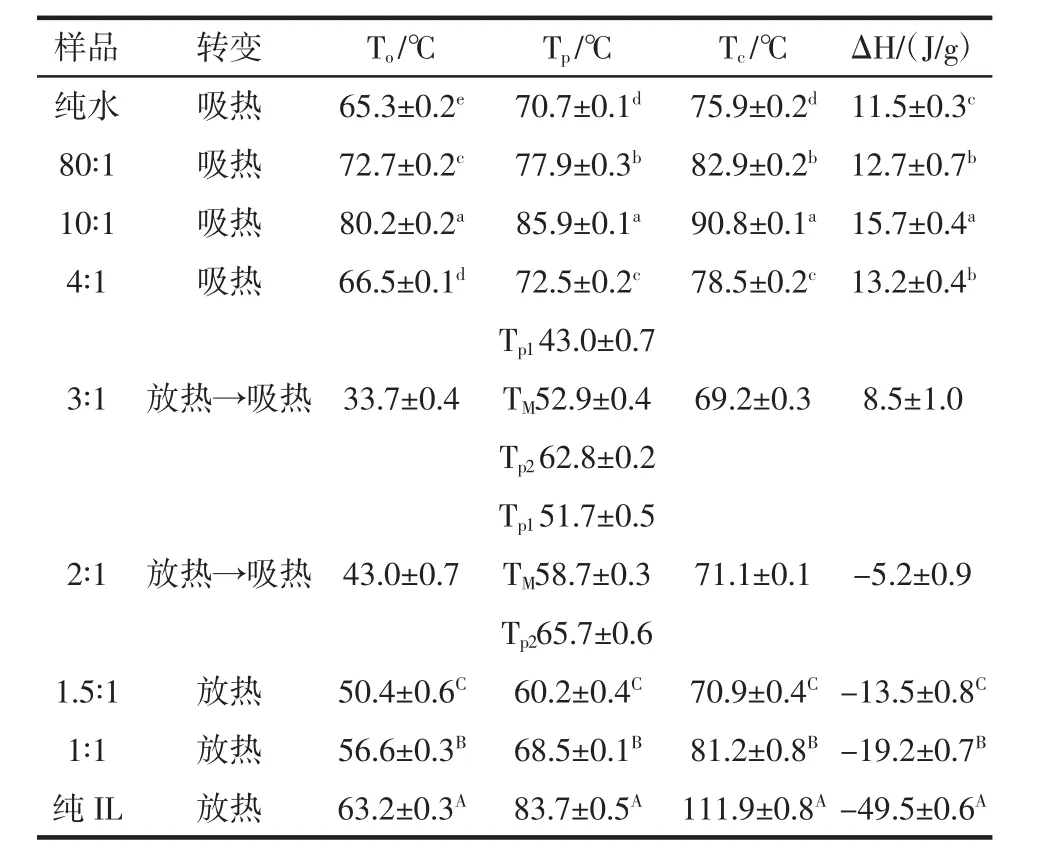
表1 在不同摩尔比的水-IL混合液中玉米淀粉的DSC结果Table 1 DSC results of maize starch in various mole ratios of water-ILmixtures
从图1可以观察到在纯水系统中玉米淀粉DSC加热过程表现为在65.3℃和75.9℃之间有个很好的凝胶化吸热峰。当水和IL摩尔比逐渐下降到10∶1,玉米淀粉单一凝胶化吸热峰逐渐转移到更高的相转变温度。然而随着水和IL摩尔比的进一步下降,导致玉米淀粉凝胶化吸热峰转移到较低的温度,这仍然高于淀粉水混合物吸热凝胶化温度。在水和IL的摩尔比为10∶1,焓变(△H)从纯水 11.5 J/g增加到 15.7 J/g,然后在水和IL的摩尔比为4∶1,减少到13.2 J/g。
在水和IL的摩尔比为3∶1其吸热焓变为8.5 J/g。在水和IL摩尔比为2∶1的情况下,放热焓变为5.2 J/g。随着水和IL摩尔比的进一步下降,只有一个单纯的放热峰。淀粉水和IL的摩尔比从1.5∶1降到0时,放热焓变从13.5 J/g增加到49.5 J/g。
2.2 短程有序性结构
利用红外光谱(Fourier transform infrared,FTIR)和拉曼光谱对DSC加热过程当中淀粉的双螺旋结构的短程有序性进行了检测。在1 047 cm-1~1 022 cm-1之间的红外波段吸收峰分别代表着淀粉结构的结晶区和非晶区,而1 047 cm-1∶1 022 cm-1的比值常被用作表征淀粉有序结构的标尺[33]。玉米淀粉在1 200 cm-1~800 cm-1范围内红外光谱图如图2所示。
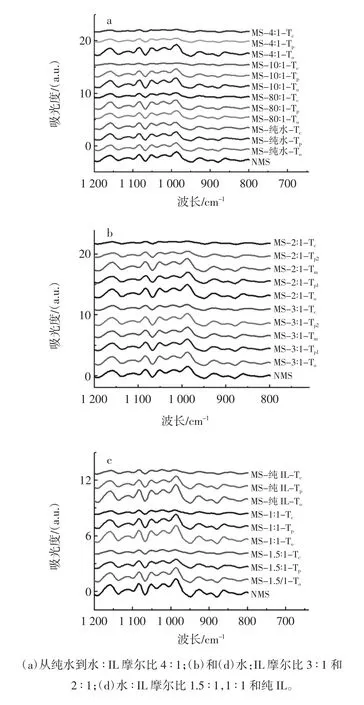
图2 RVA加热处理得到的淀粉样品的红外光谱图Fig.2 The FTIR spectra of starch samples heated in RVA canisters
从图2可以观察到,玉米淀粉在水和离子液体的混合溶液处理后的红外吸收峰的强度,随着RVA加热终止温度的增加而降低,表明淀粉中短程有序性结构被破坏淀粉的红外吸收强度下降趋势在Tp到Tc要比To到Tp下降趋势明显,暗示淀粉的短程有序性在Tp之后逐渐被破坏。
不同摩尔比的水和离子液体的混合溶液对玉米淀粉处理后的拉曼光谱如图3所示。
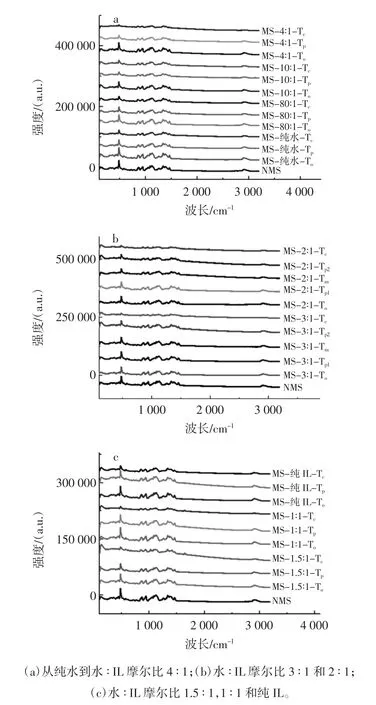
图3 RVA加热处理得到的淀粉样品的拉曼光谱图Fig.3 The LCM-Raman spectra of starch samples heated in RVA canisters
除了吸光度强度的变化,所有的淀粉样品在LCM-拉曼光谱上都呈现相似的峰型(图3)。在480、865、943、1 264 cm-1和 2 900 cm-1中观察到几个明显的吸收峰,分别与 δ(CH2)、νs(C1-O-C4)、νs(C1-O-C5)、(C-C-O)振动和ν(c-H)模式相对应。淀粉有序结构在480 cm-1和2 900 cm-1的吸收峰的变化很敏感[33]。随着RVA加热的温度的增加,拉曼480 cm-1处吸收峰的强度逐渐降低。
2.3 长程有序性结构
RVA加热后的淀粉样品,原淀粉和冷冻干燥淀粉样品的X-射线衍射图如图4所示。
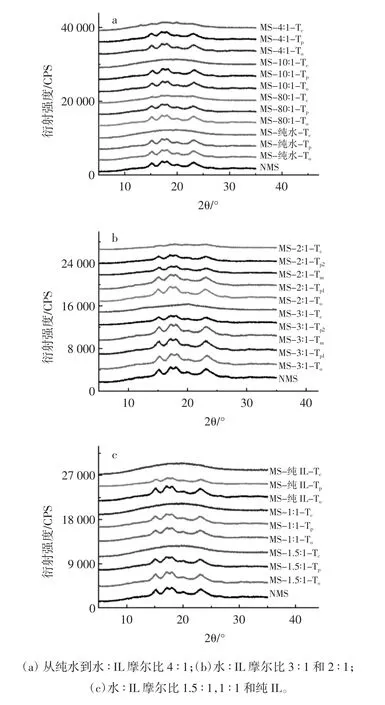
图4 RVA加热处理得到的淀粉样品的X-射线衍射光谱图Fig.4 The XRD diffraction patterns of starch samples heated in RVA canisters
通过X-射线衍射图可以观察到原玉米淀粉在的15°、17°、18°和 23°(2θ)呈现 4 个典型的 A 型淀粉的特征峰。对于在DSC上呈现单一凝胶化吸热峰的淀粉样品,在加热温度为Tp,淀粉样品的峰值强度和相对结晶度显著下降,但仍然显示典型的A型X-射线衍射峰。加热到To,衍射峰几乎没有变化,表明淀粉晶体结构没有被破坏。在水和IL摩尔比为3∶1和2∶1,RVA加热到To,Tp1和Tm时,衍射峰基本上保持不变,相对结晶度也不变,与FTIR和拉曼结果一致。
RVA加热后的淀粉样品,原淀粉和冷冻干燥淀粉样品的短程有序性和长程有序性结构如表2所示。
表2显示了在不同摩尔比的水和离子液体的混合溶液中,玉米淀粉在红外吸收光谱上1047cm-1∶1022cm-1的比值。RVA加热处理的样品,在水和IL摩尔比大于3∶1时,加热温度从Tp到Tc淀粉的在红外吸收光谱上1 047 cm-1∶1 022 cm-1的吸收比值比To到Tp下降幅度更显著,说明Tp以上的温度能破坏更多的短程有序性结构,与之前用于小麦淀粉-水系统做的结果一致[33]。当水和IL摩尔比值为3∶1和2∶1,在淀粉的放热峰期间(To,Tp1和 Tm),其吸光度在 1 047 cm-1∶1 022 cm-1的比值基本上保持不变(表2),表明淀粉分子的短程有序性结构没有被破坏。当温度达到Tp2(凝胶化吸热峰的峰值温度),淀粉的短程有序性明显遭到破坏,在加热到Tc时,淀粉的短程有序性进一步变差。当水∶IL摩尔比值低于2∶1时,从To到Tp时,淀粉样品在1 047 cm-1∶1 022 cm-1吸光度的比值无显著差异,但加热到Tc时,淀粉的短程有序性明显降低。然而纯IL加热处理玉米淀粉,其短程有序性变化趋势与玉米淀粉在水和IL的摩尔比大于3∶1的处理组的变化趋势呈现类似的结果。
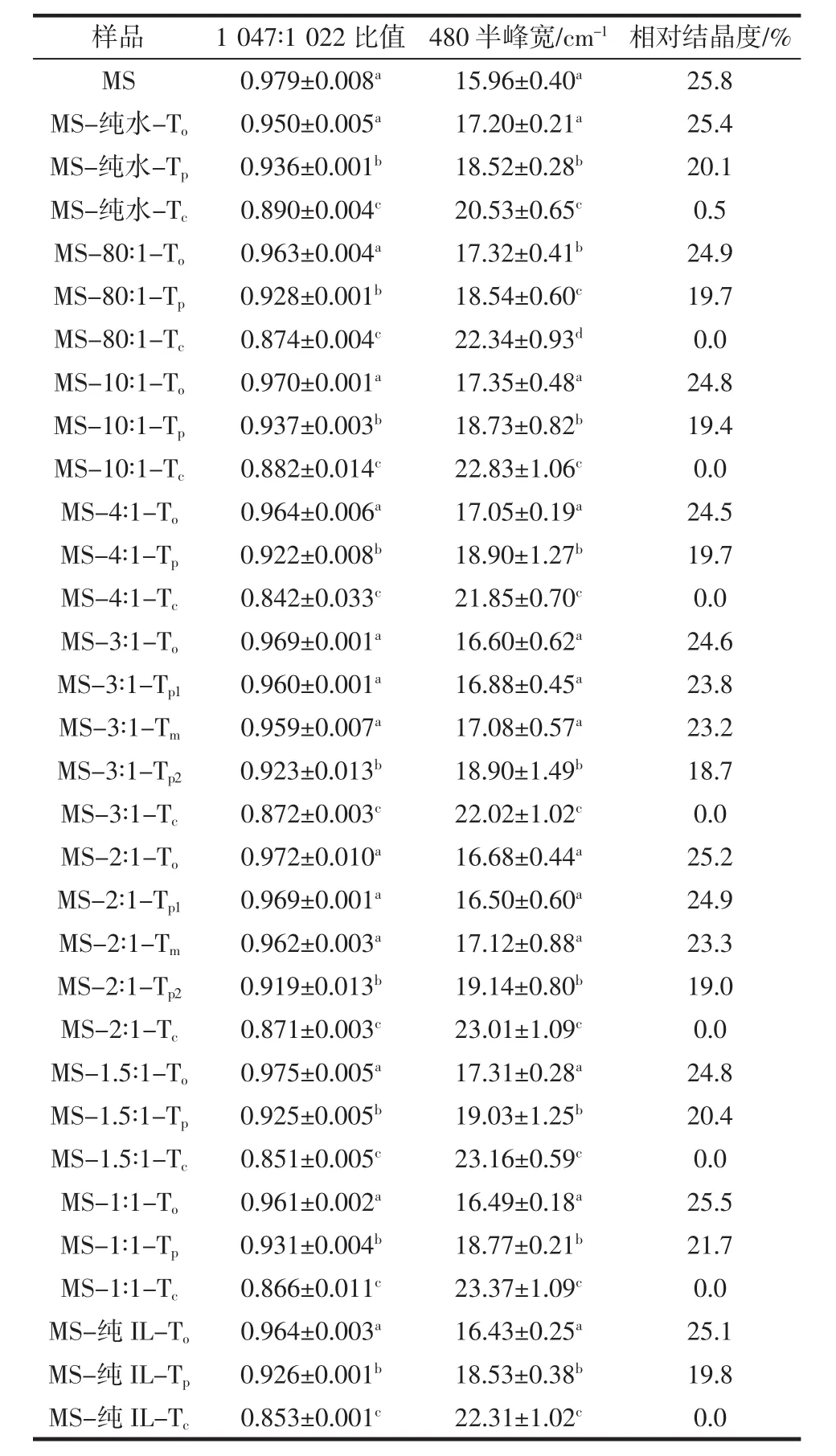
表2 不同的温度加热淀粉样品的短程与长程有序性结构Table 2 Short-and long-range ordered structures of starch samples heated at different temperatures
在480 cm-1的吸收峰的半峰宽(full width at half maximum,FWHM)是淀粉结构有序程度的标尺,这是与淀粉的相对结晶度有关[34,38]。随着RVA加热的温度的增加,拉曼480 cm-1处吸收峰的强度逐渐降低,与先前的研究一致[33,39,40]。FWHM 淀粉随着 RVA 加热的温度升高而增加,表明在相转变过程中,淀粉分子短程有序结构逐渐破坏(表2)。对不同温度下的淀粉样品的红外光谱分析结果也有类似的趋势[31,35,38,41]。
随着加热温度到Tp2,X-射线衍射峰的强度显著降低,相对结晶度也下降(表2)。在加热到Tc时,衍射峰几乎消失,表明淀粉晶体完全被破坏。在水和IL摩尔比为1.5∶1或1∶1,在加热到Tp时,衍射峰没有明显变化,但在加热到Tc时,淀粉晶体的衍射峰消失了。在纯IL系统中,淀粉加热到Tp时,其相对结晶度明显下降,在加热温度为Tc时晶体结构基本消失(表2)。
RVA加热后的淀粉样品,原淀粉和冷冻干燥淀粉样品的扫描电镜图如图5所示。



图5 RVA加热处理得到的淀粉样品的扫描电镜图(放大倍数3000×)Fig.5 SEM images of starch samples heated in RVA canisters(magnification 3000×)
在放热的相转变阶段(从To到Tm),除少量微粒膨胀之外,大部分淀粉颗粒仍保持相对完整性。值得关注的是,在水和 IL 混合物(1.5∶1 和 1∶1)中加热到 Tp的淀粉样品,仍然有清楚可见的颗粒。加热到Tc时,所有淀粉颗粒都被完全破坏。这些结果表明,颗粒的形态变化与DSC、FTIR、Raman、XRD等都有很好的一致性。
3 结论
研究不同摩尔比水-离子液体对玉米淀粉相转变的影响。随离子液体比例的增加,玉米淀粉的凝胶化峰发生了显著变化,从一个单纯的吸热峰,到先有一个小的放热峰再伴随着较大的吸热峰,最后到一个单纯的放热峰的变化趋势。在相转变的起始温度(To)时,淀粉颗粒结构几乎没有被破坏,但是当在相转变的终止温度(Tc)时,淀粉颗粒结构完全被破坏。在3∶1和2∶1条件下,由于离子液体和淀粉无定型区域的相互作用导致了淀粉的凝胶化峰,呈现出先有一个小的放热随后紧跟着一个大的吸热峰。
