猪圆环病毒3型实时荧光定量PCR检测方法的建立及应用
2020-08-12畅通刘飞
畅通,刘飞
(上海海利生物技术股份有限公司,上海兽用生物制品工程技术研究中心,上海 201403)
猪圆环病毒(porcine circovirus,PCV)为圆环病毒科(Circoviridae)、圆环病毒属(Circovirus)的成员。无囊膜,不具有血凝活性,是目前人类发现的最小的动物病毒[1]。PCV主要有两种血清型,即PCV1和PCV2。PCV1对猪的致病性较低,尚没有试验证明其具有感染性;PCV2对猪的危害性极大,可引起仔猪断奶后多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)和母猪繁殖障碍等[2-3]。
自2010年开始一种有圆环病毒特征的新型病毒被陆续报道,但未确定其种属。直到2016年才将该病原体命名为猪圆环病毒3型(PCV3)[4-5]。同年3月,在我国辽宁、江西、重庆3个地区猪场共计356头母猪,先后发生繁殖障碍导致新生仔猪死胎率达到5.02%~20.1%,母猪死亡率达到5.4%~10.5%,利用RT-qPCR或qPCR对相关病原进行检测后,发现只有PCV3显示阳性[6]。2017年初,首次检出并公布PCV3在我国流行[6]。目前国内猪圆环病毒3型分为2个簇,即3a和3b。美国PCV3分离株PCV3-USA-MO2015(KX778720.1)属于3a簇群。为了检测PCV3 流行情况,国家兽用药品工程技术研究中心收集福建、河北、河南等8个省份发病猪场189份临床样品,阳性率达到12.7%;同时,该中心利用PCV3 ELISA抗体检测方法检测了江西、安徽、河南等14个省份908份血清样品,阳性率高达 48.02%[4-6]。由此可见,PCV3早已广泛流行于我国猪群中。
实时荧光定量PCR(qPCR)技术具有精确度高、特异性强、重复性好、自动化程度高的优点[7-8],目前已广泛应用于各种动物病原的快速检测。本试验拟建立PCV3的荧光定量PCR检测手段,以期为疫苗研发、生产检验及流行病学检测等提供一种快捷可靠的技术。
1 材料与方法
1.1 病料及阳性质粒来源
PCV3阳性猪血清采自湖北某猪场;PCV2、猪繁殖与呼吸综合征病毒(PRRSV)、猪流行性腹泻病毒(PEDV)、猪细小病毒(PPV)、伪狂犬病毒(PRV)及猪瘟病毒(CSFV)阳性质粒均由本实验室鉴定并保存。
1.2 主要试剂及仪器
病毒基因组DNA/RNA提取试剂盒和质粒提取试剂盒购自天根生化科技(北京)有限公司,Premix Ex TaqTM(Probe qPCR)和pMD18-T载体购自宝生物工程(大连)有限公司,steponeplus 实时荧光定量PCR仪和普通PCR仪为美国ABI公司产品。
1.3 引物的设计与合成
根据GenBank上发布的PCV3的Cap基因的核苷酸序列(序列号:AYA44222.1),通过MegAlign软件比对序列,选择一段相对保守序列的区域,利用Primer Premier 5.0软件进行分析,设计特异性qPCR引物和探针。上游引物序列为PCV3-Fq:GAGGCTTTGTCCTGGGTGAG,下游引物序列为PCV3-Rq:ATGCGGAAAGTTCCACTCGT,荧光探针序列为PCV3-CAP-Pq:CCGTTACTTCACCCCCAAACCAATTCT,预计扩增的目的片段长度为113 bp。引物探针均由生工生物工程(上海)股份有限公司合成。
1.4 质粒标准品DNA模板的制备
按照病毒基因组DNA/RNA提取试剂盒的操作说明书,提取PCV3阳性毒株的DNA,并以此DNA为模板,使用上述荧光定量PCR引物进行PCR扩增。50 μL扩增体系为:Premix Taq预混酶25 μL,上、下游引物各2 μL,模板2 μL,ddH2O 19 μL。反应程序为:94 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸20 s,30个循环;最后72 ℃延伸10 min。采用1%浓度的琼脂凝胶电泳对PCR产物进行验证。
使用琼脂凝胶回收试剂盒对初步验证正确的PCR产物进行切胶、回收、纯化,然后与载体pMD18-T连接,转化至DH5α感受态细胞中,氨苄平板上挑取单菌落,过夜摇菌后提取重组质粒标准品。使用NANODROP 2000核酸蛋白仪对质粒质量浓度进行测定,结果为395 ng/ μL。将质粒标准品进行qPCR验证,同时送生工生物工程(上海)股份有限公司进行测序。
1.5 TaqMan荧光定量PCR反应条件的优化
为获得较为理想的Ct值,提高反应灵敏性,分别对退火温度、荧光探针与模板添加量的比例进行优化试验,筛选出Ct值最小时对应的最优退火温度、荧光探针与模板添加量的比例。退火温度分别为50 ℃、52 ℃、54 ℃、56 ℃、58 ℃、60 ℃,荧光探针与模板的比例分别为1∶1、1∶2、2∶1。每次试验均设立对照(no template control,NTC)。
1.6 标准曲线的建立及敏感性试验
采用1.5确定的最佳qPCR反应条件和反应体系,使用灭菌ddH2O将质粒标准品经10倍梯度稀释(10-1~10-8)后作为模板进行实时荧光定量PCR扩增反应,反应完毕由系统自动绘制生成标准曲线。
1.7 特异性试验
以PCV3、PCV2、PRRSV、PEDV、PPV、PRV、CSFV阳性质粒为模板,通过建立的荧光定量PCR体系进行qPCR反应,同时设立NTC对照,以此来评价该方法的特异性。
1.8 重复性试验

1.9 临床样本的检测
取本实验室保存的湖北某猪场的72份猪血清,使用病毒基因组DNA/RNA提取试剂盒提取病毒基因组,采用上述已建立好的TaqMan荧光定量PCR方法和普通PCR方法进行检测。
2 结果
2.1 标准品质粒构建
提取PCV3的DNA经设计的特异性引物PCR扩增后获得预期大小的片段。然后回收目的片段、连接、转化,挑取典型单菌落摇菌后提取重组质粒标准品。通过PCR、酶切及测序鉴定,构建的重组质粒标准品正确。PCR扩增出现645 bp的目标条带,阴性对照无特异性条带出现(见图1)。

M.DNA分子质量标准;1.增的PCV3目的片段;2.阴性对照图1 PCR 扩增
2.2 TaqMan荧光定量PCR反应条件的优化
经过一系列荧光定量PCR反应条件的优化(见表1),得到最优反应体系为:Premix Ex Taq(2×)10 μL,ROX Reference Dye(50×)0.5 μL,上下游引物各0.5 μL,荧光探针0.5 μL,模板2 μL,ddH2O 6 μL。最优反应程序为:95 ℃ 10 min,95 ℃ 15 s,54 ℃ 1 min,40个循环。

表1 荧光定量PCR反应条件的优化结果
2.3 荧光定量 PCR 标准曲线的绘制
将质粒标准品做10倍梯度稀释后作为模板,采用上述优化的qPCR体系和程序进行PCR反应,得到不同浓度模板的扩增曲线(见图2)。以起始模板浓度的对数为横坐标,荧光Ct值为纵坐标绘制标准曲线(见图3)。如图3所示,样品初始模板的浓度(x)与Ct值(y)的线性关系式为:y=-3.266x+37.41,斜率为-3.266,截距为34.939,相关系数R2为1,扩增效率为102.371%。
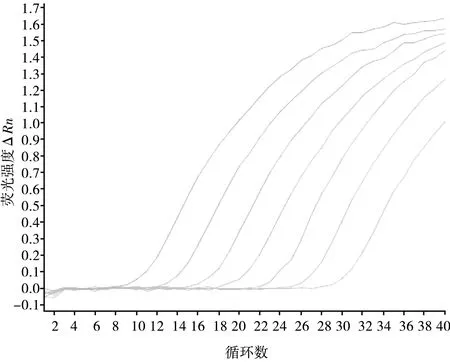
图2 以不同浓度的标准质粒为模板制作的扩增曲线

图3 实时荧光定量PCR标准曲线
2.4 特异性试验
采用已建立好qPCR方法对PCV3、PCV2、PRRSV、PEDV、PPV、PRV、CSFV阳性质粒进行检测,结果显示,只有PCV3阳性质粒的检测结果为阳性,其他均为阴性(见图4)。将PCV3 qPCR扩增产物进行琼脂凝胶电泳检测,仅在113 bp处扩增出1条特异性条带,结果与预期大小相符(见图5)。

A.PCV3阳性质粒;B~G.分别为PCV2、PRRSV、PEDV、PPV、PRV、CSFV的阳性质粒。图4 实时荧光定量PCR特异性的检测

M. DNA 分子质量标准;1.荧光特异性引物的扩增产物;2.阴性对照图5 荧光特异性引物的PCR检测
2.5 灵敏性试验
将PCV3 qPCR扩增产物进行琼脂凝胶电泳检测,仅在113 bp处扩增出一条特异性条带,结果与预期相符(见图5)。
将PCV3阳性样品10倍梯度稀释作为模板,同时采用上述已建好的qPCR方法和常规PCR方法对稀释好的模板进行灵敏性对比检测。结果显示,荧光定量PCR方法可检测到10-7对应的阳性模板(见图6),而常规PCR方法只能检测到10-5对应的阳性模板(见图7)。

1~8.分别为10-1~10-9稀释的标准质粒; NTC.阴性对照图6 实时荧光定量PCR灵敏性试验结果

M. DNA 分子质量标准;1~8.分别为10-1~10-8稀释的标准质粒;9.阴性对照图7 常规PCR灵敏性试验结果
2.6 重复性试验
采用本研究建立的荧光定量PCR方法,分别作批内重复试验和批间重复试验,通过统计学方法计算变异系数,结果见图8、表2和表3。

图8 批内重复性试验

表2 实时荧光定量 PCR 的批内重复性试验

表3 实时荧光定量 PCR 的批间重复性试验
重复性试验显示,批内变异系数为0.01%~0.41%,批间变异系数为0.02%~0.47%,变异系数均小于2%,说明离散程度较小,本方法具有良好的重复性和稳定性。
2.7 临床样本的检测
应用本试验建立的PCV3荧光定量PCR方法和常规PCR方法对采自湖北某猪场的72份血清样品进行检测。结果显示,该荧光定量PCR方法阳性检出率为16.7%,而常规PCR阳性检出率为12.4%,将常规PCR检测的阳性品经荧光定量PCR复检全部为阳性。说明该荧光定量PCR方法更为灵敏,可用于大批量样本的快速定量检测。
3 讨论
自2016年末PCV3被正式命名以来,虽然报道的文献很少,但是其检测阳性率居高不下,充分显示PCV3正在全国猪场中大规模流行,给养猪业造成巨大经济损失。研究和建立一种快速有效检测方法对于有效防控PCV3的传播,提高我国猪养殖业的健康发展具有重大意义。
目前圆环病毒的主要诊断方法有病毒分离鉴定、电镜检查、原位杂交、免疫组化和PCR等[9-11]。随着分子生物学技术的发展,荧光定量PCR已被广泛用于病原快速定量检测和基因分型等方面[12-13]。该方法全程在单管封闭环境下进行,微机控制,避免了假阳性或者假阴性的出现,具有极高的灵敏性,非常适合微量病原的快速检测[14]。
本研究以PCV3的ORF2基因保守区域设计特异性荧光引物和探针,建立了TaqMan荧光定量PCR检测方法。进一步优化反应程序和反应体系,提高了反应的特异性和灵敏性。通过构建质粒标准品,绘制标准曲线,可见在3.39×101~3.39×107copies/μL范围内,Ct值与模板拷贝数对数之间呈良好的线性关系,线性方程的相关系数R2达到1;特异性试验结果表明,PCV3与PCV2、PRRSV、PEDV、PPV、PRV、CSFV均无交叉反应,具有良好的特异性;该qPCR方法的灵敏度达到10 copies/μL,比常规PCR灵敏100倍;通过对72份临床样本进行检测,建立的qPCR方法阳性检出率为16.7%,而常规PCR阳性检出率为12.4%,说明该qPCR方法具有较高的灵敏性;重复试验结果表明,批间和批内试验变异系数均小于2%,说明该方法具有良好的重复性。
综上,本研究建立的TaqMan荧光定量PCR具有特异性强、灵敏度高、重复性好的优点。在实际生产中,可为PCV3早期流行的分子生物学诊断、病原定量检测提供一种快速有效的技术方法。
