两阶段调控葡萄糖质量浓度强化赤藓糖醇发酵的研究
2020-08-02刘金龙孙锡友赵国群
刘金龙,孙锡友,赵国群*,王 勇,白 敬,孙 旭
(1.河北科技大学 生物科学与工程学院,河北 石家庄 050000;2.河北省发酵工程技术研究中心,河北 石家庄 050000)
赤藓糖醇是一种天然的四碳多元醇,化学名是1,2,3,4-丁四醇,分子式为C4H10O4,作为低热量功能性甜味剂已经使用了几十年[1-2],广泛应用于食品、化妆品、医药及饲料行业。据2017年国际糖尿病联盟发布的全球糖尿病地图(第8版)显示,全球约4.25亿人罹患糖尿病,这一数据还在急速增长,而赤藓糖醇诱导胰岛素水平变化非常有限,是糖尿病患者理想的甜味剂[3-4]。
微生物发酵是赤藓糖醇当前主要生产方法[5-6]。利用特定菌种如出芽短梗霉菌(Aureobasidium pullulsns)、木兰假丝酵母(Candida magnoliae)、圆酵母(Torulasp.),Pseudozyma tsukubaensis,变异三角酵母(Trigonopsis variabilis),毛孢子菌属(Trichosporonsp.)和解脂耶氏酵母(Yarrowia lipolytica)等可高效合成赤藓糖醇[7-12]。
赤藓糖醇、甘露醇、甘油等在微生物细胞内通常充当平衡细胞内外渗透压的抗渗物质。在利用耐高渗酵母发酵合成赤藓糖醇过程中,赤藓糖醇作为细胞对抗渗透压的物质而产生,基于此生理特性,可以通过提供渗透压胁迫来促进赤藓糖醇的合成[13-15]。ANDREISHCHEVA E N等[16]通过添加NaCl来改变发酵体系中的渗透压,从而提高了赤藓糖醇产量。杨利博等[17]将甘油作为碳源用于赤藓糖醇发酵,结果发现,高浓度甘油产生的渗透压胁迫可以提高赤藓糖醇的产量。高浓度的葡萄糖也可通过碳源供给和渗透压胁迫双重作用于解脂耶氏酵母合成赤藓糖醇的过程[18-19],基于此原理,该研究通过发酵动力学方面分析,优化葡萄糖的添加策略,为提高赤藓糖醇的发酵效率,降低工业生产成本提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
解脂耶氏酵母(Yarrowia lipolytica)JZ-204:河北省发酵工程技术研究中心保藏菌种。
1.1.2 化学试剂
酵母浸粉(生化试剂):北京奥博星生物技术有限责任公司;玉米浆干粉(生化试剂):天津市利发隆化工科技有限公司;一水合葡萄糖(分析纯):天津市永大化学试剂有限公司;尿素(分析纯):天津欧博凯化工有限公司;甘露醇(分析纯):上海阿拉丁生化科技股份有限公司;赤藓糖醇(分析纯):上海源叶生物科技有限公司。
1.1.3 培养基
摇瓶一级种子培养基:葡萄糖100 g/L,酵母膏10 g/L,尿素1 g/L,pH自然。
摇瓶二级种子培养基:葡萄糖100 g/L,酵母膏10 g/L,尿素1 g/L,pH自然。
发酵培养基:玉米浆粉15.0 g/L,酵母膏3.0 g/L,尿素0.1 g/L,pH自然,葡萄糖质量浓度根据需求添加。
培养基灭菌条件:使用高压灭菌锅121 ℃灭菌20 min。
1.2 仪器与设备
5L发酵罐:上海保兴生物设备工程有限公司;UV-6000PC型紫外可见分光光度计:上海元析仪器有限公司;SK-200B恒温培养振荡器:上海苏坤实业有限公司;MJ-54A高压灭菌锅:施都凯仪器设备(上海)有限公司;LG16-A高速离心机:北京雷勃尔离心机有限公司;S-10生物传感器分析仪:深圳市希尔曼科技有限公司。
1.3 实验方法
1.3.1 培养方法
一级种子培养:从斜面试管取一菌环接种于摇瓶中,装液量100 mL/500 mL,摇床转速200 r/min,30 ℃培养24 h。
二级种子培养:从培养好的一级种子摇瓶中,按10%接种量接种于二级种子摇瓶,装液量100 mL/500 mL,摇床转速200 r/min,30 ℃培养24 h。
发酵培养:发酵罐装液量3.5 L/5 L,转速500 r/min,30 ℃,通气量为3.5 L/min,初始pH自然。从培养好的二级种子摇瓶中,按10%接种量接种于发酵罐,培养至葡萄糖耗尽或216 h发酵结束。
1.3.2 菌体浓度测定
取1 mL发酵液稀释适当倍数后,用分光光度计测定其在波长600 nm条件下的吸光度值(OD600nm值)。细胞干质量(dry cell weight,DCW)测定:取不同时间的1 mL发酵液,10 000×g离心10 min,去离子水洗涤2次,将待测样品于80 ℃干燥至质量恒定,测其干质量。建立OD600nm值与细胞干质量方程(1)如下:

式中:OD600nm值控制在0.2~0.8,A为稀释倍数。
1.3.3 赤藓糖醇、甘露醇含量测定
取5.0 mL发酵液,8 000×g离心10 min,取上清液用超纯水稀释适当倍数,过0.22 μm有机滤膜,滤液使用高效液相色谱法测定赤藓糖醇、甘露醇含量。
色谱条件:色谱柱为AminexHPX-87H糖分析柱(300mm×7.8mm),柱温35℃,流动相为5mmol/LH2SO4,流速0.6mL/min,进样量10 μL,检测器为示差折光检测器,检测器温度30 ℃。
1.3.4 葡萄糖质量浓度测定
取0.5mL发酵液稀释适当倍数,使葡萄糖质量浓度在0~4g/L范围内,使用S-10生物传感器分析仪检测葡萄糖质量浓度。
生产强度是指单位时间内单位罐体积发酵液的产物积累量。赤藓糖醇发酵生产强度根据公式(2)计算:

式中:赤藓糖醇发酵生产强度,g/(L·h),赤藓糖醇产物质量浓度,g/L,发酵时间单位为h。
1.3.5 数据处理
每组试验重复3次,取平均值。采用Microsoft Excel 2013软件对实验数据进行处理,用Origin 2017绘图软件对实验数据作图。
2 结果与分析
2.1 葡萄糖初始质量浓度对赤藓糖醇发酵的影响
解脂耶氏酵母(Yarrowia lipolytica)是一种耐高渗酵母,可以通过产生赤藓糖醇、甘露醇、甘油或阿拉伯糖醇来维持细胞内外的渗透压平衡,使细胞正常生长[20-22]。葡萄糖作为碳源时,可以为发酵体系中的细胞提供渗透压,从而促使解脂耶氏酵母菌过量合成赤藓糖醇、甘露醇、甘油或阿拉伯糖醇等来维持细胞内外的渗透压平衡[1,6]。
2.1.1 葡萄糖消耗过程曲线
在转速(500 r/min)和培养温度(30 ℃)的条件下,研究不同的初始葡萄糖质量浓度(100 g/L、200 g/L、300 g/L和400g/L)对赤藓糖醇发酵过程的影响。不同初始葡萄糖质量浓度条件下赤藓糖醇发酵的葡萄糖消耗过程曲线见图1,不同初始葡萄糖质量浓度对菌体生长的影响见图2。
由图1可知,100 g/L、200 g/L、300 g/L初始葡萄糖质量浓度分别于52 h、144 h、216 h消耗殆尽,而400 g/L初始葡萄糖质量浓度在216 h时还有143 g/L的残糖。故高初始葡萄糖浓度(300 g/L和400 g/L)会延长发酵周期。
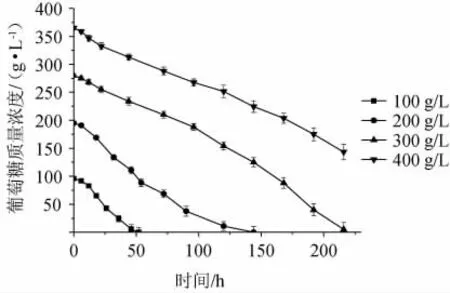
图1 发酵过程中葡萄糖质量浓度变化曲线Fig.1 Change curves of glucose mass concentration during the fermentation process
2.1.2 不同初始葡萄糖质量浓度对菌体干质量的影响
如图2所示,四种不同初始葡萄糖质量浓度(100 g/L、200 g/L、300 g/L和400 g/L)对菌体生长影响显著,菌体浓度同初始葡萄糖质量浓度呈负相关。当初始葡萄糖质量浓度为100 g/L、200 g/L、300 g/L和400 g/L时,菌体浓度分别在62 h、144 h、216 h、216 h达到了各自最高值34.7 g/L、38.2 g/L、34.5g/L、30.2g/L。结果表明,100 g/L初始葡萄糖质量浓度有利于解脂耶氏酵母的菌体生长,而高初始葡萄糖质量浓度(300 g/L和400 g/L)则会抑制解脂耶氏酵母的菌体生长。

图2 不同初始葡萄糖质量浓度对菌体生长的影响Fig.2 Effect of different initial glucose mass concentration on cell growth
2.1.3 不同初始葡萄糖质量浓度对赤藓糖醇的影响
不同初葡萄糖质量浓度对赤藓糖醇产量的影响见图3。如图3所示,四种不同初始葡萄糖质量浓度(100 g/L、200 g/L、300g/L和400 g/L)条件下,赤藓糖醇产量与初始葡萄糖质量浓度呈正相关,最高产量分别为6.40 g/L、50.21 g/L、80.76 g/L和86.08 g/L。结果表明,低初始葡萄糖质量浓度100 g/L不利于解脂耶氏酵母的合成赤藓糖醇,而高初始葡萄糖质量浓度(300 g/L和400 g/L)则有利于解脂耶氏酵母的菌体生长。
综上所述,初始葡萄糖质量浓度为100 g/L、200 g/L、300 g/L和400 g/L时,300 g/L和400 g/L的高初始葡萄糖质量浓度有利于赤藓糖醇合成,不利于菌体生长,反之,低初始葡萄糖质量浓度有利于菌体生长,不利于赤藓糖醇合成。
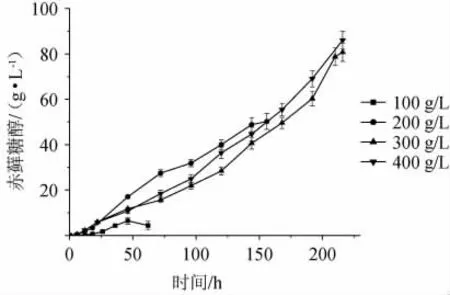
图3 不同初始葡萄糖质量浓度对赤藓糖醇产量的影响Fig.3 Effect of different initial glucose mass concentration on erythritol production
2.1.4 初始葡萄糖质量浓度对副产物甘露醇的影响
在利用解脂耶氏酵母发酵生产赤藓糖醇过程中,还检测到大量甘露醇存在。甘露醇作为公认的细胞耐渗透物质,它的存在进一步印证了渗透压胁迫有利于抗渗透产物的合成。初始葡萄糖质量浓度对副产物甘露醇的影响见图4。

图4 不同初始葡萄糖质量浓度对甘露醇的影响Fig.4 Effect of different initial glucose mass concentration on mannitol production
如图4所示,副产物甘露醇在不同初始葡萄糖质量浓度(100 g/L、200 g/L、300 g/L和400 g/L)条件下,最高产量分别为9.87 g/L、14.48 g/L、15.92 g/L和16.44 g/L。结果表明,甘露醇最终浓度同初始葡萄糖质量浓度呈正相关。这一变化趋势与TOMASZEWSKA L等[23]研究表明,甘油对解脂耶氏酵母菌发酵产赤藓糖醇和甘露醇的影响结果一致。
2.2 不同葡萄糖质量浓度下解脂耶氏酵母发酵动力学分析
为了进一步分析葡萄糖质量浓度对菌体生长和赤藓糖醇合成的影响,对4种不同初始葡萄糖质量浓度下的发酵参数进行了动力学分析,结果见图5。
不同初始葡萄糖质量浓度对菌体比生长速率μ的影响结果见图5A。由图5A可知,在整个赤藓糖醇发酵阶段,不同初始葡萄糖质量浓度(100 g/L、200 g/L、300 g/L和400 g/L)条件下μ变化趋势相差很大,其最大值分别为2.61 h-1、1.26 h-1、0.93 h-1和0.40 h-1。通过图5A的菌体比生长速率曲线比较可知,初始葡萄糖质量浓度为100 g/L时最利于菌体生长。
不同初始葡萄糖质量浓度对赤藓糖醇比合成速率的影响结果见图5B。由图5B可知,不同初始葡萄糖质量浓度(100 g/L、200 g/L、300 g/L和400 g/L)下赤藓糖醇比合成速率与初始葡萄糖质量浓度呈正相关,其最大比合成速率分别为0.014 h-1、0.039 h-1、0.075 h-1和0.082 h-1,由此可见,高浓度的葡萄糖更有利于赤藓糖醇的合成。这与RYU Y W等[24]研究利用Candida magnolia菌生产赤藓糖醇时,细胞生长和产物合成的最佳条件不同的结论相一致。
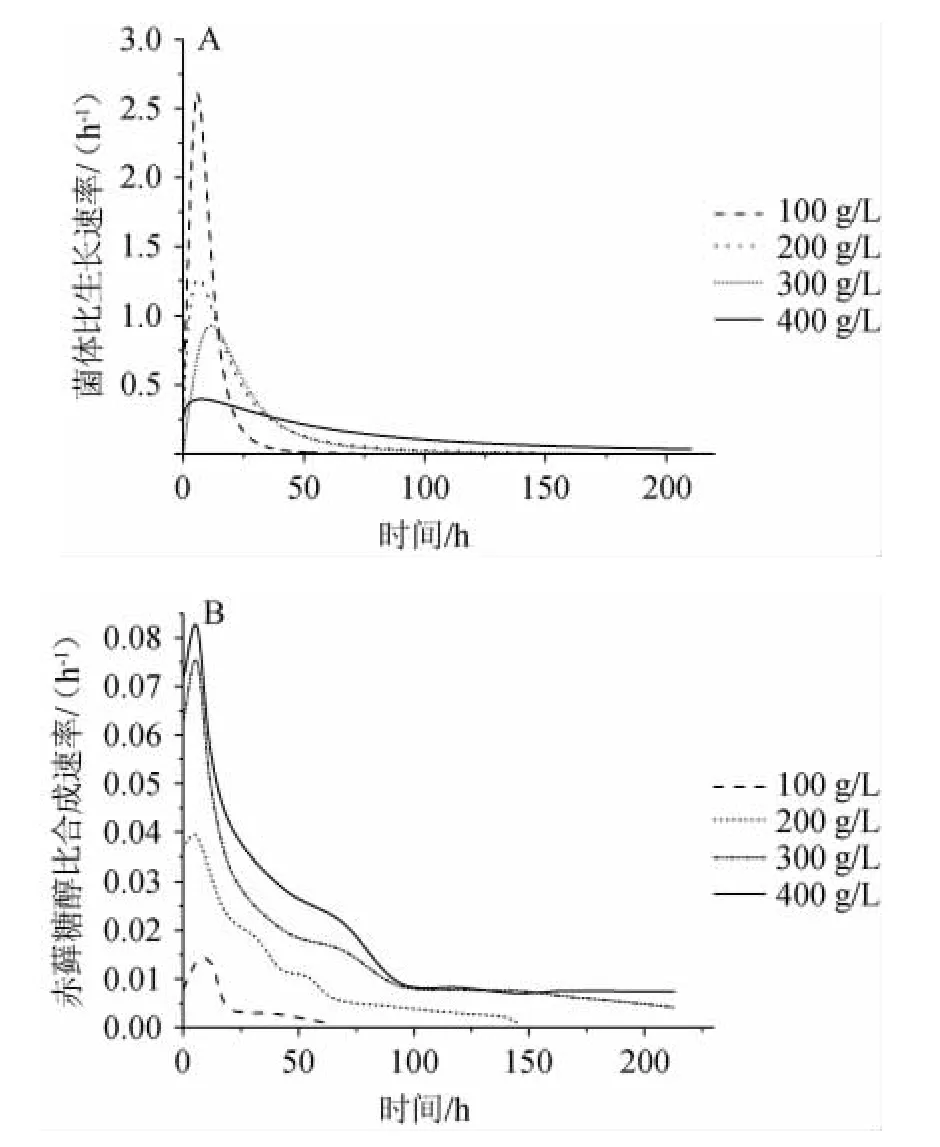
图5 不同初始葡萄糖质量浓度条件下赤藓糖醇发酵过程动力学参数的变化Fig.5 Change of kinetics parameters of erythritol fermentation under different initial glucose mass concentration
综上所述,通过对赤藓糖醇发酵过程中的菌体比生长速率(μ)和赤藓糖醇比合成速率(qp)的分析,进一步验证了300 g/L和400 g/L高初始葡萄糖质量浓度有利于赤藓糖醇合成,不利于菌体生长,反之,低初始葡萄糖质量浓度有利于菌体生长,不利于赤藓糖醇合成。
2.3 分阶段葡萄糖质量浓度控制策略
通过对各初始葡萄糖质量浓度下的μ和qp进行分析发现,μ最大值随着初始葡萄糖质量浓度的升高而降低,在初始葡萄糖质量浓度为100 g/L时,菌体可以快速生长,在22 h后开始变缓;而qp则是随着初始葡萄糖质量浓度的升高而提高。考虑到初始葡萄糖质量浓度为400 g/L时,发酵到216 h时还有143 g/L的残糖,发酵时间过长,且初始葡萄糖质量浓度300 g/L与400 g/L的赤藓糖醇产量接近,故将发酵过程分为2个阶段,分别为0~22 h(第1阶段,发酵初始葡萄糖质量浓度为100 g/L)和22 h以后(第2阶段,使用补料培养基,补加葡萄糖,使总耗糖量与初始300 g/L发酵时总耗糖量一致),各阶段的发酵过程参数见图6和表1。

图6 采用分阶段控制葡萄糖质量浓度的发酵过程曲线Fig.6 Fermentation curves of two-staged glucose concentration control strategy

表1 不同初始葡萄糖质量浓度下赤藓糖醇分批发酵过程参数比较Table 1 Comparison of fermentation parameters among batches at different glucose concentration
如图6所示,采用分阶段控制葡萄糖质量浓度的策略,在前22 h,菌体可以快速生长,缩短延滞期,在补加葡萄糖后,由于高浓度葡萄糖的抑制作用,菌体生长变缓。但从图中赤藓糖醇产量变化曲线中可以看出,在补加葡萄糖后,赤藓糖醇产量增加明显。通过对不同葡萄糖质量浓度下赤藓糖醇分批发酵过程参数比较(表1)表明,采用这一葡萄糖质量浓度两阶段控制策略,赤藓糖醇最终产量为92.66 g/L,与初始葡萄糖质量浓度为100 g/L、200 g/L、300 g/L和400 g/L的培养相比,分别提高了1 347.81%、84.54%、14.66%、7.57%;生产强度达到最高的0.48 g/(L·h),与初始葡萄糖质量浓度为100 g/L、200 g/L、300 g/L和400 g/L的培养相比,分别提高了300%、37.14%、29.73%、20.00%。采用分阶段控制葡萄糖质量浓度的策略,有利于缩短菌体生长延滞期和促进赤藓糖醇的合成,为赤藓糖醇的高效发酵合成提供参考。
3 结论
在发酵过程中,葡萄糖除作为碳源用于菌体生长代谢以外,还可以为发酵体系提供不同的渗透压,从而促使耐高渗酵母利用其过量合成赤藓糖醇、甘露醇等物质来维持细胞内外的渗透压平衡,使细胞正常生长。因此,在赤藓糖醇发酵过程中,葡萄糖质量浓度的控制对赤藓糖醇的产量影响非常大。
本研究在5 L发酵罐水平上研究了葡萄糖质量浓度对解脂耶氏酵母(Yarrowia lipolytica)JZ-204发酵赤藓糖醇的影响,发现较低的初始发酵葡萄糖质量浓度(100 g/L)有利于细胞的生长,缩短延迟期,使菌体快速增加;而较高的葡萄糖质量浓度(200~400 g/L)则有利于赤藓糖醇的合成。基于对发酵参数的动力学分析,提出解脂耶氏酵母分批发酵生产赤藓糖醇的两阶段葡萄糖质量浓度控制策略,即0 h时发酵初始葡萄糖质量浓度为100 g/L,22 h后通过补加葡萄糖,使总糖量与初始300 g/L发酵时总糖量一致。采用这一葡萄糖质量浓度两阶段控制策略,与初始葡萄糖质量浓度为100 g/L、200 g/L、300 g/L和400 g/L的培养相比,赤藓糖醇产量提高了1347.81%、84.54%、14.66%、7.57%;生产强度提高了300%、37.14%、29.73%、20.00%。
