栗树类芽孢杆菌S3胞外粘多糖毒理安全性评价
2020-08-02戴德慧胡伟莲
戴德慧,胡伟莲
(浙江科技学院 生化学院,浙江 杭州 310012)
粘多糖是一类分子结构中含有糖醛酸和氨基己糖结构的糖胺聚糖,是多糖家族中最重要的成员之一[1-3]。粘多糖有着重要的生物学活性,能调节体内的阴离子浓度、机体免疫功能、机体脂类代谢;激活脂蛋白脂酶;防御细菌或病毒的感染;具有抗凝血、抗血栓活性、抗癌等多种生理功能[4-9]。此外,粘多糖在调节骨胶原纤维的生成及增加血管壁弹性等方面也均有重要作用[10-13]。随着粘多糖特殊的结构性质和生物活性不断被发现,粘多糖也被普遍认为是一类最具发展前景的生物活性物质之一。
目前,粘多糖产品的开发制备主要采用动物组织提取法,但这种生产方法原料来源局限性大、产品提取率极低、工艺程序复杂、生产成本居高不下,造成商品价格昂贵,难以进行大规模工业化生产。而采用微生物发酵法,具有原料不受限制,产品容易纯化,成本低,且无动物来源致病病毒来源的污染的危险,易于形成规模化生产[14-15]。利用兽疫链球菌(Streptoccus zooepidemicus)发酵生产的透明质酸是微生物粘多糖中最重要的代表,已广泛应用于食品、化妆品和医疗等领域[16-17]。
在腾格里沙漠的南缘地区筛选得到一株栗树类芽孢杆菌(Paenibacillus castaneae)S3,其能在营养贫瘠的无氮蔗糖培养基中较好的生长,自生固氮并产大量的胞外粘多糖。该粘多糖具有较好的保温、防粘连及絮凝作用,在食品、医药、化妆品及环保等领域具有广泛的应用前景,但其是否存在安全隐患尚不清楚。因此,本研究通过小鼠急性经口毒性试验、骨髓细胞染色体畸变、精子畸形及30 d喂养试验分别考察栗树类芽孢杆菌S3胞外粘多糖的急性毒性、致突变、遗传及亚急性毒性等进行初步的安全性评价,为其今后的开发利用提供毒理学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物
美国癌症研究所(institute of cancer research,ICR)清洁级小鼠:浙江省实验动物中心,生产许可证号:SCXK(浙)2014-0001号。所有小鼠均喂养于屏障环境(空气洁净度万级,换气次数10~20次/h,温度20~26 ℃,日温差≤3 ℃,相对湿度40%~70%),小鼠饲喂60Co灭菌的营养配合饲料,饮用超滤水,笼器具、垫料等均经121 ℃高压灭菌20 min。
1.1.2 试剂
蔗糖、硝酸钠、硫酸镁、磷酸氢二钾、乙醇(均为分析纯):国药集团化学试剂有限公司;环磷酰胺(分析纯):江苏恒瑞医药股份有限公司;秋水仙素、氯代十六烷基吡啶(均为分析纯):上海阿拉丁生化科技股份有限公司。
1.1.3 培养基
发酵培养基:蔗糖30 g,硝酸钠1g,磷酸氢二钾1 g,MgSO4·7H2O 0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蒸馏水1 000 mL,121 ℃高压灭菌20 min。
1.2 仪器与设备
BSA224S、BSA2202S电子天平:上海赛多利斯贸易有限公司;日立7100型全自动生化分析仪:日本日立公司;X-30R离心机:美国贝克曼库尔特有限公司;CX33生物显微镜:奥林巴斯(中国)有限公司;LRH-70生化培养箱:上海一恒实验设备有限公司;GI54DWS高压灭菌器:致微(厦门)仪器有限公司;ZWYR-2112B型恒温摇床:上海智城分析仪器制造有限公司;ADVIA 2120I全自动血液分析仪:德国西门子公司;Alphaclean1300垂直流洁净工作台:力康生物医疗科技控股有限公司。
1.3 实验方法
1.3.1 胞外粘多糖的制备[18]
按3%(V/V)的接种量将栗树类芽孢杆菌(Paenibacillus castaneae)S3菌悬液(106CFU/mL)接种于发酵培养基,装液量50 mL/300 mL,于28 ℃、180 r/min条件下摇瓶培养48 h,得到发酵液。将发酵液经5 000 r/min离心20 min,除去菌体,加入终浓度为0.1 mol/L的NaCl,再加入1%氯代十六烷基吡啶(cetylpyridinechloride,CPC)处理,使其形成络合沉淀后,4 000 r/min离心20 min,收集沉淀,以0.6 mol/L NaCl溶液充分溶解沉淀,然后加3倍体积的无水乙醇,4 000 r/min离心20 min,收集白色絮状产品,冷冻干燥,得到粘多糖样品。
1.3.2 小鼠急性经口毒性试验[19-20]
选用ICR清洁级小鼠,体质量为18~24 g,雌雄各10只,灌胃前16 h禁食,称质量后,24 h内分3次灌胃给予质量浓度为0.1 g/mL的受试物,灌胃容量为40 mL/kg体质量,累计受试物总剂量为12 g/kg体质量。灌胃4 h后给食,给药后连续观察14 d,记录中毒表现及死亡情况。给药14 d后,采用颈椎脱臼法处死小鼠,进行心、肝、脾、肺、肾、子宫、睾丸、胃、肠等重要脏器病理检查。另选用相同数量的小鼠,在同样的处理方式下,以蒸馏水取代受试物作为对照组。
1.3.3 小鼠骨髓细胞染色体畸变试验[21]
选用体质量为25~30 g的健康ICR清洁级小鼠50只,随机分为5组,每组10只,雌雄各半。制备的粘多糖样品分为低(1.0 g/kg体质量)、中(2.0 g/kg体质量)、高(4.0 g/kg体质量)三个剂量试验组,采用环磷酰胺(cyclophosphamide,CP)(40 mg/kg)为阳性对照组,蒸馏水为阴性对照组,给予受试物3次,每次间隔24 h,在末次给受试物24 h后取材,处死动物前2 h按4 mg/kg体质量腹腔注入秋水仙素。小鼠颈椎脱臼处死取股骨,将骨髓洗入10 mL离心管中,反复冲洗数次后,混匀,制成1.0 mL细胞悬液,采用Giemsa染色储备液染色,用油镜对细胞中期的染色体进行分析观察,每只动物分析100个中期相细胞,计算染色体异常率,即染色体异常数与总分析数的比值。
1.3.4 小鼠精子畸形试验[22]
选用体质量为28~35 g的雄性ICR清洁级小鼠25只,随机分为5组,每组5只。设置试验组(剂量分别为低(1.0 g/kg体质量)、中(2.0 g/kg体质量)、高(4.0 g/kg体质量)、阴性对照组(蒸馏水)和阳性对照组(50 mg/kg体质量CP),连续灌胃给予受试物5 d,至首次给受试物后的第35天,用颈椎脱臼法处死小鼠,取出两侧副睾,放入盛有2 mL生理盐水的平皿中。用眼科剪将副睾纵向剪1~2刀,静置3~5 min,轻轻摇动。用合成纤维血网袋过滤,吸滤液涂片。空气干燥后,用甲醇固定5 min以上干燥,用1.5%伊红染色1 h,用水轻冲,干燥。每组记数5只动物,每只动物计数1 000个结构完整的精子,计算精子畸形率(以百分率计)。
1.3.5 30 d喂养试验[23]
选用体质量为18~24 g的ICR清洁级小鼠80只,随机分成4组,每组20只,雌雄各半。设置试验组(剂量分别为低(1.0 g/kg体质量)、中(2.0 g/kg体质量)、高(4.0 g/kg体质量)、对照组(蒸馏水)。实验期间每天观察小鼠一般状态、体征、摄食量、饮水及粪便状况。每7 d测一次体质量,按体质量变化调整给药量,连续观察30 d。给药期满30 d,禁食禁水12 h后,摘眼球取血,检查血液常规指标及血液生化指标。取血后立即剖取动物肝、肾、脾、胃、睾丸或卵巢等脏器称质量,根据体质量计算器官质量系数,并进行病理组织学检查。
1.3.6 数据统计分析
采用SPSS 20.0软件进行显著性分析。
2 结果与分析
2.1 小鼠急性经口毒性试验结果
小鼠急性经口毒性试验体质量增长情况见表1。
由表1可知,给予受试物的样品组雄雌小鼠体质量增长与对照组无明显差异(P>0.05),给药14 d后小鼠外观毛色光亮,无兴奋、不安、窜动、跳跃、竖毛、流泪、流涎、凸眼、扭体反应现象;给药后摄食、取水、大小便等均无明显异常;观察期间无动物死亡;给药14 d 后小鼠的心、肝、脾、肺、肾、子宫、睾丸、胃、肠等重要脏器均未见出血、充血、水肿、渗出、溃疡、穿孔等明显的病理变化,胸腔、腹腔、心包膜无积液。结果表明,对于粘多糖,雌雄两性小鼠经口最大耐受度均>12 g/kg。根据急性毒性分级,粘多糖样品属无毒级[24-25]。
2.2 小鼠骨髓细胞染色体畸变试验结果
小鼠骨髓细胞染色体畸变试验结果见表2。
由表2可知,试验组小鼠的染色体异常率(4.20%、4.20%、4.00%)与阴性对照组(4.70%)无明显差异(P>0.05),与阳性对照组(45.3%)差异极显著(P<0.01),且试验组结果显示染色体异常率无剂量反应关系。结果表明,该粘多糖样品剂量为0~4.0 g/kg时无致小鼠骨髓细胞染色体畸变的作用。

表2 小鼠骨髓细胞染色体畸变试验结果Table 2 Results of chromosome aberration tests in mice bone marrow cells
2.3 小鼠精子畸形试验结果
小鼠精子畸形试验结果见表3。
由表3可知,试验组小鼠精子的畸形率(2.14%、2.04%、2.06%)与阴性对照组(2.56%)比较,无显著差异(P>0.05),与阳性对照组(7.68%)比较,差异极显著(P<0.01),且试验组结果显示染色体畸变率无剂量反应关系。结果表明,该粘多糖样品剂量为0~4.0 g/kg时对小鼠精子无畸变作用。
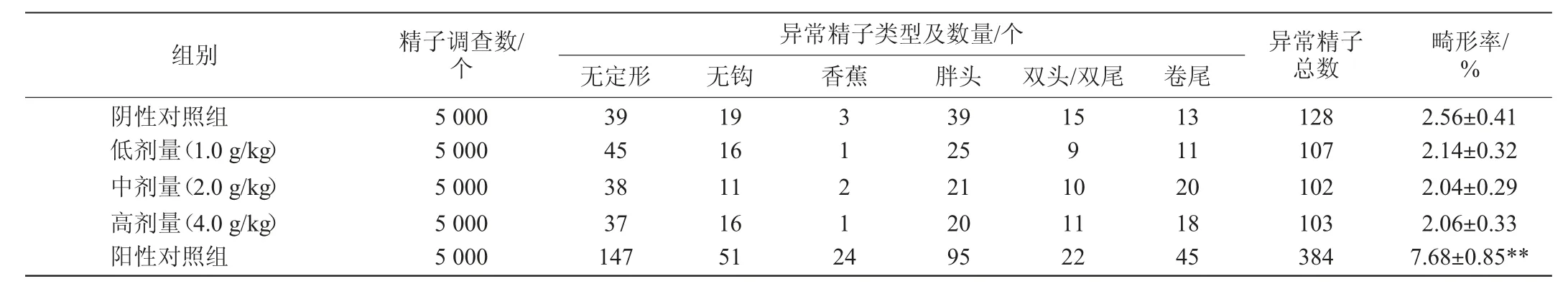
表3 小鼠精子畸形试验结果Table 3 Results of sperm abnormality tests in mice
2.4 30 d饲喂试验结果
2.4.1 一般毒性反应
高、中、低三个剂量给药组及对照组小鼠在30 d试验期内均活动正常,行为活泼,毛色光泽,进食饮水正常,大、小便无异常改变,无一死亡。
2.4.2 体质量测定结果

表4 30 d喂养试验中小鼠体质量测定结果Table 4 Determination results of mice body weight in 30 d feeding tests
由表4可知,高、中、低三个剂量给药组体质量增长正常,试验组与对照组相比较,差异不显著(P>0.05)。
2.4.3 小鼠脏器系数测定结果
由表5可知,给药30 d后,3个剂量试验组的肝脏、脾脏、肾脏、睾丸及卵巢脏器系数与对照组无显著性差异(P>0.05)。

表5 30 d喂养试验中小鼠脏器系数测定结果Table 5 Determination results of mice organ coefficient in 30 d feeding tests
2.4.4 血常规指标测定结果
由表6可知,各剂量组小鼠白细胞数量(white blood cell,WBC)、红细胞数量(red blood cell,RBC)、血红蛋白(hemoglobin,HGB)浓度、红细胞压积(hematokrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV)、平均血小板容积(mean platelet volume,MPV)、平均红细胞血红蛋白(mean corpuscular hemoglobin,MCH)含量、嗜中性白细胞(neutrophil,NE)百分比、淋巴细胞(lymphocyte,LY)百分比、嗜酸性粒细胞(eosnophils,EOS)百分比、单核细胞(monocyte,MONO)百分比、嗜碱性粒细胞(basophil,BAS)、平均红细胞血红蛋白(mean corpuscular hemoglobin,MCH)浓度、红细胞分布宽度(red blood cell distribution width,RDW)、血小板(platelet,PLT)数量均与对照组无显著性差异(P>0.05)。

表6 30 d喂养试验中小鼠血常规指标测定结果Table 6 Determination results of mice blood routine indexes in 30 d feeding tests
2.4.5 血生化指标测定结果
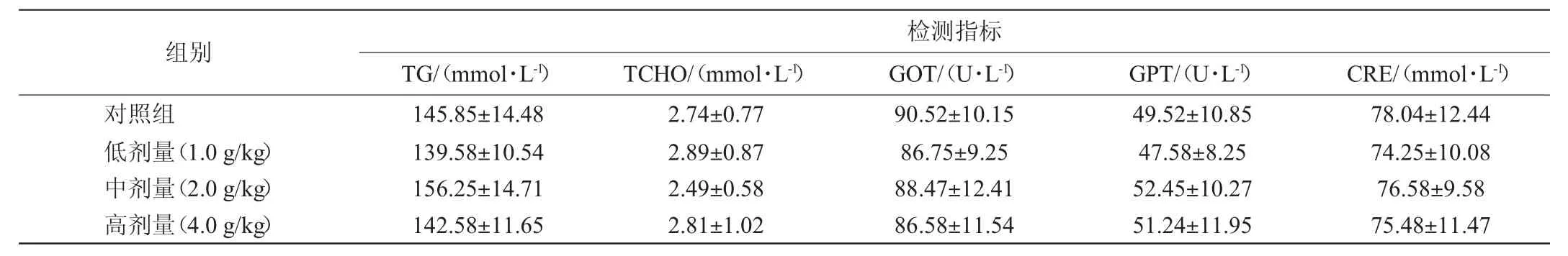
表7 30 d喂养试验中小鼠血生化指标测定结果Table 7 Determination results of mice blood biochemistry indexes in 30 d feeding tests
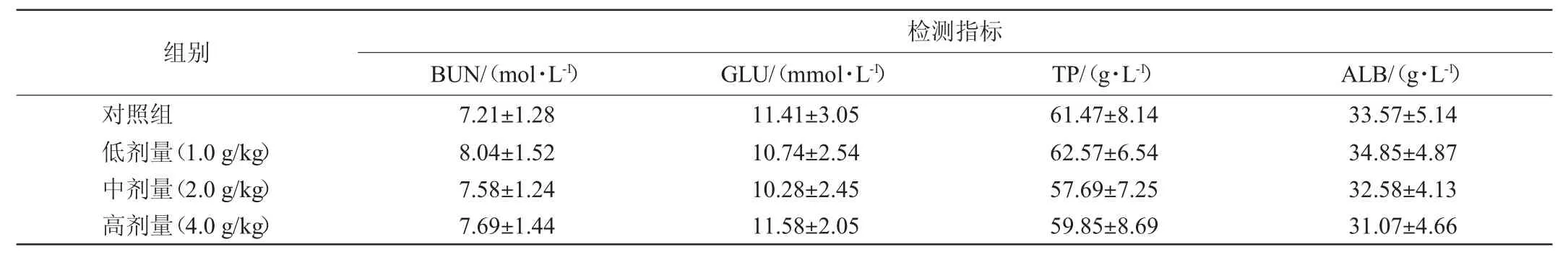
续表
由表7可知,各剂量组小鼠的甘油三脂(triglyceride,TG)、总胆固醇(total cholesterol,TCHO)、谷草转氨酶(glutamic oxalacetic transaminase,GOT)、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、肌酐(creatinine,CRE)、尿素氮(blood urea nitrogen,BUN)、葡萄糖(glucose,GLU)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)血生化指标与对照组无显著性差异(P>0.05)。
2.4.6 30 d喂养小鼠的病理组织学检查
全面细致观察发现,各小鼠的心、肝、肾、脾、胃、睾丸及卵巢等器官的大小、形态、色泽、质感等均未见异常。各主要脏器无明显变性、坏死,光泽正常。
3 结论
通过小鼠急性毒性试验,确定栗树类芽孢杆菌S3胞外粘多糖样品对雌雄性小鼠的急性毒性最大耐受度均>12 g/kg,属无毒物。通过小鼠骨髓细胞染色体畸变及精子畸形试验,确定栗树类芽孢杆菌S3胞外粘多糖样品低(1.0 g/kg)、中(2.0 g/kg)、高剂量(4.0 g/kg)对小鼠的染色体及精子无畸变作用。通过小鼠30 d喂养试验表明,试验期内各组小鼠生长发育良好,体质量增加、脏器系数、血常规及血生化各项指标与对照组均无显著差异(P>0.05));病理组织学检查均未见病理改变。
