黄花菜生物钟基因HcLHY 的克隆及时空表达分析
2020-07-29公菲菲侯非凡亢秀萍
公菲菲,李 森,杜 崴,高 阳,侯非凡,亢秀萍
(山西农业大学 园艺学院/山西省设施蔬菜提质增效协同创新中心,山西 太谷 030801)
开花是植物生命过程中的一个重要的发育过程,其中开花时间是农业生产上一个重要农艺性状,适宜的开花时间有利于植物的正常发育和后代繁衍[1]。植物的开花受内源生物钟和外源环境条件的影响。有研究表明,昙花、夜来香、牵牛等植物花瓣的开放主要是受自身24 h 的昼夜生物钟所控制[2]。在模式植物拟南芥中的基因组功能研究和遗传学研究已经发现数百个基因的表达受到生物钟的调控[3-4],在其他物种上生物钟基因的研究工作仅限于根据基因的同源性克隆已报道的生物钟基因,验证其功能。生物钟中央振荡器是植物昼夜节律的核心系统,拟南芥的生物钟昼夜节律的模型中生物钟核心振荡器由3 个循环组成,主要包括中心循环(Core loop )、早晨循环(Morning loop )和傍晚循环(Evening loop )[5]。 中心循环是最早鉴定参与生物钟调控的反馈循环,包括了R1 类Myb 结构域的转录因子基因LHY和CCA1,以及一个伪反应调节蛋白基因Toc1[6-7]。CCA1/LHY可以抑制Toc1的表达,而Toc1可直接或间接的通过一些组分调控CCA1和LHY的表达,以此构成了一个完整的调控循环[5]。植物就是通过这样一个多重“转录-翻译反馈循环网络”整合环境信号的变化,维持生物节律输出的稳定性[8]。在现有的研究中指出LHY与开花时间有关,Yon 等研究表明烟草的NaLHY沉默株系在LD 条件下比对照早2 h 开始开放、在LL 条件下比对照早4 h 开始开放[9]。在金鱼草中AmLHY可以提高生长速度并影响着花香的持续时间和香味分布[10]。
黄花菜是重要的特色蔬菜,且兼具观赏和药用价值。由于其花朵只开 1 d 并且天然存在夜间开花和白天开花类群,是花朵开放和闭合研究较好的模式材料。其中,它的开花具有明显的生物钟现象,能够在1 d 中的特定时间整齐开放,夜间开花类群夜开昼闭,采收时间短且比较集中,观赏价值低。研究者通过调查黄花菜和萱草F1杂种花的开闭时间,可以初步确定花朵开放受一个主基因控制,夜间开花性状是显性,白天开花则是隐性性状,控制花朵开放时间的基因属于核基因[11-12]。目前,黄花菜生物钟基因的研究工作尚未开展,本课题组前期在对自然群体开花时间进行关联分析时发现,c33464.graph_c0 与开花时间相关,在转录组数据库中的注释信息显示其为LHY基因(未发表)。本试验以大同黄花(Hemerocallis citrinacv.‘DatongHuanghua’)为材料,克隆黄花菜LHY基因,并对该基因进行生物信息学和时空表达特性分析,为深入研究LHY基因在黄花菜开花过程中的分子机理提供研究基础,为下一步开展遗传和外源物质影响开花时间调控黄花菜采收提供理论依据。
1 材料与方法
1.1 试验材料
试验材料大同黄花(Hemerocallis citrinacv.‘Datong- Huanghua’)取自山西农业大学黄花菜种质资源圃。
本课题组前期观察发现, 在连续晴朗的天气下,大同黄花花蕾通常在17:50—18:10 开口(即花被片和花萼都打开,雌蕊雄蕊同时出现在花被片中间)[13],在本试验将开口(18:00)定义为0 h,以0 h 为对照前后每隔6 h 采1 次样,具体见图1。另外采集-12 h (6:00)的根、叶、花瓣、花萼、雌蕊、雄蕊用于分析基因表达的组织特异性。采集样品后用锡箔纸包裹编号,并置于液氮中速冻,之后置于-80℃ 冷冻保存,每个材料包含3 次生物学重复。

图1 不同时期黄花菜样品Fig.1 Sample of Hemerocallis citrina cv. ‘DatongHuanghua’in different stages
1.2 总RNA 提取及cDNA 合成
使用TaKaRa MiniBEST Plant RNA Extraction Kit 试剂盒,根据说明书Protocol-II 多糖多酚植物组织的裂解步骤提取Total RNA,参考侯非凡[14]的方法用1.2%琼脂糖凝胶电泳和核酸蛋白测定仪鉴定RNA 质量和浓度, 用PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒进行反转录合成cDNA。
1.3 基因的克隆
在大同黄花(Hemerocallis citrinacv.‘Datong Huanghua’)转录组测序数据库测序结果中查找c33464.graph_c0 的Unigene 序列,通过ORF-Finder(https://www.ncbi.nlm.nih.gov/orffinder/) 找到其ORF 序列[15],使用Snapgene 在UTR 区域设计特异性引物c33464-F/R,以黄花菜-12 h(6:00)样品的cDNA 作为模板,使用2X M5 HiPer plusTaqHiFi PCR mix ( 聚合美公司) 进行基因cDNA序列的扩增,PCR 程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,34 个循环;72 ℃延伸10 min,PCR 产物经琼脂糖凝胶电泳检测后,切胶回收目的片段连接19-T 载体(TAKARA 公司), 用M13-F/R 引物进行测序。用 DNAMAN7.0 将克隆得到的序列与转录本c33464.graph_c0 进行比对,并与黄花菜基因组(未公布)对应的Scaffold 进行比对;然后在 NCBI 网站上进行序列比对,定义所克隆的基因。通过Gene Structure Display Server(GSDS, http://gsds.cbi.pku.edu.cn) 预测HcLHY基因的结构信息[16]。

表 1 HcLHY 基因克隆引物和qRT-PCR 引物表Table 1 Cloning primers and qRT-PCR primers of HcLHY
1.4 生物信息学分析
用NCBI-CD Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白保守结构域预测[17],并在 NCBI-blastp 进行同源性比对,使用 MEGA5.0 构建蛋白进化树,采用NJ 法 ( Neighbor Joining Method ) 构建系统进化树,Bootstrap 值由 1 000 次重复得到[18]。
使用ProtParam(http://web.expasy.org/protparam/)对LHY 蛋白的基本理化性质进行分析;Protscale(https://web.expasy.org/protscale/)可对蛋白亲疏水性进行分析,通过在线分析工具 TMHMM (http://www.cbs.dtu.dk/services/TMHMM/) 对候选基因进行跨膜结构域分析; 通过在线分析工具 PSORT Prediction(http://psort1.hgc.jp/form.html)可对候选基因进行亚细胞定位预测分析;通过在线分析工具 SignalP(http://www.cbs.dtu.dk/services/SignalP/)对候选基因进行信号肽分析[19]。
1.5 时空表达特异性分析
本试验以黄花菜各样品的Total RNA 反转录所得的cDNA 为模板进行qRT-PCR 扩增,引物为 q33464-F/R,不同发育时期的内参基因使用AP4-F/R, 不同组织使用的内参基因为Act-F/R[20]。参照TAKARA 公司TB Green™ Premix ExTaq™ II(Tli RNaseH Plus)试剂盒说明书进行扩增,反应体系为20 μL:TB Green Premix ExTaqII 10 μL,ROX Reference Dye II 0.4 μL,10 μmol/L q33464-F/R各0.8 μL,ddH2O 7 μL,100 ng/μL 模 板cDNA 1 μL;反应程序为:95 ℃预变性20 s,95 ℃变性 10 s,60 ℃退火延伸30 s,40 次循环。进行RT-qPCR 反应时,每个样品设置3 次生物学重复3 次技术重复,使用2-ΔΔCt法计算相对表达量。使用SPSS 软件以Duncan’s 法进单因素方差分析,P<0.05 为差异显著水平,P<0.01 为差异极显著水平,GraphPad Prism 7 绘制柱形图。
2 结果与分析
2.1 HcLHY 的cDNA 克隆
以黄花菜开口前-12 h(6:00)样品的cDNA为模板,以c33464-F/R 为引物,克隆HcLHY基因的cDNA 全长共计2 126 bp。经NCBI-ORF Finder 分析,得到HcLHY基因 ORF 区,片段长1 929 bp,编码642 个氨基酸。此外,将克隆到的序列在黄花菜基因组(未公布)中Blast 得到mergeScaf19802,经序列比对后显示克隆序列、转录本(c33464.graph_c0)对应的CDS 和基因组外显子的一致性为100%。通过NCBI-blastp 进行序列比对,HcLHY与AoLHY(XP_020245416.1)、EgLHY(XP_010934912.2)、PdLHY(XP_008788724.1) 编码的蛋白同源性比较高,拥有相同保守域,并将本基因命名为HcLHY基因。由NCBI-CD Search 预测其保守结构域可知,在蛋白序列的N-羧基端有一预测其基因结构显示有5 个外显子,4 个内含子。个Myb DNA-binding 保守结构域,位于氨基酸序列的24 ~69 位点,并且具有蛋白相互作用模块功能的SANT 结构域,由此可知HcLHY 是一个典型的 MYB 转录因子。通过Gene Structure Display Server
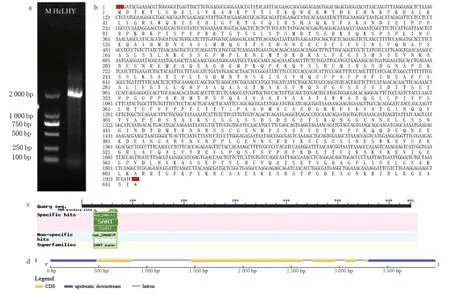
图2 HcLHY 基因的序列分析Fig.2 Sequence analysis of HcLHY
2.2 HcLHY 的生物信息学分析
利用 ProtParam 软件对HcLHY基因编码氨基酸进行基本理化性质预测(表 1),HcLHY 蛋白属不稳定蛋白,不稳定指数(Instability index II)为53.88(大于40),相对分子量为69 470.67 D,理论等电点(pI)为 5.82。80 个带负电荷氨基酸残基(Asp+Glu),占总氨基酸的12.5%;71 个带正电荷氨基酸残基总数(Arg+Lys),占总氨基酸的11.1%。340 位的Ala 丙氨酸和341 位的Thr(谷氨酸疏水性最强的(2.356),476 位的甘氨酸Glu、477 位的Gln、478 位的Asn 和479 位的Glu 亲水性最强(-3.544)。总平均亲水性(GRAVX)为-0.626 1,预测为亲水蛋白。预测HcLHY基因编码蛋白不具有跨膜结构域; 为转录因子,定位于细胞核中; 不具备信号肽。
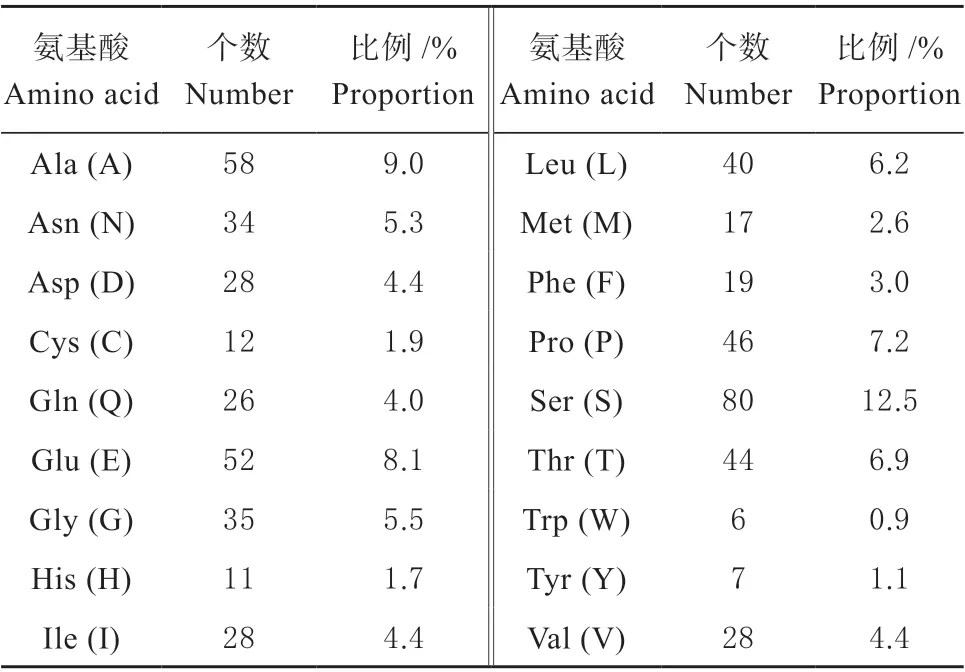
表2 HcLHY 蛋白氨基酸残基组成Table 2 Composition of amino acid residues in HcLHY protein sequence
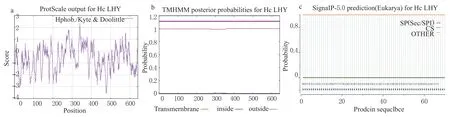
图3 HcLHY 蛋白分析Fig.3 Analysis of HcLHY protein
2.3 HcLHY 蛋白同源性比对及进化树分析
将HcLHY基因编码的氨基酸序列在NCBI 数据库中进行Protein Blast 比对,发现其与芦笋(Asparagus officinalis)、玉米(Zea mays)、海枣(Phoenix dactylifera)、野芭蕉(Musa acuminata subsp. malaccensis)、油棕(Elaeis guineensis)等有较高的同源性分别为53.49%、39.41%、43.89%、41.43%、44.81%,上述植物均为单子叶植物。和模式植物拟南芥Arabidopsis thaliana(AT1G01060 )的相似性为37.47%。利用MEGA5.0 将HcLHY 蛋白与其他物种进行多序列比对(图4),结果显示,HcLHY 蛋白与其他物种LHY 同源蛋白相比,在羧基端有共同的保守区域,这可能与MYB 转录因子的功能域存在于序列的羧基端有关。
使用MEGA5.0 构建系统进化树,分析HcLHY蛋白与其他物种LHY 同源蛋白的进化关系,结果如图5 所示,HcLHY 与同为百合科的芦笋蛋白聚在一支,亲缘关系最近,与非洲油棕、海枣亲缘关系较近。
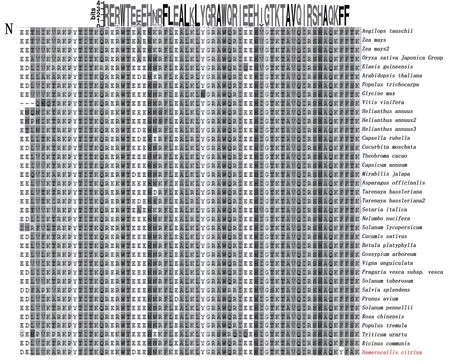
图4 HcLHY 蛋白序列比较及保守结构域motifFig.4 HcLHY protein sequence comparison and conserved domain motif

图5 LHY 蛋白系统进化树分析Fig.5 Phylogenetic tree of LHY
2.4 HcLHY 基因的时空表达特异性分析
为了探究HcLHY基因在花开放进程中的表达量,对HcLHY基因进行了时空特异性分析(图6、图7)。在开放前-12 h(6:00)表达量达到最大,从图6 可以看出+12 h(6:00)花朵已闭合,此时表达量降低。

图6 HcLHY 基因的表达分析Fig.6 HcLHY gene expression analysis
组织特异性分析结果显示(图7),HcLHY基因在花蕾开口前-12 h(6:00)不同组织中表达量存在差异,在花瓣中表达量最高,显著高于叶片、雌蕊、雄蕊、花萼及根,根中表达量最低。

图7 HcLHY 基因的表达分析Fig.7 HcLHY gene expression analysis
3 结论与讨论
LHY基因是在拟南芥中最先分离出来的,研究发现,LHY基因是一个典型的 R1 类 MYB 转录因子,是生物钟核心振荡器的关键基因之一[21]。LHY基因的表达具有昼夜节律性,其表达除了受光照和温度等环境信号的影响外,同时也受生物钟内源机制的调节。本试验中首次从萱草属植物中克隆得到生物钟基因HcLHY,并对其结构特征及花开放过程中的表达特性做了初步分析。该基因所编码蛋白具有典型的Myb DNA-binding 保守结构域,同源性分析显示黄花菜HcLHY编码的氨基酸序列与其他物种LHY 具有较高的相似性,且在N 端有共同的保守结构域,进化分析发现相同科或类群的植物聚为一类,HcLHY 与芦笋亲缘关系最近,同时发现不同植物的LHY 蛋白保守结构域也有较高的相似性,在被子植物生物钟系统中的功能高度保守。
在拟南芥生物钟模型中,光信号可以激活核心振荡器基因的表达,然后生物钟下游基因接收振荡信号后开始发挥作用使生物体做出一系列生理生化反应[5]。核心振荡器中LHY/CCA1基因在黎明时分表达量达到最高峰,同时抑制Toc1基因的表达,而Toc1基因在傍晚达到表达高峰,在此时LHY及CCA1的表达量也因为其抑制作用而降到谷底[22]。在拟南芥、大豆、大白菜[23]、金鱼草[10]、朵丽蝶兰[24]、杨树[25]等物种上LHY基因都是在黎明出现高峰,傍晚表达量有一个低谷,但他们的检测的都是该物种叶片24 h 内的表达,本研究以黄花菜为材料首次在花器官上验证LHY基因24 h 内的表达。在本试验中LHY基因1 天内的表达量也是在黎明时随着光照增强达到最高峰,在傍晚最低,有明显的节律趋势,与前人研究结果一致。
此外,在组织特异性的方面,研究者在采集了拟南芥黎明后1 h 的不同组织发现,叶片和茎的表达量高于根、花序和角果[26]。在朵丽蝶兰中营养器官的表达量明显高于生殖器官,表现出茎>花梗>蕊柱>唇瓣>叶片>萼片>花瓣>根的趋势[24]。在本研究中采集的是黄花菜黎明6:00 的各组织样品,花瓣表达量最高,其次是叶片,都显著高于雌蕊、雄蕊、花萼及根。此外,在‘大同黄花’以根、花蕾、叶片为材料转录组数据库中,c33464.graph_c0 花蕾的表达量明显大于叶片和根,与本研究结果相吻合。由此推测在开花过程中,LHY基因在黄花菜的花器官中发挥重要作用,花器官感受光信号,引起核心振荡器节律性表达,然后生物钟下游基因接收振荡信号后开始发挥作用促使其开花。
LHY基因为生物钟关键基因,在生物钟调控中起着关键作用。在拟南芥中有关生物钟相关的基因研究的较为透彻,但目前在萱草属植物中相关基因还未涉及。萱草属植物具有明显的24 h 节律,而开花时间对于萱草属植物的观赏时间具有重要影响,同时也直接决定以花蕾为食用器官的黄花菜的采收时间,进而影响黄花菜的产量、品质等重要性状。本研究通过对黄花菜生物钟LHY 基因的表达研究,为解析黄花菜LHY基因在开花时间的生物学功能提供了研究基础,对于挖掘黄花菜植物生物钟基因的调控网络,为下一步开展遗传和外源物质影响开花时间调控黄花菜采收提供理论依据。
