抗性淀粉结构特性和肠道菌群调节功能的研究进展
2020-07-13王培鑫吕芳澜郑宝东曾红亮
林 炎,王培鑫,吕芳澜,张 怡,2,郑宝东,2,3,曾红亮,2,3,*
(1.福建农林大学食品科学学院,福建 福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002;3.中爱国际合作食品物质学与结构设计研究中心,福建 福州 350002)
抗性淀粉是一种新型的膳食纤维,被定义为“不被健康个体小肠所吸收的淀粉及其降解物的总称[1]”。根据植物来源、品种、生长阶段、部位以及处理方式的不同,可将抗性淀粉分为物理性包埋淀粉(physically trapped starch,RS1)、天然抗性淀粉颗粒(resistant starch granules,RS2)、回生淀粉(retrograded starch,RS3)、化学改性淀粉(chemically modified starch,RS4)、直链淀粉-脂肪复合淀粉[2](amylose-lipid complexed starch,RS5)5 类。抗性淀粉特殊的结构性质主要与直链淀粉(由无水葡萄糖通过α-1,4-糖苷键组成的线性聚合物)和支链淀粉(是高度分支化聚合物,由含有5%左右的α-1,6-糖苷键组成)相互作用以及两者在抗性淀粉中的占比有关[3]。因此,呈现不同的颗粒形状(包括块状、层状、沟壑状、孔洞状、网络状/蜂窝状)、不同的晶体结构(由原生淀粉的A型、B型、C型转化为A型、C型、B型、V型或B+V型)和不同的分子结构(分子质量分布范围为104~108g/mol)。国内外研究者对不同来源抗性淀粉结构特征与肠道菌群调节功能之间的关系进行了探究,发现抗性淀粉与肠道菌群两者共存可产生积极效应,如:增强胰岛素敏感性、扩大肠道内抗性淀粉与菌群之间的可发酵面积,减少脂肪积累、改善葡萄糖稳态和脂质代谢等作用[4]。其原因是肠道中有益微生物对抗性淀粉的发酵作用与肠道有益微生物代谢碳水化合物产生的短链脂肪酸(short chain fatty acids,SCFAs)共同促进机体健康。此外,抗性淀粉对炎性肠病[5]、肥胖[6]、2型糖尿病[7]、心血管疾病[8]、慢性肾病[9-10]、短肠综合症[11]、癌症(胰肠癌、结肠癌)[12-13]等疾病的发生有重要的预防及调控作用,并可进一步影响骨密度和炎症以及紧密连接蛋白基因的表达[12]。
1 抗性淀粉的定义及分类
1982年,Englyst等[14]首次发现,在煮熟冷却后的马铃薯中存在不可被胰腺淀粉酶和普鲁兰酶水解的淀粉,而提出了抗酶解淀粉;Englyst等[15]建立了体外小肠消化环境,定义了3 类不同葡萄糖释放速率的淀粉,其中包括在口腔及小肠中迅速消化吸收(时间小于20 min)的快消化无定形淀粉(rapidly digestible starch,RDS);在小肠中完全消化吸收,但速率较慢(时间20~120 min)的慢消化无定形或结晶淀粉(slowly digestible starch,SDS);经过小肠后在结肠中才可发酵的抗性淀粉。RDS摄入后立即引起血糖升高,SDS的摄入较RDS能较为缓慢地引起血糖变化,而抗性淀粉能达到有效控制血糖变化的目的。
根据表1抗性淀粉的不同类型来源及其消化情况,RS1主要存在于硬质小麦、豆类种子等由细胞壁或是蛋白质包埋的淀粉本体中,通过物理结构阻碍淀粉消化;RS2属于天然抗性淀粉颗粒,存在于未成熟的绿皮香蕉、马铃薯、未加工的豌豆中等具有紧密结构的天然食物结构中,由于B型和C型两种致密的晶体结构使RS2不能被淀粉酶消化;RS3淀粉是指淀粉先经历糊化(即通过添加过量水或配比水后加热,进而破坏原有结晶结构的过程),后经过食品加工过程中的回生(即冷却或是脱水时被破坏的颗粒结构缓慢重结晶逐渐形成双螺旋结构的过程)作用重新聚合形成的重结晶组分;RS4是一种化学改性淀粉,淀粉在醚化、酯化、以及交联等化学作用下[16],形成不同于α-1,4-糖苷键及α-1,6-糖苷键的新化学键,因而具有对淀粉酶的抗性。RS5是新型的直链淀粉-脂质类抗性淀粉,其结构变化主要是由淀粉构象所引起,当存在合适的配体(脂质)时,直链淀粉将由双螺旋向单螺旋构象转化,从而实现脂质进入直链淀粉螺旋腔后直链淀粉与脂质不同程度的复合,形成具有塌陷螺旋构象的V6I、V6II、V6III及V8型的结构晶体[17]。因此,也称直链淀粉-脂质复合物为V-复合物,其属于直链淀粉单螺旋内或在螺旋间空间中存在的小客体分子,其包括单体类黄酮、染料木黄酮以及缩合单宁等与直链淀粉相互作用的多类别分子[18-19]。

表1 抗性淀粉的不同类型来源及其消化情况Table 1 Different sources of resistant starch and their digestion levels
2 抗性淀粉的制备和测定
抗性淀粉抗酶解性的关键因素与淀粉本体特征有关,包括淀粉基本成分的含量、颗粒结构、聚合度、直链淀粉的链长、结晶区支链淀粉双螺旋结构的排列方式等[24-26]。此外,食品加工及贮藏条件也对抗性淀粉的含量及其结构的稳定性产生影响[27]。一般而言,不同植物来源的淀粉在加工过程中通过施以不同时间、不同温度、不同方式而达到提高抗性淀粉含量的目的,其中物理处理法、化学改性法、脂质复合法以及生物改进法已形成一定的理论体系(图1)。

图1 抗性淀粉的制备方法Fig. 1 Preparation methods for resistant starch
1)物理处理法通过经历糊化和老化两阶段,糊化一般采用湿热和压热,包括蒸煮、高压灭菌微波等处理方式,后经历冷热循环、冷冻循环等老化过程促进无定形分子重结晶形成双螺旋结构,通常形成RS3型。李素玲[28]以绿豆淀粉为原料采用湿热法糊化,120 ℃环境条件下将水分质量分数为20%的绿豆淀粉加热12 h后,其抗性淀粉含量达到45.2%。2)化学法通过削弱α-淀粉酶与糖苷键的结合作用及降低淀粉消化的程度而促进抗性淀粉含量增加[29]。任俊彦[3]研究发现,木薯淀粉经辛烯基琥珀酸酐酯化处理后有效引入酯羰基,抗性淀粉含量得到显著提高。3)脂质复合法是指淀粉、脂质以及其他化合物通过疏水性基团相互作用形成单螺旋结晶结构[30]。4)生物酶法改性包括酶法以及基因工程法,酶法一般被称为酸解脱支法,基于脱支酶的脱支作用以及无机酸的降解作用而得以实现,一般添加水解酶(α-淀粉酶、β-淀粉酶、普鲁兰酶在单独改性时的使用居多)、糖基转移酶(多与水解酶协同作用)、麦芽三糖酶等进行处理[31],具有反应效率高、底物特异性强,能有效降低产物快消化淀粉含量,增加慢消化淀粉及抗性淀粉含量等优点。以添加普鲁兰酶为例,其作用于支链淀粉与支链淀粉连接的α-1,6-糖苷键,从而达到释放更多在回生时排列并聚集形成的晶体结构短线性分子,提高抗性淀粉产量的目的[32]。基因工程法则是以从分子遗传技术为基础,从基因水平层面促使淀粉颗粒的结构与含量发生变化。
目前,国际上常用的抗性淀粉含量测定方法分为体内直接法(测定体内未被小肠吸收的淀粉及其降解物)和体外间接法(不被淀粉酶水解的淀粉含量)。体内直接法包括测定人体肺部呼吸释放的氢气含量、回肠造口术法以及插管法;体外间接法是利用消化前后淀粉质量的差值而进行的研究,主要方法包括Björck方法[33]、Berry方法[34]、Englyst方法[14]、Champ方法[35]、Goñi方法[36]、Akerberg方法[37]、McCleary方法[38]、AOAC方法[39]、AACC推荐方法[40]、直接法(基于Englyst和Champ方法)[41]、猪胰α-淀粉酶法[41]、耐高温α-淀粉酶法[41]。目前,以AOAC方法以及AACC方法为基础的Megazyme试剂盒因其适用范围广、使用方便及准确率高的特点在分析实验室中得到广泛的推广及应用[42-43]。
3 抗性淀粉的表观结构特性
抗性淀粉的表观结构在扫描电子显微镜或透射电子显微镜的观察下呈现块状、层状,其中根据块状颗粒表面形态分为沟壑块状、孔洞块状或网络块状/蜂窝块状以及复合状(图2)。例如,在糊化过程中持续加热或是酶处理的马铃薯淀粉(图2a)颗粒易发生溶胀以及熔化,向无定形状态转变,并与周边的淀粉偶联形成海绵状结构,促进老化阶段内部双螺旋结构生成,形成更为致密的晶体结构,易产生凹陷孔洞以及蜂窝状结构及复合状[44-45],但并非所有经过酶处理的抗性淀粉都以块状为主,有研究发现经过α-淀粉酶处理后的苦荞抗性淀粉呈现片状结构(图2g);对薏仁抗性淀粉(图2b)进行微波处理后发现,其表面粗糙程度较大并形成密集的条纹状沟壑,可能是由于微波的快速导热机制所产生的形貌特征,而在超声辅酶压热法的研究中发现其呈现出孔洞状结构特征(图2d),这可能是超声波空化作用所引起的[45];常见的淀粉处理以高压均质、高速剪切以及超声波等外界辅助压力与交联技术相互结合的处理方式进行,主要原因是淀粉在交联过程中分子链之间的相互作用增强,易发生团聚现象,多呈现出沟槽层状结构乃至于出现单颗粒上的立体网状结构,例如经过高压均质-反相乳化交联法制得的RS4基纳米抗性淀粉(图2e)[46],但值得注意的是团聚现象的发生与交联化、酰化程度有一定的联系,例如,当乙酰化的取代度较低时,抗性淀粉的表征形貌无法出现融合、皱缩、孔洞甚至于网状结构[47-48]。因此,抗性淀粉的形貌特征不仅与淀粉来源有关,还与抗性淀粉形成前后的处理方式密切相关。当抗性淀粉属于同一来源时,处理方式的差异会导致表观结构可能存在不同。例如,Zeng Shaoxiao等[49]通过压热法、超声-压热法、微波法制备莲子抗性淀粉,发现与压热法制备的莲子抗性淀粉相比,微波法制备的莲子抗性淀粉颗粒较小且较为光滑,而超声-压热法处理的莲子抗性淀粉颗粒较大且较为粗糙。欧阳梦云[50]研究发现,籼米淀粉在超声辅助-双酶复合法处理后呈现深陷沟壑块状(图2c),而在晶种诱导-双酶复合法处理后呈不规则块状,且表面凹凸不平,以塌陷状为主(图2f)。当抗性淀粉为非同一来源时,以相同的方式处理,其所呈现的表观结构也不一定相同,宋家钰等以压热酶法对苦荞抗性淀粉及黑豆抗性淀粉的研究[51]中验证了以上猜想。

图2 不同抗性淀粉的表观结构特性Fig. 2 Apparent structural characteristics of different types of resistant starch
4 抗性淀粉的晶体结构特性
不同抗性淀粉的晶体类型与结晶度如表2所示,抗性淀粉存在4 种不同的晶体结构类型,分别是A型、B型、C型、V型晶体结构。A型结构(衍射角2θ为15°、17°、18°、23°的单斜晶胞)大多数存在于谷类淀粉中,B型结构(衍射角为2θ为5.6°、17°、22°、24°的六方晶胞)的抗性淀粉主要是由链长为30~44 个葡萄糖分子的支链淀粉与直链淀粉交错缠绕组成,当其经过压热-酶解处理,芸豆淀粉、鹰嘴豆淀粉、红豆淀粉等均呈现B型晶体结构。有研究表明,压热法处理通常会使得抗性淀粉从A型结晶向B型结晶转化[53]。C型晶体结构(衍射角2θ为5.7°、15.3°、17.2°、18.3°、23.5°)是A型与B型晶体结构的混合物,主要有芋头、甘薯等块根淀粉以及某些豆类淀粉,其中C型又被分为Ca、Cb、Cc,Ca型接近于A型,Cb型倾向于B型,刘敏[44]的研究表明,经过微波双酶法、湿热酶法、微波湿热法制得的马铃薯抗性淀粉更接近于Cb型,结晶度为29.12%~30.52%,而2 次循环湿热法制得的马铃薯抗性淀粉更接近于Ca型,结晶度为28.65%。V型晶体结构(衍射角2θ为7.4°、13°、19.8°)主要存在直链淀粉和磷酸单酯、脂肪酸等复合物以及糊化后的淀粉(即RS5型抗性淀粉)之中,又被分为V6I、V6II、V6III、V8。有研究表明不同晶型复合物主要区别在于脂质进入直链淀粉螺旋腔内的程度[17]。普通玉米淀粉经过复合酶的处理,抗性淀粉的晶型由B+V型向V型发生转变,正是因为晶体结构的改变导致了RS3抗酶性能的增加。
抗性淀粉晶体结构与其处理方式有关,其中,酶解(酸解脱支)法是基于不同的淀粉来源以及性质实现不同淀粉酶的修剪及脱支作用,从而促进α-淀粉酶对任意α-1,4-糖苷键的内切作用,由此获得大量游离直链分子,后再基于普鲁兰酶对α-1,6-糖苷键的催化作用,在老化过程中双螺旋实现相互缔结,从而形成一种具有高抗性的晶体结构。因此,当原淀粉以A型晶体结构存在时,其易形成B型、V型以及B+V型晶体的抗性淀粉,值得关注的是,A型晶体向B型或是B+V型晶体转化时,处理酶的添加顺序会对转化后的晶体结构产生影响,欧阳梦云[50]以微波预糊化籼米淀粉(A型晶体结构)为原料,利用超声波间歇式辅助异淀粉酶和普鲁兰酶分步脱支酶解制备RS3型籼米抗性淀粉,发现先添加异淀粉酶后再添加普鲁兰酶制备的RS3型籼米抗性淀粉晶体结构为B型,先添加普鲁兰酶后添加异淀粉酶RS3型籼米抗性淀粉晶体结构为B+V型。当晶体结构为B型的原淀粉(如马铃薯原淀粉)形成抗性淀粉之后,其晶体结构可能会向C型转变,包括Ca型与Cb型;当晶体结构为C型的原淀粉(例如,莲子原点粉)在转化为抗性淀粉之后,其晶体结构会向A型、B型、V型以及B+V型转变。
大量研究表明不同的处理方式会影响抗性淀粉的晶型结构,但吴小婷[54]在对莲子原淀粉分别施以压热处理、微波处理以及超声波-压热处理后,不同处理使莲子原淀粉的C型结构均转化为B型结构,由此却说明了莲子抗性淀粉的晶体类型与热处理方式无关。Chen Chuanjie等[25]研究了水分添加量(50%~90%)对莲子抗性淀粉的影响,发现即使莲子抗性淀粉中水分含量不同,但莲子抗性淀粉依旧保持B型结构。淀粉的回生重结晶动力学研究表明,淀粉回生过程主要包括:单纯淀粉链高聚构象改变、晶核诱导形成、晶体增长、晶体完美形成这4 个阶段。由于高能无序的淀粉分子在范德华力和氢键吸引力的作用下发生重结晶生成抗性淀粉,若有效控制重结晶发生前加入晶种,通过降低溶液的过饱和度、缩短析晶时间就能尽量避免出现爆发式的成核现象,进而能有效提高抗性淀粉的产率。目前,欧阳梦云[50]通过控制重结晶动力学过程中晶体成核方式,将晶体诱导与双酶法相互结合,促进籼米淀粉内晶体的有序结构形成,其中在B+V型结晶结构中表现得最为突出。
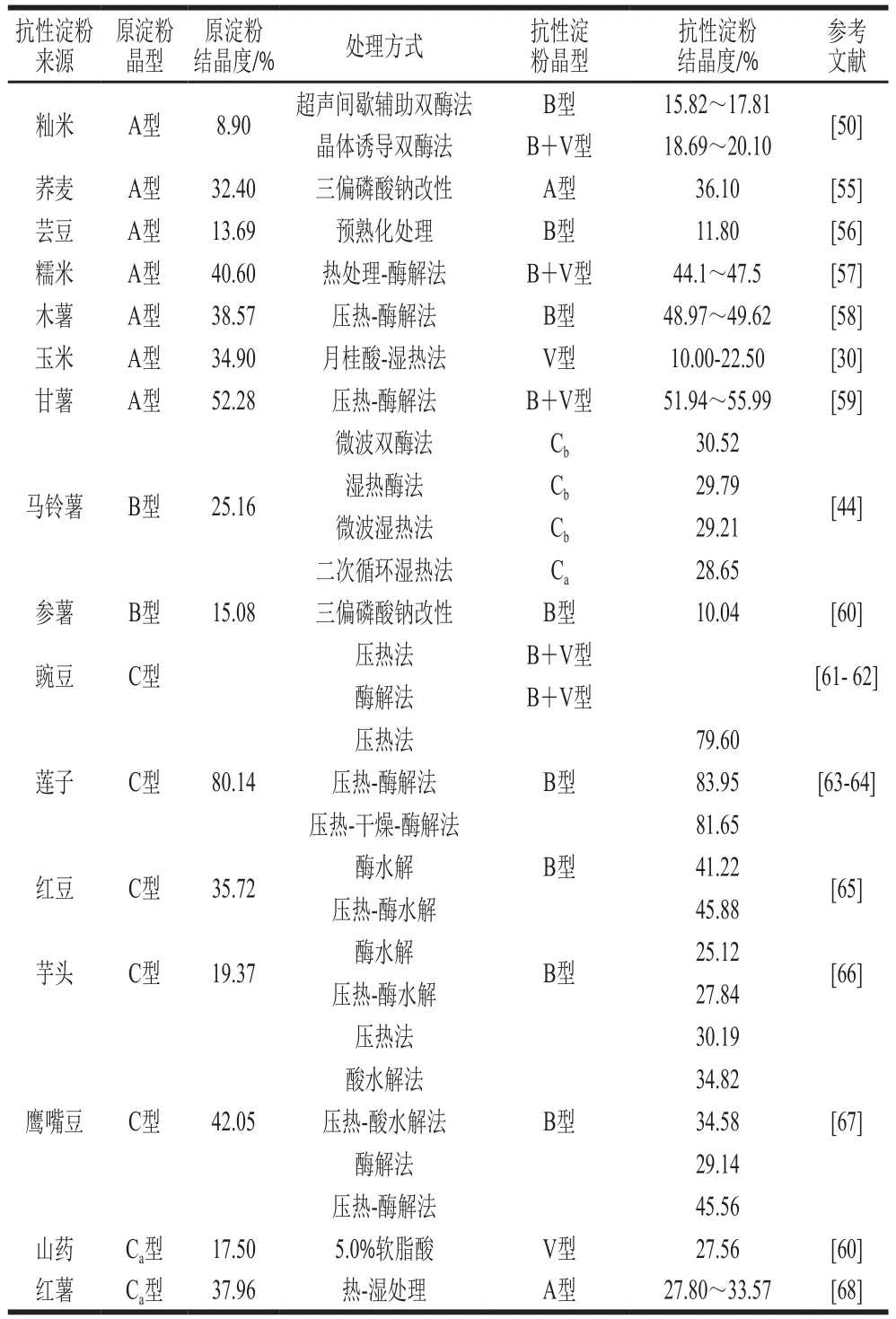
表2 不同抗性淀粉的晶体类型与结晶度Table 2 Crystal types and crystallinity of different types of resistant starch
5 抗性淀粉的分子结构特性
淀粉分子中的直链淀粉和支链淀粉的短链部分有助于双螺旋短程有序结构的形成,而傅里叶变换红外光谱(Fourier-transform infrared spectroscopy,FT-IR)的衰减全反射模式以及投射模式恰好满足短程分子有序结构(淀粉链构象、螺旋结构、结晶度)变化以及形成过程中产生氢键组合的变化程度做出有效界定。通常将抗性淀粉与溴化钾以质量比1∶200混合后放置于扫描波谱范围为400~4 000 cm-1、分辨率为4 cm-1的FT-IR仪中进行检测。有研究结果表明,FT-IR图所呈现的特征吸收频率对应不同的基团类型[50,61](表3),通常情况下RS3型淀粉可通过995 cm-1和1 047 cm-1处的吸收峰变化判断晶体结构的改变,1 047 cm-1和995 cm-1处的吸收峰分别与抗性淀粉的有序结构和水合结晶有关,1 022 cm-1处的峰与无定形结构有关,利用1 047/1 022 cm-1和995/1 022 cm-1峰值比来表示淀粉颗粒外部区域的有序程度或是双螺旋的内部变化。例如在莲子抗性淀粉中,800~1 200 cm-1处呈现的特征峰显然比天然淀粉弱,也可进一步推测莲子抗性淀粉的构象与莲子原淀粉相比已发生变化。RS4型抗性淀粉是淀粉经过醚化、酰化或是交联作用后得到的改性淀粉,研究表明RS4荞麦抗性淀粉在990~1 050 cm-1处出现吸收峰,这个波段是P—O—C基团的吸收峰,证明了RS4荞麦抗性淀粉中有淀粉磷酸酯的生成[55];乙酰化处理的马铃薯淀粉在1 730 cm-1处出现强吸收峰,可以判定该反应过程中产生了乙酰化基团[48],这与酯化反应过程中产生的1 746 cm-1处的新峰所代表的酯羰基基团极为相似。淀粉与脂质复合后的分子特征同样可以通过FT-IR光谱进行表征,孟爽[69]通过比较玉米淀粉、玉米淀粉与硬脂酸混合物和玉米淀粉-硬脂酸复合物的光谱发现,在以上混合物与复合物中皆出现了1 711 cm-1处的C=O的伸缩振动与2 850 cm-1处C—H的伸缩振动,而复合物较混合物相比,并没有新的特征峰出现,说明在复合物的形成过程中未产生新的基团,表明淀粉与硬脂酸之间并未发生化学反应,而是通过疏水作用络合形成稳定的复合物。

表3 抗性淀粉的红外光谱特征峰Table 3 Infrared characteristic peaks of resistant starch
此外,还可通过紫外分光光度计、高效分子排阻色谱和激光衍射法粒度分析仪等仪器测量抗性淀粉的直链淀粉含量、聚合度、分子质量分布等分子结构特征(表4)。研究表明抗性淀粉的分子结构特征会因为植物来源以及处理方式的不同而呈现出的差异性,例如,同是经过高支化处理的蜡质玉米淀粉以及木薯淀粉,两者之间的重均相对分子质量(Mw)有较大的差异。而同一来源马铃薯淀粉经过微波、双酶、湿热法等不同方式处理后,它们的分子质量分布也呈现较大的差异。但值得关注的是,木薯淀粉原料以及蜡质玉米淀粉经过颗粒淀粉高支化修饰后形成的抗性淀粉含量与直链淀粉含量均有较大差异[3](表4)。直链淀粉含量越高淀粉越容易老化,玉米淀粉经过压热-酶处理后直链淀粉的质量分数从(23.04±0.18)%上升至(43.40±0.83)%,抗性淀粉的质量分数从(1.33±0.02)%上升至(50.84±0.49)%,说明压热-酶处理有利于抗性淀粉的形成,直链淀粉含量越高,形成抗性淀粉的含量也越高[70]。与原料淀粉颗粒相比,抗性淀粉的粒径明显增大,说明原料淀粉经过工艺手段制备生成抗性淀粉的过程中,部分淀粉颗粒产生膨化效果或聚集成更大的颗粒[70],Zheng Mingjing等[71]对比单一莲子抗性淀粉与莲子抗性淀粉与壳聚糖混合物发现,后者的直链淀粉含量更高,形成了更完整的有序结构且观察到明显的大颗粒聚集趋势。实验中通常用分散度来衡量分子质量分布的宽度,由Mw与数均相对分子质量(Mn)的比值表示,当Mw/Mn为1,说明淀粉样品为单分散体系;Mw/Mn比值与1的偏移程度越大说明淀粉样品分子大小越不均一[3]。Zeng Hongliang等[72]的研究结果表明,淀粉结构上的细微差异与Mw有着密不可分的关系,当抗性淀粉的Mw在3.0×104~3.0×106范围时,则可促进结晶相以及双螺旋结构的形成。此外,不同处理易对淀粉的分散度产生影响,例如马铃薯淀粉经微波-湿热处理后,其分散度从1.330降至0.303,均一性减小[44]。莲子淀粉经压热-干燥-酶处理后其分散度从4.119降至1.045,分散程度下降显著[64]。

表4 抗性淀粉的分子结构特征Table 4 Molecular structural characteristics of resistant starch
6 抗性淀粉的肠道菌群调节功能
6.1 抗性淀粉对益生菌的影响
益生元与益生菌存在共生关系,由于抗性淀粉可作为底物被结肠微生物发酵并利用,因此具有促进益生菌生长及增强其活性的作用,并且能够与其他益生元膳食纤维相互作用发挥其益生元效应[73]。有动物(小鼠、大鼠以及猪等)实验的研究结果显示,抗性淀粉可增加拟杆菌[74]、双歧杆菌[75-76]、乳酸杆菌[74-76]、瘤胃球菌[77]、粪球菌属[76]以及支原体科[76]菌种的丰度,提高厚壁门菌/拟杆菌的比值。Kawakami等[74]研究发现,以饲料补充剂RS2饲养的大鼠的盲肠内容物的厌氧菌水平高于以饲料补充剂RS3饲养的大鼠。因此,可猜测不同类型的抗性淀粉在影响人类肠道微生物群方面存在功能差异。通过人体研究,对10 名健康人进行了双盲交叉研究验证,结果表明补充RS4 3 周,能显著增加人体粪便菌群中放线菌的丰度和拟杆菌(青春双歧杆菌和狄氏副拟杆菌)的丰度,同时减少厚壁菌门的丰度,而补充RS2与补充RS4相比能显著提高布氏瘤胃球菌和直肠真杆菌的比例[78]。Zeng Hongliang等[79]研究发现,以无糖MRS培养基为基础培养基,研究RS3型莲子抗性淀粉对肠道微生物体外增殖的影响,结果发现RS3型莲子抗性淀粉主要促进双歧杆菌与乳杆菌的增殖,并提高长双歧杆菌对酸性缓冲液的耐受性与德氏乳杆菌亚种的存活率。
6.2 抗性淀粉对肠道菌群的影响
机体健康和肠道中微生物群落有着密不可分的联系,人体肠道细菌的种类超过1 000 种,细菌的细胞总数高达4×1013个左右,成年人的肠道细菌与自身细胞数之比约为1∶1[80]。肠道微生物生态系统处于动态变化之中,受基因、肠道位置、健康状况、年龄、药物、补充剂和饮食等诸多因素的影响[81]。饮食是塑造肠道微生物群组成和影响肠道群落功能的关键因素[82]。例如,抗性淀粉与肠道菌群的数量以及种类有直接关系,Kieffer等[83]建立由腺嘌呤诱导的慢性肾脏疾病大鼠模型,以高直链淀粉玉米2型的抗性淀粉进行喂养,结果显示肠道内细菌种类平均减少15%,放线菌和变形菌的相对丰度显著增加,厚壁菌的相对丰度显著降低。Zeng Hongliang等[84]使用RS3型莲子抗性淀粉(lotus seed resistant starch,LRS3)喂养小鼠,结果显示,喂食LRS3的小鼠肠道细菌多样性水平低于正常组以及高直链玉米淀粉组,且小鼠的肠道中乳酸杆菌和双歧杆菌、毛螺菌科、瘤胃菌科和梭状芽孢杆菌属等淀粉利用菌[85]和丁酸产生菌[86-87]的数量增加(表5),而理研菌科和紫单胞菌科则均降低。抗性淀粉的摄入选择性调节特定肠道微生物群的水平,促进了双歧杆菌与乳酸菌的增长,但限制了沙门氏菌和李斯特菌[88]。因此,抗性淀粉具有促进肠道内有益菌的生长、抑制有害菌或致病菌的增殖等作用。此外,Koay等[89]观察小鼠摄入抗性淀粉后能有效增加肠道微生物的代谢物,例如三甲胺-N-氧化物、胆汁酸、胆固醇硫酸盐三羧酸循环中间产物等。
6.3 抗性淀粉调节肠道菌群产生SCFAs的微生物机制

表5 不同益生菌的发酵产物[91]Table 5 Fermentation products from different probiotics[91]
肠道微生物通过部分或完全发酵饮食中无法完全被酶水解的抗性淀粉,代谢产生SCFAs(其中乙酸盐相对含量高于60%、丁酸相对含量69.5%、丙酸相对含量50.2%、戊酸相对含量44.1%、异戊酸相对含量20.3%、己酸相对含量19.2%)、乳酸和其他产物[90]。结肠是人体内SCFAs的主要产生部位,这些SCFAs多是由未消化的底物在结肠内被厌氧菌酵解产生的乙酸、丙酸、丁酸、乳酸等组成。由于机体内肠道环境各异、肠道发酵位置、发酵底物以及肠道内发酵菌的种类(淀粉利用菌、丁酸产生菌)不同,对应产生的SCFAs的种类、数量以及对肠道功能及机体健康所发挥的作用也不相同[91](表5)。大量的研究表明,人体和动物摄食抗性淀粉含量高的食物后,肠道和粪便的SCFAs含量增高,且宿主的肠道菌群也发生了适应性改变[85,92-93]。方建东[94]研究了RS3型玉米抗性淀粉对肠道菌群的影响,发现RS3型玉米抗性淀粉不仅能够提高小鼠肠道菌群多样性,促进双歧杆菌和乳杆菌增殖,抑制大肠杆菌和肠球菌生长,并且能够提高肠道SCFAs含量。Lesmes等[95]研究发现RS3型抗性淀粉结构的微小差异对肠道内丁酸含量的调控作用也会产生影响。
7 抗性淀粉结构对肠道菌群调节功能的影响
抗性淀粉的表观结构特征影响肠道菌群调节功能,这可能是肠道微生物对淀粉底物结构特征的敏感性所造成的,而这类调控机理可能是受淀粉颗粒的表面形态及颗粒内部精细结构所影响。比如,莲子抗性淀粉之所以能促进双歧杆菌增殖,可能与其表面结构有关,经过压热、微波等处理后的莲子抗性淀粉表面具有的特殊沟塾状结构,能提高益生菌在不良肠道环境的适应性,使其更好地利用碳源,促进自身增殖[96];张岩[97]比较了非热处理、干热处理、压热处理制备的抗性淀粉对肠道菌群代谢产物的影响,发现干热处理制备的抗性淀粉作为底物进行发酵可有效地提高发酵液总SCFAs浓度,尤其是提高肠道菌群产丁酸能力,这可能是由于干热处理制备的抗性淀粉颗粒内部的有序程度比RS2更低,该结构可能更利于微生物的利用与增殖,产生更多的SCFAs。以压热法制备RS3作为发酵底物时,肠道微生物产酸能力最弱。有可能是由于最初的热处理方式对其结构产生较大影响,压热后的结构更加碎裂与不规则,不利于微生物的着陆利用。杨春丰等[98]制备与纯化得到了板栗抗性淀粉及消化抗性淀粉,并研究了它们的益生作用与结构变化。结果表明:板栗抗性淀粉及抗消化性淀粉对双歧杆菌和乳酸杆菌都有显著的增殖作用,对大肠杆菌和产气荚膜梭菌有强抑制作用,对粪肠球菌、梭状杆菌、兼性细菌无明显影响,而这可能与板栗抗性淀粉表面粗糙不平的叠层结构特征有密切联系。另一方面,分析对比发酵前后的板栗抗性淀粉的结晶结构,经过人工胃液消化的板栗抗性淀粉由V型转化为B型,人工肠液消化的板栗抗性淀粉由V型转化为A型,后者颗粒结构由原来大小不均一的叠层结构变为大小均匀的疏松结构,且平均聚合度有所减小,与谢涛等[99]关于马铃薯抗性淀粉的研究结果一致。抗性淀粉的分子结构亦会对肠道菌群益生菌造成一定的影响,林姗[100]在对抗性淀粉分级分离的研究中发现,抗性淀粉的Mw越小,其对益生菌的增殖效果越小。因此,可以推测抗性淀粉的结构在对肠道益生菌产生保护作用的同时,肠道菌群亦能对抗性淀粉的表观结构产生影响。抗性淀粉可在肠道微生物发酵作用下产生丁酸,其产丁酸能力高于其他膳食纤维[101]。抗性淀粉的精细结构对其调节肠道产丁酸能力起着决定性作用。周中凯等[102]研究发现,玉米抗性淀粉的颗粒形态、有序结构和无序结构影响肠道微生物产丁酸能力,高有序结构的玉米抗性淀粉可促进肠道内丁酸的生成。目前,关于抗性淀粉结构对肠道菌群相关性影响的研究内容相对较少,尤其是不同晶体结构以及分子结构对肠道菌群的调节功能等方面的影响,仍需进一步的研究。
8 抗性淀粉的开发与利用趋势
抗性淀粉的加工特性及益生作用使其具有较为广泛的可利用空间。抗性淀粉添加于面包类食品中以改善色泽、口感,因此可以达到优化加工工艺、提高感官评价的效果;添加于油炸食品中以提升表面的脆度和硬度,加深油炸食品表面的金黄色达到增加食欲的效果;添加于面条制品中可以降低含油量,加深色泽,同时提高面制品的营养价值。除此之外,抗性淀粉还可作为益生元被添加到食品中,主要的作用有:1)作为发酵底物为有益菌的生长提供能量;2)作为新型的可溶性膳食纤维为机体提供益生作用;3)作为包埋性微胶囊材料提高食品的稳定性。
目前,行业内有关抗性淀粉的应用主要集中在药物载体方面,特别是口服结肠定位给药系统(需具备阻止胃液和肠液降解的能力)的理想药物载体。Sivapragasam等[103]证明了纳米抗性淀粉是一种可用于结肠靶向给药的新材料,丁涌波[46]验证了基于纳米技术处理的RS3和RS4载药型抗性淀粉在人工胃液的作用下释放率快,但是累积释放率低;而在人工肠液和人工结肠液实验条件下,基于纳米技术处理的RS3和RS4载药型抗性淀粉能实现药物的有效控释。
9 结 语
随着生活水平的提高,人们对于食品营养与身体健康之间关系的关注度逐渐提升,近年来抗性淀粉因其肠道菌群调节功能的特殊性质而进入大众的视野。抗性淀粉来源广、涉及类别较多,可通过物理、化学、生物酶促法等方法进行制备。本文从不同类别抗性淀粉的表观结构、分子结构、晶体结构3方面介绍抗性淀粉结构特性对其肠道菌群调节功能影响,未来研究方向可从以下4 个方面进行探究:1)建立加工条件与抗性淀粉原子和分子等多次度结构之间关系;2)通过Pearson(皮尔逊)、Kendall(肯德尔)和Spearman(斯皮尔曼)等相关性指数建立结构与肠道菌群调节功能的关系;3)进一步研究结构特性对肠道菌群调节功能的分子机制;4)通过多组学研究这种肠道菌群的调节与机体健康的关系等。
除此之外,抗性淀粉精细结构与肠道菌群调节功能的关系也是近年来所研究的热点问题。但就目前的情况而言,关于抗性淀粉结构特性对肠道菌群调节功能的作用机制尚未明确。因此,需建立抗性淀粉结构特性与体外/体内定量的研究方法,为后期抗性淀粉应用于药物载体、结肠系统定点治疗提供有力的理论基础。
