刺芫荽中多糖的提取工艺优化及含量测定
2020-06-28何月秀王崟宁曾维晶李安顺翟锐锐艾朝辉
何月秀,王崟宁,曾维晶,李安顺,翟锐锐,李 娟,艾朝辉
(海南医学院 药学院,海南 海口 571199)
刺芫荽又称刺芹、洋芫荽、野芫荽、假芫荽、大叶芫荽、缅芫荽、阿佤芫荽等,伞形科刺芹属多年生草本植物。可用于治疗感冒寒咳、哮喘、胃气痛、产后出血、跌打损伤、肠炎腹泻、消化不良、胸痛、麻疹内陷、气管炎、急性传染性肝炎及蛇咬伤等症[1-4]。刺芫荽中含有多种天然产物,如多糖、黄酮、月桂醇等化合物;越来越多的研究表明天然多糖类化合物具有抗氧化、抗衰老、抗肿瘤及免疫增强作用[5]。然而迄今为止国内外对刺芫荽中多糖的含量和成分还没有报道过,刺芫荽作为一种可贵的药用植物资源,目前仅作为一种香料和调料食用,还没有被全面地开发利用[1]。因此,开发和利用刺芫荽多糖在现实生活中具有重要意义。本实验主要研究影响刺芫荽多糖提取的多种因素并优化提取工艺,建立刺芫荽多糖的测定方法。
1 实验部分
1.1 仪器与试剂
粉碎机,天津泰斯特仪器有限公司;恒温水浴锅,上海博讯生物医疗仪器有限公司;电子分析天平,瑞士METILER;TP电子天平,湘仪天平仪器设备有限公司;722型分光光度计,上海精密科学仪器有限公司。葡萄糖、浓硫酸、苯酚、无水乙醇等试剂均为分析纯,广州化学试剂公司;实验用水为蒸馏水;刺芫荽,采摘于海南地区,经鉴定为刺芫荽全草,干燥,粉碎至250~380 μm备用。
1.2 实验方法
1.2.1刺芫荽多糖提取工艺流程
准确称取1.0 g刺芫荽粉末于圆底烧瓶中,加入适量蒸馏水,于一定温度中水浴提取一定的时间,离心,取上清液,浓缩,再加入体积分数为75%乙醇使多糖沉淀,于冰箱中放置24 h后,再次离心得到刺芫荽多糖。
1.2.2标准曲线的绘制
准确称取100 mg标准葡萄糖于100 mL容量瓶中,加水至刻度,摇匀配置成1 g/L的标准溶液,依次吸取0.20、0.40、0.60、0.80、1.00、1.20 mL的葡萄糖标准溶液于6个25 mL的容量瓶中,并依次加入1 mL 6%的苯酚,5 mL浓硫酸,摇匀后静止30 min,加水定容,静置室温,以水为空白,于490 nm处测其吸光度。以横坐标为多糖浓度,纵坐标为吸光度,作标准曲线。得标准曲线A=6.291 5c-0.032,R2=0.997 1,表明在0.008~0.064 g/L有良好的线性关系。
1.2.3刺芫荽多糖的测定
将提取的多糖加入适量蒸馏水配制成多糖溶液。取2.00 mL的多糖溶液于25 mL容量瓶中,按1.2.2步骤加入1 mL 6%的苯酚,5 mL浓硫酸等操作,并于490 nm处测定吸光度,以标准曲线法计算多糖含量。
多糖提取率=c×V×D/W
式中:c,多糖的浓度,g/L;V,多糖溶液的体积,mL;D,稀释的倍数;W,刺芫荽粉末的质量,g。
1.2.4单因素考察
以料液比、提取温度、提取时间、提取次数4个因素进行单因素试验。
1.2.5正交实验
根据单因素试验结果,设计料液比、提取温度、提取时间、提取次数4个因素3水平的正交实验,确定刺芫荽多糖的最佳提取工艺条件。
1.3 方法学考察
1.3.1精密度试验
准确精密称取刺芫荽样品1.0 g,按1.2.1方法提取刺芫荽多糖及1.2.2方法于490 nm处连续6次测定吸光度。
1.3.2稳定性试验
准确称取刺芫荽样品1.0 g,按1.2.1方法提取刺芫荽多糖及1.2.2方法于490 nm处每隔30 min测定吸光度,连续测定3 h。
1.3.3重复性试验
分别称取6份1.0 g刺芫荽样品,按1.2.1方法提取刺芫荽多糖及1.2.2方法于490 nm处分别测定吸光度。
1.3.4加样回收率试验
分别称取6份1.0 g刺芫荽样品,并分别加入适量多糖标准溶液,按1.2.1方法提取刺芫荽多糖及1.2.2方法于490 nm处测定吸光度。
1.4 含量测定
分别称取3份1.0 g刺芫荽样品,按照优化后的提取工艺进行提取刺芫荽多糖及1.2.2方法于490 nm处测定吸光度。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1料液比对多糖提取率的影响
在提取时间为90 min,提取温度为80 ℃。提取次数为1次,考察不同料液比对刺芫荽多糖提取率的影响,结果见图1。当料液比在(1∶10)~(1∶30),刺芫荽多糖的提取率随着料液比的增大而不断提高,当料液比为(1∶30)~(1∶35)时,多糖提取率呈下降趋势。

图1 料液比对刺芫荽多糖的影响
2.1.2提取时间对刺芫荽多糖提取率的影响
在提取温度为80 ℃,料液比为1∶20,提取次数为1的条件下,考察不同的提取时间对刺芫荽多糖提取率的影响,结果见图2。提取时间为30~120 min时,刺芫荽多糖提取率的增加或减小幅度并不大,当提取时间为120~150 min时多糖提取率呈上升趋势,当提取时间>150 min时,多糖提取率下降。
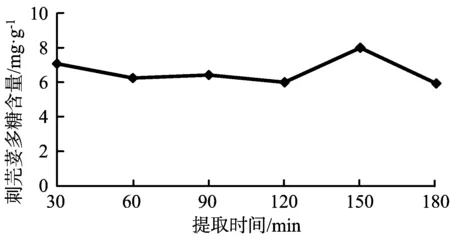
图2 提取时间对刺芫荽多糖的含量的影响
2.1.3提取温度对刺芫荽多糖提取率的影响
在提取时间为90 min,料液比为1∶20,提取次数为1的条件下,考察不同提取温度对刺芫荽多糖提取率的影响,结果见图3。提取温度为60~75 ℃时,提取率呈上升趋势,75~85 ℃时提取率下降,85~90 ℃时提取率上升。考虑到温度过高容易破坏多糖的结构,影响提取率,综合各方面因素考虑,提取的最高温度设定为90 ℃。
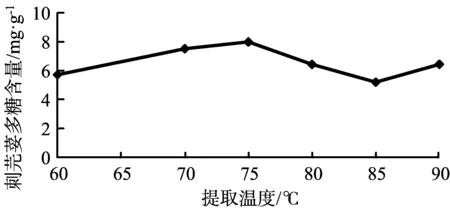
图3 提取温度对刺芫荽多糖含量的影响
2.1.4提取次数对刺芫荽多糖提取率的影响
在料液比1∶20,提取时间为90 min,提取温度为80 ℃的条件下,考察不同提取次数对刺芫荽多糖提取率的影响,结果如图4所示。由图4可知,提取2次比只提取1次的提取率要高,提取3次与提取2次相比,提取率并没有升高。

图4 提取次数对刺芫荽多糖含量的影响
2.2 正交试验优选
在单因素考察的基础上,取刺芫荽粉末1.0 g,以多糖提取率为指标,对料液比、提取时间、提取温度及提取次数进行正交试验,每个因素选3个水平,按L9(34)正交设计进行试验。选择的因素水平见表1,L9(34)正交试验设计见表2。

表1 正交试验因素水平

表2 刺芫荽多糖提取正交试验安排及结果
由表2可知,四个因素对刺芫荽多糖得率影响的主次顺序依次为:提取次数>提取时间>料液比>提取温度。刺芫荽多糖的最佳工艺组合为A1B3C3D2,即在料液比为1∶20,提取时间为150 min,提取温度为80 ℃,提取两次刺芫荽多糖的得率为12.78 mg/g。
2.3 方法学考察
2.3.1精密度试验
测得的吸光度值分别为0.269、0.270、0.269、0.268、0.268、0.267,RSD=0.39%(n=6)。表明该方法具有较高的精密度。
2.3.2稳定性试验
测得的吸光度值分别为0.267、0.275、0.271、0.273、0.269、0.264,RSD=1.49%(n=6)。结果表明该实验提取的刺芫荽多糖溶液在3 h内较为稳定。
2.3.3重复性试验
测得的吸光度值分别为0.271、0.272、0.267、0.270、0.269、0.269,RSD=0.66%(n=6),表明该方法具有较好的重复性,方法可靠。
2.3.4加样回收实验(见表3)
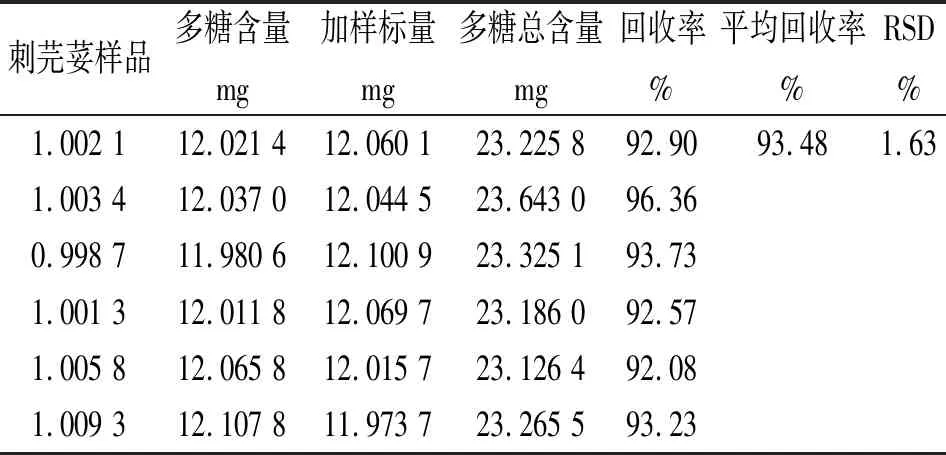
表3 加样回收实验结果
2.4 含量测定
按正交优化的提取工艺条件提取刺芫荽多糖3份样品并按1.2.2方法测定吸光度,计算刺芫荽多糖含量分别为12.83、13.34、13.18 mg/g。
3 结语
用正交法优化刺芫荽多糖的提取工艺,得到的最优提取工艺为料液比1∶20、提取时间150 min、提取温度80 ℃、提取2次,使刺芫荽多糖得到充分地提取,再经离心、浓缩、醇沉再离心等步骤得到刺芫荽多糖。按该工艺条件下多糖得率为12.78 mg/g。
采用苯酚-硫酸法对刺芫荽多糖含量进行测定,其原理是多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物。再以比色法测定,并对此测定方法进行了重复性、稳定性、精密性及加样回收率考察,考察结果令人满意,说明用苯酚-硫酸法测定多糖方法简单可行、稳定、可靠,可用于刺芫荽多糖的含量测定[5]。
