睡眠重叠综合征患者发生肺动脉高压的相关因素调查
2020-06-21范正阳王婧婷帕提古丽依司拉木孙丹册
范正阳 谢 江 李 菲 王婧婷 帕提古丽·依司拉木 孙丹册
(1.首都医科大学2016级临床医学专业,北京 100069; 2.首都医科大学附属北京安贞医院呼吸与危重症科,北京 100029)
慢性阻塞性肺疾病(以下简称慢阻肺)的病理生理学特征为不可逆的通气功能障碍,临床表现为咳嗽、咳痰、喘息和活动耐量下降,严重患者可出现缺氧和二氧化碳潴留,患者的生活质量明显降低[1]。阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)的临床特征为夜间反复出现的呼吸暂停和日间思睡,可引起间歇性低氧血症、高碳酸血症和睡眠结构紊乱[2]。慢阻肺与OSA可同时或先后发病,二者均与心肺血管疾病发生风险增加及预后不良有关[3-4],慢阻肺合并OSA的现象被称为睡眠重叠综合征(overlap syndrome,OS)[5],此类患者同时存在小气道陷闭和上气道阻塞,导致比单一病理状况下更易出现的严重夜间低氧血症,从而更容易导致肺动脉高压(pulmonary hypertension,PH)和肺源性心脏病[6]。本研究将通过实施肺功能、睡眠监测及超声心动图检测,综合分析OS患者发生PH的危险因素,旨在为发现高危患者及实施积极干预提供初步依据。
1 对象与方法
1.1 研究对象
本注册研究 (ChiCTR1900027294)通过首都医科大学附属北京安贞医院伦理委员会授权,所有参与人员均签署知情同意书。研究纳入128名于2019年1月至2020年1月在首都医科大学附属北京安贞医院呼吸与危重症医学科门诊和住院部诊疗且具有完整肺功能、超声心动图及夜间睡眠监测数据的患者作为研究对象。排除标准:①既往诊断慢阻肺或OSA,并且接受支气管扩张药、激素、气道正压、口腔矫治器等治疗;②罹患特发性肺动脉高压、结缔组织病、左心室心力衰竭;③由于各种原因超声心动图无法判断肺动脉压,如不存在三尖瓣反流等。
1.2 研究方法
1.2.1 肺功能检测
采用德国Jaeger公司的Masterscreen-PFT型肺功能仪实施肺功能检测。检查时患者取坐位,平静呼吸30 s后开始记录第一秒用力肺活量(forced expiratory volume in the first second,FEV1)和用力肺活量(forced vital capacity,FVC)等参数。慢阻肺的诊断参照《慢性阻塞性肺疾病全球倡议(2017年修订版)》[7]的标准,即吸入支气管扩张药后FEV1/FVC小于70%。
1.2.2 睡眠监测
采用E系列多导睡眠检测仪(Compumedics Ltd公司, 澳大利亚)或NOX-T3便携式睡眠监测仪(Nox Medical公司,冰岛)记录夜间10点至早晨6点睡眠呼吸事件,安装导联包括:口鼻气流、呼吸热敏、经皮指端氧饱和度、呼吸感应式胸腹运动体积描记、体位和心电图等。采用美国睡眠呼吸医学会标准[8]判读呼吸事件,计算呼吸暂停低通气指数(apnea-hypopnea index,AHI),即平均每小时睡眠中呼吸暂停和低通气的次数。AHI≥5次/h即诊断OSA;同时符合OSA和慢阻肺标准者被诊断为OS。
1.2.3 彩色多普勒超声心动图
采用美国GE公司的Vivid7-BT06型彩色多普勒超声诊断仪,根据三尖瓣瓣膜反流速率计算肺动脉收缩压(systolic pulmonary artery pressure, SPAP)。计算公式为:SPAP= 4V2(TRmax) + RAP(TRmax 指三尖瓣最大反流速度,RAP指右心房压力)。采用严格的SPAP ≥50 mmHg(1 mmHg=0.133kPa)作为PH的诊断标准[9-10]。
1.3 统计学方法
应用JMP 13完成统计分析。连续变量以中位数(P25,P75)表示,组间比较采用Kruskal-Wallis H检验。分类变量以频数(百分比)表示,组间比较采用卡方检验。采用多元逐步Logistic回归分析PH发病的独立相关因素,校正因素为年龄、性别和体质量指数(body mass index,BMI)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组患者一般情况
所有患者分为对照组(n=24)、单纯OSA组(n=81)、单纯慢阻肺组(n=9)和OS组(n=14)。表1所示为患者的基本人口学和临床特征。对照组相对年轻,BMI较低。各组性别及高血压、糖尿病、冠状动脉粥样硬化性心脏病(以下简称冠心病)和脑血管病等慢性病发生率差异无统计学意义,吸烟率相似。
2.2 患者睡眠监测指标与肺功能参数
如表2所示,OS患者与其他各组相比,睡眠监测指标和肺功能参数均较差。与单纯OSA和单纯慢阻肺患者相比,OS患者最低血氧饱和度(minimum oxygen saturation during sleep,minSaO2)(79%vs82%和90%,P<0.001)和平均血氧饱和度(average oxygen saturation during sleep,meanSaO2)(92%vs93%和95%,P<0.001)显著偏低;睡眠血氧饱和度低于90%所占整夜睡眠百分比(percentage of total sleep time with saturation <90%,T90)(11%vs6%和0%,P<0.001)、AHI(29次/hvs22次/h 和 2 次/h,P<0.001)和氧减指数(oxygen desaturation index,ODI)(30次/hvs18次/h和2次/h,P<0.001)显著偏高。各组之间左心室射血分数(left ventricular ejection fraction,LVEF)差异无统计学意义。与其他各组相比,OS组患者FEV1预计值百分比及FEV1/FVC显著偏低(P<0.001)。
2.3 PH的相关危险因素
OS组患者较单纯OSA组和单纯慢阻肺组患者SPAP稍偏高,但差异无统计学意义(31 mmHgvs30 mmHg和28 mmHg,P=0.898)。为进一步分析PH相关危险因素,以FEV1预计值(80%)、meanSaO2(93%)、minSaO2(83%)、T90(3.1%)等主要变量的中位数和AHI=15次/h(OSA分解的公认节点)分别对患者实施二分类分组,以全部128名患者为研究对象,多元逐步Logistic回归分析PH的独立相关因素。FEV1<80%预计值的患者发生PH的概率是对照患者(FEV1≥80%预计值)的2.78倍(OR2.78,95%CI1.05~7.38,P=0.040),AHI≥15次/h的患者PH发生概率是AHI<15次/h患者的3.46倍(OR3.46,95%CI1.02~11.71,P=0.046)。校正年龄、性别和BMI等混杂因素后,FEV1<80%预计值仍与PH的发生具有显著相关性(OR3.57,95%CI1.20~10.62,P=0.022)(表3)。
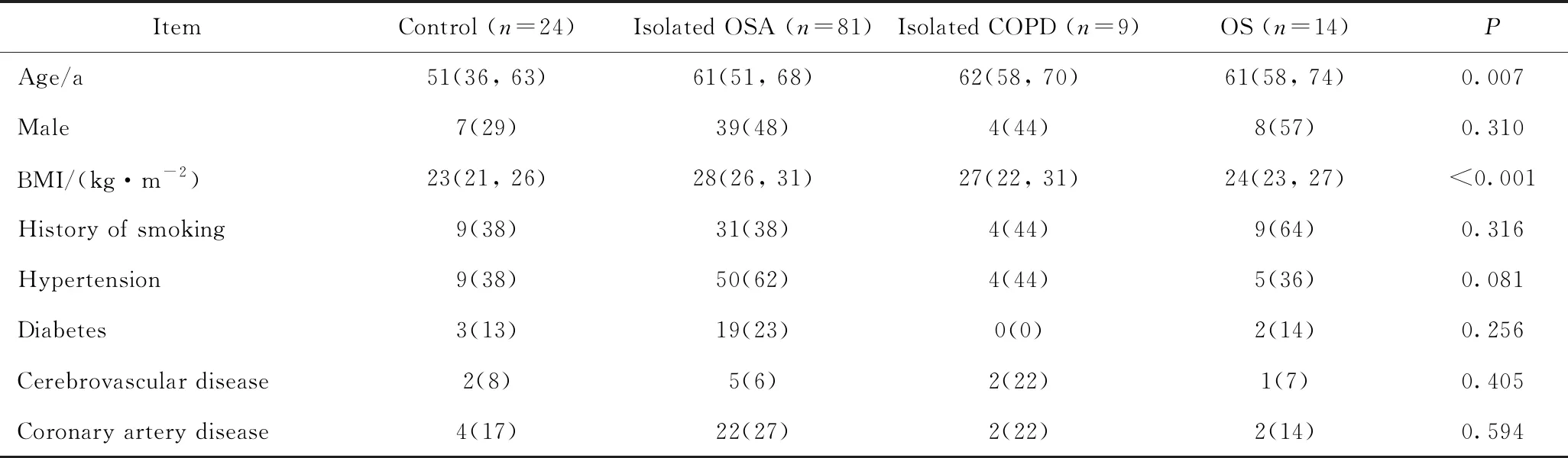
表1 各组患者的人口学及临床特征比较 Tab.1 Demographic and clinical characteristics of 128 objective patients for investigation [M(P25, P75), n(%)]
OSA: obstructive sleep apnea;COPD: chronic obstructive pulmonary disease;OS: overlap syndrome;BMI: body mass index.
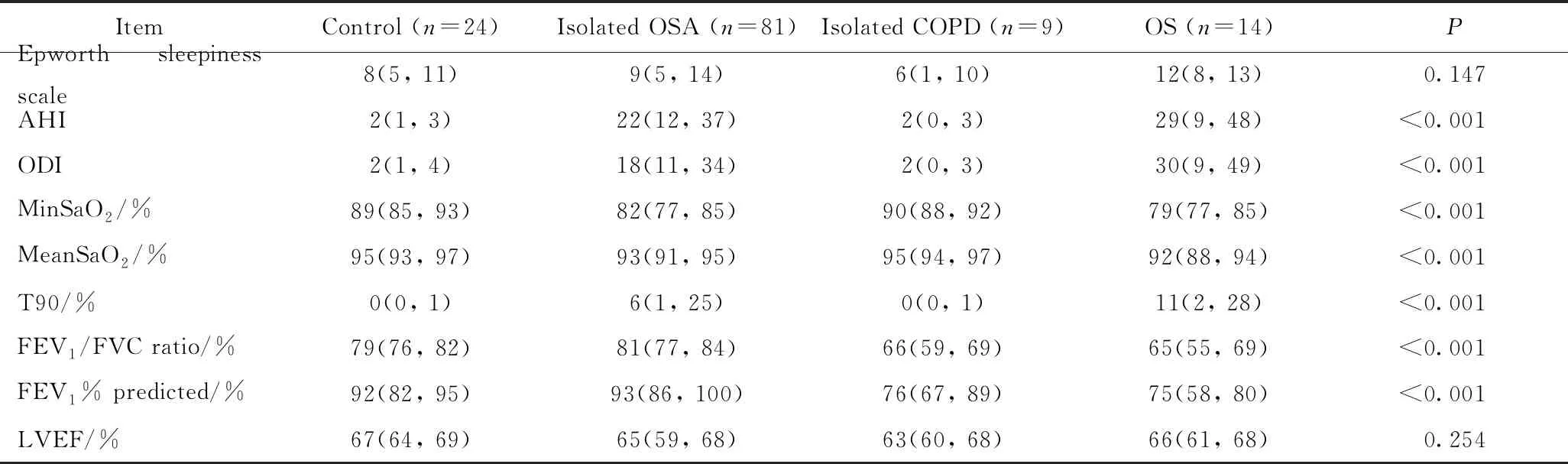
表2 各组患者的超声心动图、肺功能、睡眠监测比较
OSA: obstructive sleep apnea;COPD: chronic obstructive pulmonary disease;OS: overlap syndrome;AHI: apnea-hypopnea index;ODI: oxygen desaturation index;MinSaO2: minimum oxygen saturation during sleep;MeanSaO2: average oxygen saturation during sleep;T90: percentage of total sleep time with saturation <90%;FEV1: forced expiratory volume in the first second;FVC: forced vital capacity;LVEF: left ventricular ejection fraction.

表3 PH的独立相关因素
n=129;*Adjusting for age, sex and body mass index;△1 mmHg=0.133 kPa;PH: pulmonary hypertension;SPAP: systolic pulmonary arterial pressure;FEV1: forced expiratory volume in the first second;MeanSaO2: average oxygen saturation during sleep;AHI: apnea-hypopnea index;T90: percentage of total sleep time with saturation <90%;MinSaO2: minimum oxygen saturation during sleep.
3 讨论
本研究显示OS患者比单纯OSA和单纯慢阻肺患者存在更严重的低氧血症;在接受肺功能和睡眠监测的患者中,肺通气功能显著降低和严重的阻塞性睡眠呼吸暂停与PH的发生存在相关性。虽然在校正模型中,严重的阻塞性睡眠呼吸暂停与PH的发生无显著相关性,但鉴于严重OSA为PH发生带来的高风险,仍建议在临床工作中予新诊断的PH患者实施肺功能检查和睡眠监测,筛查PH发病的因素,为个体化治疗提供依据。
慢阻肺是最常见的慢性气道疾病之一。最新研究[11]显示,我国慢阻肺患者近1亿。肺动脉高压和肺心病是慢阻肺常见的合并症和致死原因,而缺氧可能是慢阻肺导致PH的主要病理生理学机制。缺氧刺激肺动脉内皮细胞和平滑肌细胞过度迁移、增生、凋亡,细胞外基质合成增多,血管内中膜增厚,动脉壁增厚,内径缩窄,从而导致肺动脉重构,肺血管阻力持续升高并形成PH[12-13]。与单纯的慢阻肺患者相比,OS患者常常不仅表现为持续低氧血症,并因夜间反复发生上气道阻塞导致缺氧进一步加重[14]。因此,中重度OS患者常常出现持续性并阵发加重的特殊缺氧形式。与慢性持续缺氧相比,OS患者经历更严重的缺氧负荷——更低的血氧饱和度和更长的总缺氧时间。缺氧被诸多研究者[15-16]认为是心肺血管疾病发生和影响预后的最重要因素。OSA相关低氧血症是比较容易识别、监测和干预的临床指标。在Marin等[17]的试验中,研究者给予OS患者持续正压通气,在降低了OSA所致的死亡风险后,患者的病死率和不良事件发生率与单纯慢阻肺患者水平相当。因限于研究样本量和横断面设计的原因,本研究尚不能证实低氧是PH的独立危险因素,仍需更多的前瞻性队列研究证实严重缺氧是OS患者发生PH的主要原因,而对其实施干预能降低PH的发生率和致死率。
尽管国内外指南并没有根据肺功能的严重程度对慢阻肺患者实施分区和治疗,但是肺功能却是诊断慢阻肺的金标准,也是随访患者治疗效果、评估预后、预测急性加重风险的重要指标[18]。肺功能降低的患者存在因明显气流受限造成的低氧血症,后者是PH最重要的致病因素。肺通气量下降是PH发生的独立相关因素,此为本研究的主要发现之一,并与此前诸多学者的观点相一致:有研究者[19-20]认为多种类型的PH均涉及肺功能的改变。而重度慢阻肺患者PH的发生率显著高于轻度慢阻肺人群[21]。
此外,OS患者因为存在夜间上气道阻塞,通气量进一步下降,肺功能恶化风险增加。同时,呼吸事件过程中的呼吸努力加重患者的呼吸肌疲劳,对慢阻肺恢复不利。另一方面,慢阻肺相关的高碳酸血症、液体潴留和再分布都可能加重上气道阻力,导致OSA的缺氧程度加重。总而言之,慢阻肺和OSA相互作用,降低肺通气功能,加重低氧血症。改善肺功能是治疗慢阻肺相关PH的重要手段。此前的研究[22]显示气道正压通气治疗可降低肺动脉阻力和肺动脉压,并且肺动脉压下降的程度与呼吸机的使用时长呈正相关。考虑双水平正压通气或者容量保证型通气均能在控制夜间呼吸事件基础上增加肺通气量,因此成为OS患者比较好的治疗手段。尽管有研究[23]发现气道正压治疗后肺动脉压下降,患者生活质量改善,运动耐力增加,但目前尚缺乏前瞻性研究证实正压通气能够降低PH患者的病死率。
本项目有一些缺陷限制了研究结果的推广。首先,如前所述,目前的研究仅调查了PH发病的相关性因素,需要有随访研究来证实肺功能下降和低氧血症是PH的独立危险因素,并且能够被气道正压通气等治疗方案所延缓或者逆转。其次,本研究的对照组并不是“健康人群”,而是有潜在呼吸道疾患的“患者”,因此作为对照组并不完全准确。最后,如前所述,由于研究样本量不足,无法证实OS是PH的独立危险因素。根据笔者和其他学者的研究[24],OS患者发生肺栓塞等肺血管疾病的风险要高于单纯OSA和单纯慢阻肺患者,而低氧血症既是心血管疾病的主要致病风险,也是PH等肺血管疾患的重要致病机制。
总之,OS患者存在严重的低氧血症,表现为缺氧时间长、氧减程度重,肺功能显著下降是PH发生的独立相关因素。需要有进一步的研究证实使用气道正压通气、支气管扩张药等方法改善OS患者通气功能和纠正低氧血症能够减少心肺血管疾病合并症,有利于长期预后。
