高糖对H9C2心肌细胞系和乳大鼠心室肌细胞钙库操纵性钙内流及相关蛋白的影响
2020-06-21沙勒塔娜提塔拉别克孙志朋王璐琪油红捷罗大力
沙勒塔娜提·塔拉别克 孙志朋 王璐琪 油红捷 罗大力
(首都医科大学基础医学院药理系,北京 100069)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是由糖尿病引起的以心肌结构改变和功能减退为特征,独立于冠状动脉粥样硬化性心脏病、高血压、瓣膜病变等原因的特异性心肌病[1]。比较公认的是胰岛素作用减弱(包括胰岛素减少和胰岛素抵抗)和慢性血糖升高是DCM发生发展的重要原因。能量代谢异常(包括胰岛素、血糖、血脂代谢异常)、氧化应激和线粒体损伤、肾素-血管紧张素-醛固酮系统的异常激活、交感神经和钾、钠、钙等通道电生理紊乱以及多种细胞因子的调节异常也是DCM发病的致病因素[2],但DCM的发病机制目前仍不明确,且治疗手段匮乏。近年来研究[3-4]显示钙库操纵性钙内流(store operated calcium entry,SOCE)可能参与了DCM心肌肥大发病过程,但高糖如何影响SOCE的具体机制不清。
Ca2+不仅参与肌纤维兴奋-收缩耦联过程,还是细胞内重要的第二信使,参与调节多种细胞活动。细胞外Ca2+内流的主要通道包括电压门控型钙通道(voltage gated calcium channels,VGCC)、受体门控型钙通道(receptor operated calcium channels,ROCC)和由钙库操纵的钙通道SOCE[5-6]。其中SOCE是包括心肌细胞在内的多种细胞Ca2+内流的重要通道之一,主要由基质相互作用分子1(stromal interaction molecule 1,STIM1)和钙释放激活钙通道调节分子1(calcium release-activated calcium channel modulator 1,Orai1)组成。STIM1是一种定位在肌浆网(sarcoplasmic reticulum,SR)膜上的单次跨膜蛋白,它的作用为监测SR腔中Ca2+浓度[7],Orai1则主要参与构成细胞膜上的Ca2+通道[8]。当SR腔中的Ca2+耗竭,STIM1蛋白会发生构象变化并聚集到临近细胞膜的位置与Orai1相互作用,激活SOCE,介导Ca2+内流[9-11]。SOCE参与了多种心血管系统疾病的病理生理过程。然而,高糖环境是否影响心肌SOCE介导的Ca2+内流并不清楚。因此,本实验旨在通过高糖刺激大鼠胚胎心肌细胞系(H9C2)和培养的乳大鼠心室肌细胞(neonatal rat ventricular myocytes,NRVMs),探究SOCE的变化以及可能的作用机制,为深入研究高血糖导致的心肌细胞钙信号紊乱的分子机制和糖尿病心肌病的发病原因提供新的研究基础。
1 材料与方法
1.1 材料
大鼠胚胎心肌细胞系H9C2购自中国科学院上海生命科学研究院,胎牛血清购自美国Gibco公司,DMEM和M199培养基购自美国HyClone公司,葡萄糖购自美国Gibco公司,青-链霉素混合液购自北京索莱宝公司,毒胡萝卜素(thapsigargin,TG)购自美国Sigma公司,STIM1以及Orai1单克隆抗体购自美国Santa公司,驴抗兔荧光二抗-FITC购自美国Invitrogen公司,Calnexin以及GAPDH鼠单克隆抗体购自美国Abcam公司,琼脂糖G珠购自美国Invitrogen公司,Fluo-4 AM钙离子荧光探针购自日本Dojindo研究所,胶原酶Ⅱ购自美国Worthington Biochemical公司,胰酶购自北京索莱宝公司。
1.2 SD乳大鼠心室肌细胞的分离培养与纯度鉴定
选择出生48 h内SD乳大鼠40只,用手术剪沿乳大鼠中部偏左剪开胸骨,暴露出心脏,剪下心脏,小心去除心房及心脏周围的大血管,保留心室部分,收集至10 mL血清瓶中,将组织剪碎。加入5 mL HBSS消化液[含0.1%(质量分数)胰蛋白酶和 0.03%Ⅱ型胶原酶],置恒温磁力搅拌器上,37 ℃恒温消化5 min。第一次消化结束后,用玻璃吸管吸出上清丢弃。再加入5 mL HBSS消化液,37 ℃恒温消化5 min,消化结束后用玻璃吸管将细胞悬液吸入15 mL离心管中,并在离心管中加入含10%(体积分数)胎牛血清的DMEM终止消化。在血清瓶中再加入5 mL HBSS消化液,按上述步骤依次消化,共计10次。将15 mL离心管中的细胞悬液在1 000 r/min条件下离心5 min后弃去上清,加入3 mL含10%(体积分数)胎牛血清M199完全培养基重悬细胞,用200目筛网过滤细胞悬液至100 mm细胞培养皿中,置于37 ℃,5%(体积分数)CO2培养箱中静置2 h,然后利用差速贴壁法去除优先贴壁的成纤维细胞。重新收集细胞悬液,补充M199完全培养基,并将血清含量调整至15%(体积分数),放置在培养箱中,37 ℃,5%(体积分数) CO2条件下培养。 24 h 后更换培养基,去除未贴壁的细胞。继续培养进行后续实验。
NRVMs纯度鉴定:取培养48 h的NRVMs心肌细胞,用横纹肌肌动蛋白(α-actin)单克隆抗体作为一抗进行免疫细胞化学染色。随机选取10个高倍(20×)视野计数阳性细胞及细胞总数,以阳性细胞数/细胞总数×100%≥95%作为细胞纯度合格指标。通过以上方法分离的心室肌细胞纯度均达95%以上,此外,在分离细胞培养至24 h 后可以观察到NRVMs心肌细胞成片自主搏动现象,表明本实验细胞所产生的反应是来自心肌细胞。
1.3 钙离子探针孵育心肌细胞
Fluo4-AM母液的配制:用4 μL二甲基亚砜(DMSO)溶解50μg的Fluo4-AM粉末配制成4 mmol/L的Fluo4-AM母液。-20 ℃避光密封保存。用无血清的DMEM培养基稀释Fluo4-AM 母液,配制成4 μmol/L工作液。向共聚焦皿中加入 Fluo4-AM 工作液覆盖细胞后37 ℃细胞培养箱孵育40 min。用有钙(1.8 mmol/L)台氏液(pH=7.35~7.4)轻轻浸洗细胞3次,以充分去除残留的Fluo4-AM工作液,然后加入1 mL无钙台氏液覆盖细胞备用。
将负载好荧光染料的心肌细胞放在激光共聚焦显微镜系统的载物台上,设置参数:激发波长488 nm,接收波长516 nm,40×物镜,最快速度连续扫描,所有图像在同一条件下(针孔大小、光电倍增管增益等)采集。调节焦平面位置选取合适的细胞层面,记录细胞内钙离子初始荧光强度值(F0),待细胞稳定后向共聚焦皿中轻轻加入2 μmol/L毒胡萝卜素,连续记录产生的Ca2+释放荧光强度变化值(F)。待细胞钙信号回到静息状态时,轻轻滴加1.8 mmol/L CaCl2溶液,连续记录瞬时Ca2+内流荧光强度变化值(F)至细胞恢复静息状态。以上实验均在室温条件下进行,重复3次。实验数据分析:以每个细胞Ca2+离子荧光强度变化值与Ca2+离子初始荧光强度值的比值,即F/F0作为细胞Ca2+内流或Ca2+释放的荧光强度值进行统计分析。
1.4 免疫共沉淀
在10 cm培养皿中接种2.4×107个心肌细胞,分为2组:对照组(5.5 mmol/L葡萄糖),高糖组(25 mmol/L葡萄糖),每组共3个皿。将培养皿置于37 ℃,5% (体积分数)CO2的培养箱孵育48 h后收集各组细胞,加入适量NP-40细胞裂解液,4 ℃ 摇床缓慢摇晃1 h后离心(12 000 g,15 min)取上清液。加入20 μL Protein G琼脂糖珠,4 ℃ 摇床缓慢摇晃预吸附2 h后离心去除珠子,再根据蛋白浓度加入适量STIM1抗体过夜。次日取20 μL Protein G琼脂糖珠加入到细胞裂解液中,4 ℃ 摇床缓慢摇晃孵育4 h,使抗体与Protein G琼脂糖珠充分偶联。免疫沉淀反应后,离心(200 r/min,3 min) 弃上清,用细胞裂解液轻轻清洗琼脂糖珠,再离心(200 r/min,3 min),保留琼脂糖珠沉淀,重复3次。最后向琼脂糖珠加入25 μL的1×SDS上样缓冲液,95 ℃ 5 min,进行后续SDS-PAGE电泳及Western blotting蛋白检测。实验重复3次。
1.5 化学交联
在6 cm培养皿中接种9×106个心肌细胞,分为2组:对照组(5.5 mmol/L葡萄糖),高糖组(25 mmol/L葡萄糖),每组共3个皿。将培养皿置于37 ℃,5%(体积分数) CO2的培养箱孵育48 h后用无钙台氏液轻轻清洗两遍,然后加入2 μmol/L 毒胡萝卜素刺激细胞5 min,再加入1%(质量分数)多聚甲醛室温固定蛋白质间相互作用6~8 min,最后加入0.1 mol/L甘氨酸冰浴5 min终止甲醛反应。收集细胞加入适量裂解液,超速离心(38 000 g,90 min,4℃)后去除上清,加入适量裂解液溶解蛋白沉淀进行BCA测定浓度。进行后续SDS-PAGE电泳及Western blotting蛋白检测。与普通Western blotting实验不同,该蛋白样品不经过煮沸处理。实验重复3次。
1.6 细胞免疫荧光
取细胞培养12孔板,在每个孔板内放置玻璃爬片,在每个爬片上接种5×105心肌细胞,分为2组:对照组(5.5 mmol/L葡萄糖),高糖组(25 mmol/L葡萄糖),将孔板置于37 ℃,5% (体积分数)CO2的培养箱孵育48 h。吸去培养基,台氏液轻轻浸洗细胞3次,每次5 min。向孔内加入2 μmol/L 毒胡萝卜素刺激细胞5 min,然后迅速用4%(质量分数)多聚甲醛进行细胞固定,室温20 min。吸去多聚甲醛,台氏液浸洗细胞3次。向孔内加入0.1% (体积分数)Triton X-100,室温破膜30 min,使细胞通透。除去Triton X-100,台氏液浸洗3次,每次5 min。用5%(质量分数)BSA封闭30 min。封闭后无须清洗,向每孔滴加STIM1抗体[1∶50,5%(质量分数)BSA稀释],4 ℃湿盒内孵育过夜12 h。次日,吸去一抗,台氏液浸洗细胞3次,每次5 min。向孔内滴加驴抗兔荧光二抗-FITC(绿)[1∶500,5% (质量分数)BSA稀释],室温避光孵育1 h。吸去二抗,台氏液浸洗细胞3次,每次5 min。向玻片上滴加DAPI复染细胞核,避光室温孵育10 min。台氏液浸洗细胞,用镊子轻轻取出爬片,用抗荧光淬灭剂封片,将爬片反过来贴于载玻片上,然后在荧光显微镜下观察并采集图像。为了分析STIM1 puncta结构的变化,首先按照相同的成像数据采集各组荧光图像,然后通过Image J软件对puncta面积进行计算。其中将面积>0.5 μm2的颗粒物定义为puncta,每组随机选取30~40个细胞作为统计样本,实验重复3次。
1.7 统计学方法
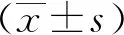
2 结果
2.1 高糖对H9C2和NRVMs心肌细胞SOCE功能的影响
与对照组相比,高糖组H9C2(图1A)以及NRVMs (图1B)心肌细胞的钙库排空能力差异均无统计学意义(P>0.05),但加入CaCl2溶液1.8 mmol/L后,高糖组H9C2产生的Ca2+内流强度高于对照组(P<0.05,图1A), 高糖组NRVMs产生的Ca2+内流强度也增高(P<0.01,图1B)。不同组别各选取30~40个状态良好的心肌细胞进行Ca2+信号实时记录并统计,以n=30~40细胞表示,每个组别实验均重复3次。

图1 激光共聚焦显微镜检测高糖对H9C2和NRVMs心肌细胞SOCE的影响
2.2 高糖对H9C2和NRVMs心肌细胞中SOCE相关蛋白表达的影响
与对照组相比,高糖培养的H9C2(图2A)和NRVMs(图2B)心肌细胞STIM1蛋白表达均明显增加 (P<0.01),且在H9C2全细胞蛋白中Orai1的表达量也升高(P<0.05)。提示高糖上调H9C2和NRVMs心肌细胞SOCE相关蛋白(STIM1和Orai1)表达,各组实验均重复3次。

图2 Western blotting检测高糖对H9C2和NRVMs心肌细胞STIM1和Orai1蛋白表达的影响
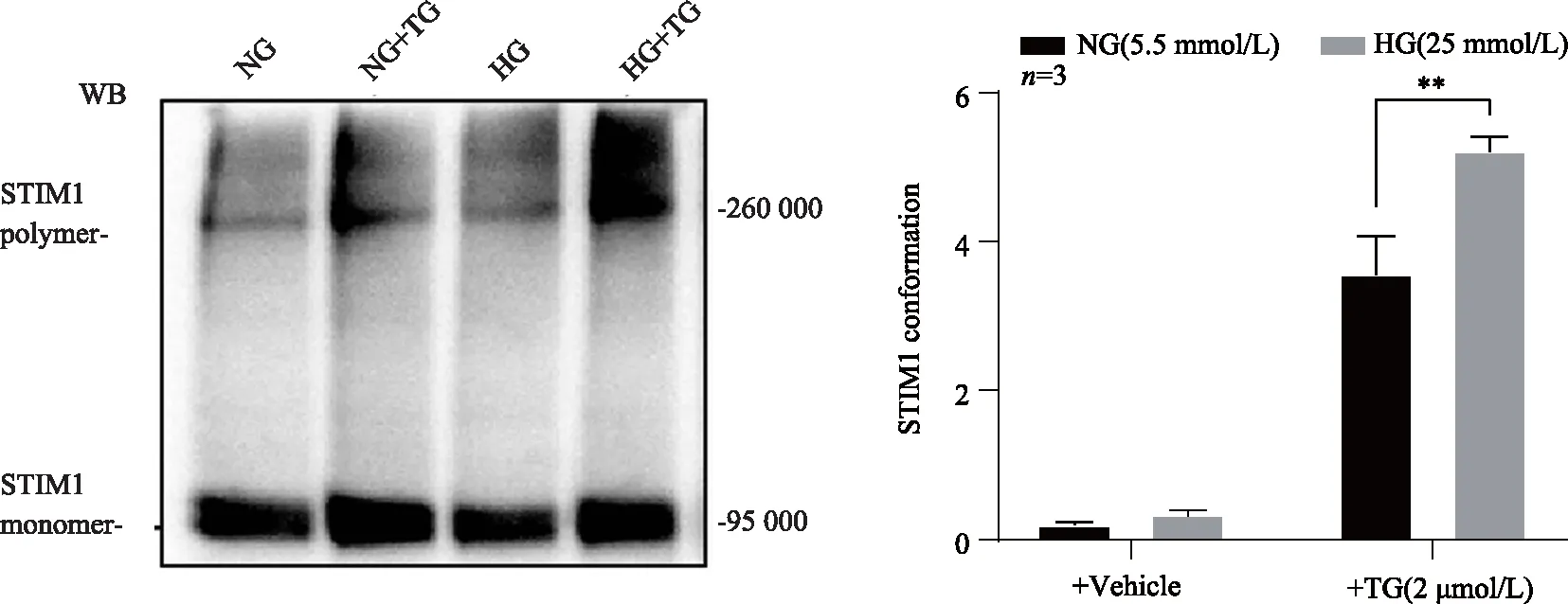
图3 化学交联法检测高糖对NRVMs 心肌细胞STIM1蛋白聚集体形成的影响
2.3 高糖对NRVMs心肌细胞STIM1蛋白聚集化的影响
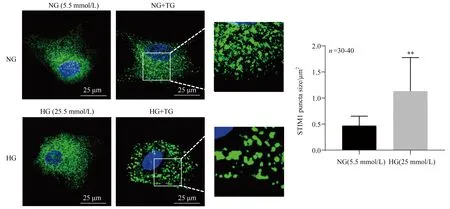
图4 免疫荧光染色观察高糖对NRVMs细胞STIM1蛋白聚集体形成的影响
在没有经TG刺激时,两组心肌细胞SR蛋白抽提物中STIM1聚集体(STIM1 polymers)无明显差异;接下来,经TG刺激排空钙库后,与对照组相比,高糖组STIM1蛋白高分子量聚集体(约260 000以上)显著增多(图3),差异有统计学意义(P<0.01)。为了进一步验证上述蛋白交联结果,对两组NRVMs心肌细胞STIM1蛋白进行免疫荧光检测。结果显示,在静息状态下,对照组和高糖组细胞STIM1蛋白荧光染色差异无统计学意义(P>0.05);但经TG刺激排空钙库后,高糖组细胞STIM1形成的斑点状蛋白聚集体结构(puncta)与对照组明显不同(图4)。结果显示,与对照组相比,高糖组细胞STIM1 puncta的单个面积显著增大,差异有统计学意义(P<0.01),且可见形成的puncta远离核周,朝胞膜方向位移。提示钙库排空后高糖过度促进STIM1蛋白激活形成聚集体。
图5 免疫共沉淀法检测正常糖和高糖条件下NRVMs中内源性STIM1与Orai1蛋白的相互作用
2.4 高糖对NRVMs心肌细胞中STIM1与Orai1相互作用的影响
与STIM1免疫共沉淀的蛋白复合物中可检测到Orai1单体(约34 000)和聚集体(约160 000),说明经药物刺激后心肌细胞内STIM1与Orai1蛋白确实存在相互作用,但对照组与高糖组间这两种蛋白相互作用情况并无明显差异(图5)。提示高糖异常激活SOCE的机制可能不是通过促进STIM1和Orai1直接相互作用。
3 讨论
STIM1和Orai1是构成 SOCE的重要蛋白分子。STIM家族由两种蛋白亚型组成:STIM1和STIM2,在研究[12]显示STIM1是定位于SR膜上的单次跨膜蛋白,具有监测SR腔内Ca2+浓度的传感作用。其NH2末端位于SR腔内,包括典型的EF-hand结构域 (canonical EF-hand domain,cEF)、非Ca2+结合EF-hand结构域 (non-Ca2+binding hidden EF-hand domain,hEF) 和α卷曲模体结构域(sterile alpha motif domain,SAM)[13-14]。虽然Ca2+只与cEF结构域结合,但是hEF-hand-SAM结构域的稳定性对Ca2+传感作用非常重要。在静息状态下,Ca2+与STIM1的cEF-hand结合,STIM1通过螺旋结构域间的相互作用形成二聚体[15]。当SR Ca2+存储减少时,Ca2+从STIM1的cEF结构域脱离,导致hEF-hand-SAM复合物中的疏水残基暴露,启动STIM1聚集反应[16]。然而与STIM1相比,STIM2具有明显不同的NH2末端区域[17],STIM2在SOCE调节中的作用目前尚不清楚。Orai家族成员包含三个高度保守的同系物:Orai1,Orai2和 Orai3,其中Orai1是位于细胞膜上包含四个跨膜结构域的通道蛋白[18],是最重要的SOCE效应蛋白。已知Orai1在静息条件下以均二聚体或四聚体形式存在[19]。激活后,形成六聚体[20]并介导钙释放激活的钙离子通道(calciumrelease-activated calcium,CRAC)开放。当SR充盈时,STIM1与Ca2+结合并散在分布于SR膜上。一旦SR内Ca2+排空,STIM1发生构象变化,迅速寡聚化并迁移到与质膜紧密靠近的区域形成斑点状puncta结构。STIM1的重新定位触发Orai1向SR-PM接触位点的募集,最终通过STIM1与Orai1相互作用,激活SOCE,介导Ca2+内流[21-26]。
研究[27-30]表明,SOCE功能障碍与心肌疾病的发生发展有密切联系。与非兴奋细胞一样,乳大鼠心室肌细胞能够对肌浆网Ca2+储备的耗竭做出反应,通过不同于VGCC的通道引起细胞外Ca2+内流,这种途径已被证明是SOCE[31]。Voelkers等[32]也证实了乳大鼠心肌细胞中有STIM1和Orai1蛋白表达以及SOCE介导的Ca2+内流参与心肌细胞病变过程;Ohba等[33]发现敲除STIM1能够抑制NRVMs中SOCE效应。上述研究表明,心肌细胞存在SOCE途径及其效应蛋白STIM1和Orai1可以调控这种Ca2+内流通道。在此基础上,已有研究[34]显示高糖可以引起心肌细胞损伤,其机制可能是高糖增加细胞内Ca2+浓度,引起Ca2+超载。有研究[35]表明,体外高糖环境可抑制H9C2心肌细胞增生,上调STIM1、Orai1及瞬时受体电位阳离子通道蛋白(transient receptor potential cation channel,TRPC1)的表达,提示高糖诱导的H9C2心肌损伤中有SOCE的参与;相反地,Pang等[36]在5.5 mmol/L葡萄糖条件下培养NRVMs,加入TG后胞质Ca2+浓度立即升高,而在30 mmol/L 高糖中培养20 h后NRVMs对TG刺激的反应减弱,表明高糖降低了NRVMs由血管紧张素II(angiotensin II,Ang II)或TG诱导的SOCE。此外,Correll等[37]发现,STIM1过表达的心肌细胞SOCE增强,且小鼠早在6周龄就表现出心脏性猝死,而存活超过12周的小鼠则出现心力衰竭伴肥大,胎儿基因程序启动,组织病理学和线粒体结构改变,心室功能丧失和肺水肿。与此同时,近期有项研究[38]表明,主动脉弓缩窄术(transverse aortic constriction,TAC)诱导的小鼠表现出心肌细胞肥大,SOCE过度激活,但在突变Orai1的R91W16位点后,SOCE趋于正常。以上研究结果说明,SOCE功能障碍以及STIM1、Orai1表达改变均可能诱发心肌细胞钙信号紊乱,然而在高糖条件下心肌细胞SOCE的变化比较矛盾,其机制也尚不清楚。
心肌细胞功能障碍既是心肌病变的始动原因,也是促进疾病发展的重要因素,而且高血糖以心肌细胞为靶点,损害心脏的机械性能[39]。因此,保护心肌细胞对维护心脏健康有重要意义。糖尿病患者合并心血管疾病的发病率较非糖尿病者明显增高,为正常者的约2.5倍,其致病机制与离子通道密切相关[40]。近年的研究[41]证实,糖尿病患者在慢性发展过程中心肌细胞内静息Ca2+升高,心脏收缩舒张功能受损,其中涉及的Ca2+超载机制复杂。笔者以高糖对心肌细胞Ca2+内流的影响作为出发点,从细胞功能变化到分子层面的内在机制进行探究。TG是一种肌浆网钙泵(Ca2+-ATPase)的抑制剂,可促进细胞内钙库排空及诱导SOCE。在本研究中,对照组H9C2心肌细胞和NRVMs与高糖组两种细胞的钙库排空能力(Ca2+release)均差异无统计学意义,说明高糖可能没有改变肌浆网内Ca2+含量。但高糖组两种心肌细胞由SOCE介导的Ca2+内流强度均显著高于对照组。另外,根据Western blotting结果可知,在H9C2心肌细胞及NRVMs中构成SOCE的两种主要蛋白STIM1及Orai1均有表达,这与之前的研究[32-33]一致,且用高糖培养以上两种心肌细胞48 h后,STIM1及Orai1的表达明显上调。已知钙库排空能够诱发肌浆网膜上STIM1蛋白变构激活发生聚集反应,形成斑点状蛋白聚体体结构(puncta)[42-43],在本实验中发现高糖可以促进STIM1蛋白的这种激活反应,形成更丰富的聚集体,而这种现象有助于激活质膜上的Orai1钙离子通道,过度开放SOCE,这与笔者在检测Ca2+信号时看到的高糖增强Ca2+内流的结果相一致。为了进一步验证高糖对心肌细胞SOCE的影响,笔者用免疫共沉淀实验对NRVMs心肌细胞内源性STIM1及Orai1的相互作用进行检测,发现对照组与高糖组STIM1免疫沉淀的Orai1单体及类聚集体并无明显差异。根据以上实验结果,笔者猜测:等同的时间与空间里,在充足外Ca2+环境下,高糖组心肌细胞SOCE介导的Ca2+内流显著增多,是由于高糖诱导STIM1和Orai1蛋白表达上调,使单位时间内SOCE启动所需的开放通道增多,而不是通过增强STIM1与Orai1之间的相互作用,然而这一猜想有待后续研究。
糖尿病是世界范围内最常见的慢性病之一。这文重点关注的是糖尿病患者中一种特殊的心脏合并症——糖尿病性心肌病变。本文首先探究了高糖对心肌细胞SOCE功能的影响。接下来,重点放在高糖如何改变心肌细胞的SOCE,并发现是通过上调组成SOCE的蛋白表达,同时促进STIM1蛋白变构聚集,从而诱导SOCE异常激活,增加Ca2+内流,这可能是糖尿病导致的心肌细胞钙信号紊乱的机制之一,为SOCE参与糖尿病心肌疾病的发病机制提供了新的依据。
