影响肝门部胆管癌术后远期预后的因素
2020-06-21李先亮
曹 迪 李先亮 张 荟 贺 强*
(1. 首都医科大学附属北京朝阳医院肝胆胰脾外科 北京市器官移植中心,北京 100020;2.河北燕达医院普通外科,河北廊坊 065201)
肝门部胆管癌是胆道肿瘤中最多见又最难处理的胆管与肝脏结合部的肿瘤。因为其解剖位置特殊、易侵犯周围组织结构,根治性手术切除率不高,多种因素导致其预后较差。现针对肝门部胆管癌患者进行分析,探讨多种因素对其远期预后的影响。
1 对象与方法
1.1 研究对象
以2011年1月至2017年12月首都医科大学附属北京朝阳医院肝胆外科诊治的49例肝门部胆管癌患者为研究对象,其中男性患者25 例,女性患者24 例,年龄45~90岁,平均年龄(67.6±10)岁。主诉为无痛性黄疸37例,消化系统症状(厌食、反酸等)12例。
1.2 纳入、排除标准
纳入标准:①术前临床诊断考虑为肝门部胆管癌;②北京朝阳医院行手术治疗[根治性手术(R0切除)或姑息性手术(R1切除)];③术后病理证实为肝门部胆管癌;④所有治疗策略均得到患者或家属的同意,未涉及伦理问题。
排除标准:①术前有严重心、脑血管或内分泌、代谢性疾病;②术前影像学评估无法行手术治疗。
1.3 术前检查
患者术前行实验室检查,包括血常规、凝血功能、肝功能及生化指标,如总胆红素(total bilirubin, TB)、直接胆红素(direct bilirubin, DB)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)等;肿瘤标志物为癌胚抗原(carcino-embryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)、甲胎蛋白(alpha fetal protein,AFP)等;影像学检查包括腹部增强电子计算机断层扫描(computed tomography, CT)或腹部磁共振成像(magnetic resonance imaging,MRI)。
1.4 手术方案
根据实验室检查、术前影像学检查及术中冰冻病理结果、患者手术耐受能力,确定最终手术切除范围及方案;具体包括:Ⅰ、Ⅱ型计划行标准肝门部胆管癌根治+胆肠吻合术;Ⅲ型患者计划行扩大肝门部胆管癌根治(联合半肝切除)+胆肠吻合术;Ⅳ型计划行姑息性肿物切除+胆肠吻合术。
1.5 随访观察
患者术后均采用门诊复查、电话随访等方式给予回访。随访时间自手术日至死亡或最近一次随访,随访截止日期为2017年12月,随访内容包括血常规、生化指标及腹部CT、MRI检查等。
1.6 观察指标
(1)临床表现及辅助检查结果;(2)治疗方案及病理学检查结果;(3)围术期合并症发生情况;(4)随访和生存情况;(5)预后因素分析:性别、年龄、术前最高TB、术前是否行经皮肝穿刺胆管引流(percutaneous transhepatic cholangic drainage,PTCD)、术前AST、ALT、CA19-9、Bismuth-Corlette分型、术中一般资料(手术时间、出血量、是否输血)、病理情况(切缘情况、分化程度、肿瘤大小、淋巴结转移、血管侵犯、神经侵犯)及术后有无化疗等。
1.7 统计学方法
采用SPSS 25.0软件进行统计学分析。生存率比较采用Log-Rank检验。多因素分析采用COX比例风险模型。以P<0.05为差异有统计学意义。
2 结果
2.1 围术期情况
本组49例患者均顺利出院,围术期无死亡患者;5例患者围术期出现合并症,发生率10%;其中发生胆漏3例,发生率6.1%;消化道出血、腹腔感染各1例。
2.2 随访结果
截至2017年12月,49例患者均获得随访,随访时间为l~83个月。随访期内,29例患者死亡,其中19例死于肿瘤复发、转移或肿瘤进展,2例死于消化道出血,2例死于肺部感染,1例死于胆管炎致败血症,5例具体死亡原因不明。49例患者中位生存时间为29个月,术后1、3、5年生存率分别为87.3%、30.8%、6.2%,生存曲线详见图1。
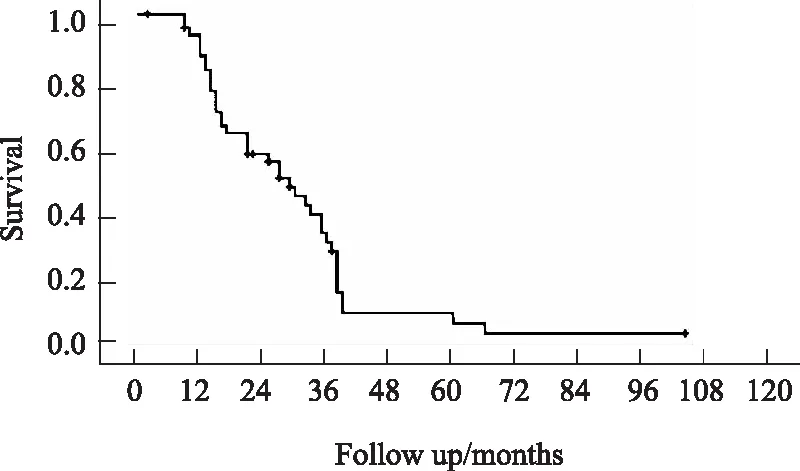
图1 肝门部胆管癌患者总体生存曲线
2.3 影响肝门部胆管癌预后的单因素分析
将患者的术前资料(性别、年龄、术前TB、AST、ALT、CA19-9、Bismuth-Corlette以及术前是否行PTCD),术中情况(手术时间、出血量、是否输血),病理情况(切缘情况、分化程度、肿瘤最大直径、血管侵犯、神经侵犯、淋巴结转移),术后情况(有无化疗等)共18项临床资料纳入单因素分析,经Log-Rank检验可知:术前是否行PTCD、病理分化程度、肿瘤大小、神经侵犯是可能影响预后的危险因素,详见表1。
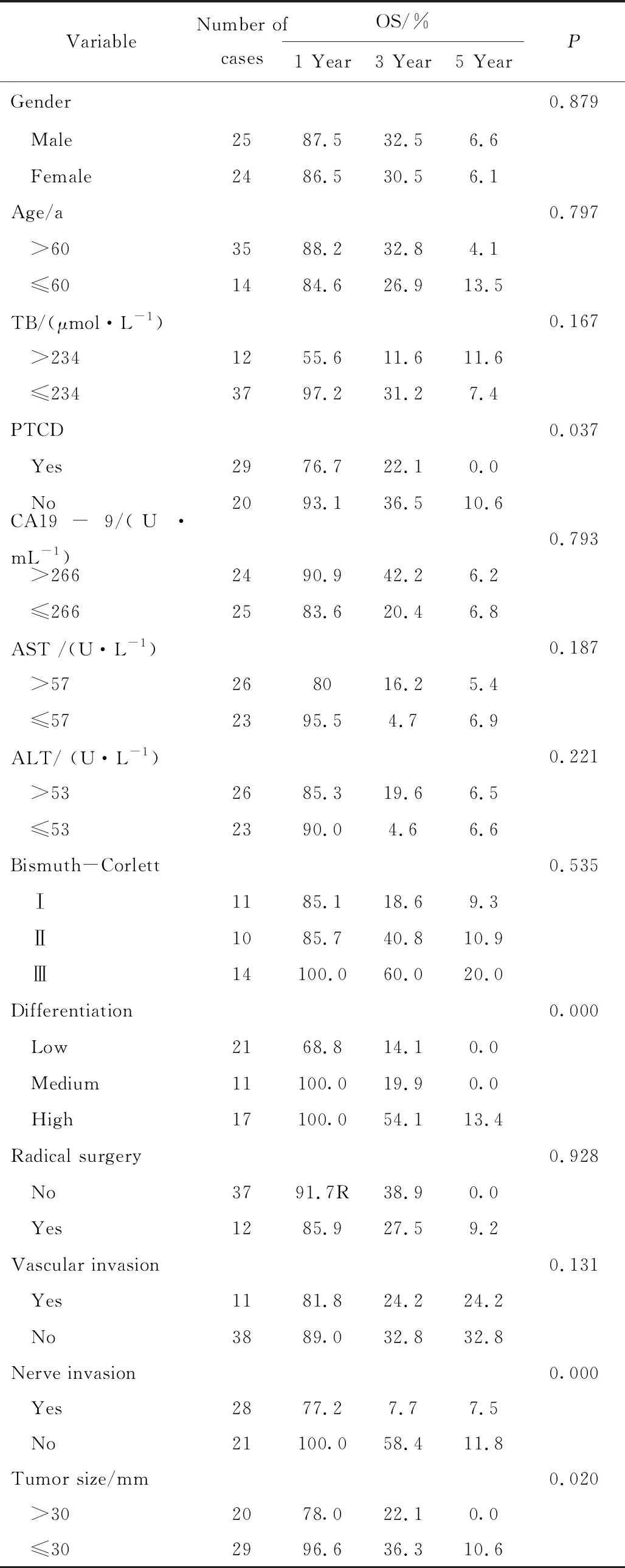
表1 影响肝门部胆管癌预后的单因素分析

续表1
OS: overall survival;TB: total bilirubin;PTCD: percutaneous transhepatic cholangic drainage;CA19-9: carbohydrate antigen 19-9;AST: aspartate aminotransferase;ALT: alanine aminotransferase.
2.4 影响肝门部胆管癌预后的多因素分析
将患者神经侵犯、病理分化程度、肿瘤大小、术前是否行PTCD等4项影响预后的危险因素纳入COX比例风险模型进行多因素分析,结果显示:有无神经侵犯和病理分化程度是影响行手术切除的肝门部胆管癌患者预后不良的独立危险因素(P<0.05),详见表2。
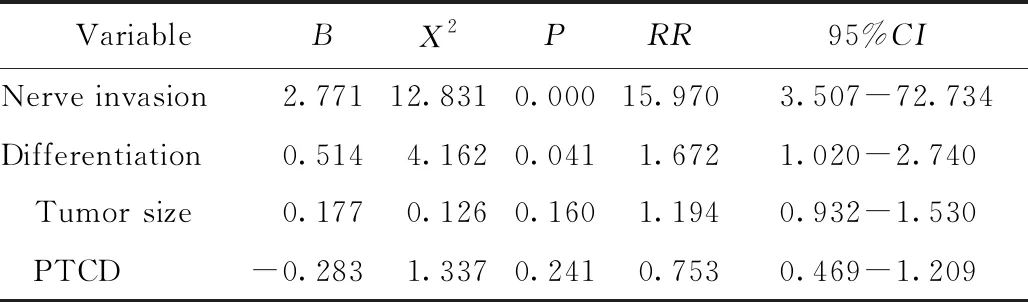
表2 影响肝门部胆管癌行手术切除的患者预后的多因素分析
PTCD: percutaneous transhepatic cholangic drainage.
3 讨论
肝门部胆管癌是指发生于左、右肝管以及肝总管的恶性肿瘤,约占胆管恶性肿瘤的40%~60%,也称为高位胆管癌、近端胆管癌或Klatskin肿瘤[1-2],是胆道肿瘤中最多见又最难处理的胆管与肝脏结合部的肿瘤。其解剖位置特殊、周围结构复杂,并且因其浸润性生长的特性易侵犯肝动脉及门静脉。
目前手术切除是治疗肝门部胆管癌的首选治疗方法[1],其手术方式的选择主要取决于癌肿局部浸润范围及Bismuth分型。因为其特殊的解剖关系及生物学特征,根治性手术切除率不高[3-4]且预后较差,总体5年存活率<40%[5]。2017年,隋鑫磊等[6]报道了湘雅医院296例肝门部胆管癌患者的中位生存期为10个月,1、3、5年生存率为47.1%、20.2%和9.5%;王孟龙等[7]报道其中心肝门部胆管癌患者术后中位生存期为16个月;Sharma等[8]报道Mayo医院肝门部胆管癌患者中位生存期为7个月,1年和5年生存率分别为41%和10.4%,与本组患者资料基本一致。重要的预后危险因素会影响术后的整体治疗方案,因此值得进一步探讨。
本组资料提示,肿瘤分化程度是影响肝门部胆管癌预后的独立危险因素,这个研究因素得到很多中心的数据支持,是一个值得重视的因素,但是在目前肿瘤治疗中,单纯的分化程度,并不会很好的指导术后整体综合治疗选择。肿瘤分化程度[9]反映了肿瘤的生物学特性,也反映了肿瘤生长、增生的状况,分化程度低的肿瘤细胞更容易侵犯周围的脉管和组织,转移更早,因此预后更差。徐力善等[10]提出胆管癌分化程度越差,浸润及转移的特征越明显,与临床远期疗效的观察结果相吻合。Matsuo等[11]曾研究120例肝门部胆管癌R0术后患者预后情况,其中高分化患者远期预后优于中低分化患者,是独立危险因素之一,与本组研究结果相同。
笔者的研究显示,神经侵犯是影响患者术后预后的独立危险因素,神经侵犯的患者预后明显更差。通过神经周围侵犯和转移是胆管癌的一种重要病理特征[12],指肿瘤细胞包绕神经纤维,并进入神经束膜内,沿其扩展、局部浸润的转移现象。肝门部脉管结构紧密,肿瘤非常容易侵犯动静脉,因此会早期出现神经侵犯情况。但是目前,神经侵犯尚未被广泛认可为肿瘤的转移途径,因此该因素对预后的影响值得进一步探讨。有研究[13]显示,神经浸润发生的频率与肿瘤浸润的深度呈明显的相关性。Beal等[14]报道其所在医疗中心治疗225例患者的经验,得出与本中心相同的结论,并提出神经侵犯的患者更容易出现肿瘤的转移以及术后复发。郑秀海等[15]的生物试验结果提示,胆管癌肿瘤细胞对神经纤维有亲嗜性。肝十二指肠韧带内有恒定的粗大神经分布,肿瘤侵犯神经主要发生在胆管与肝动脉间的神经丛,因此肝门部胆管癌根治术中,对肝十二指肠韧带及一、二级胆管所在的Glisson鞘“骨骼化”时,要求仔细剥除胆管与肝动脉和门静脉间的神经纤维组织。这也是对手术医生提出的值得重视的关键点。
综上所述,肝门部胆管癌患者的整体预后较差,分化程度低、神经侵犯是患者术后预后不良的独立危险因素。外科医生应更加彻底地骨骼化肝十二指肠韧带,术后针对这类患者的局部和整体的相关治疗也需要积极考虑。
