载脂蛋白C3转基因小鼠应用于严重高三酰甘油血症急性胰腺炎的探索
2020-06-21徐有青崔纯莹赵志刚
柳 鑫 徐有青 崔纯莹 赵志刚*
(1. 首都医科大学附属北京天坛医院药学部,北京 100070; 2. 首都医科大学附属北京天坛医院消化内科,北京 100070;3.首都医科大学药学院药剂学系,北京 100069)
急性胰腺炎是由于胰蛋白酶原过度激活,胰蛋白酶生成增加,引起胰腺自我消化的一种急性炎性反应[1]。流行病学调查研究[2]显示,继胆道疾病与乙醇中毒因素外,严重高三酰甘油(triglyceride,TG)血症已成为急性胰腺炎的第三发病因素。严重高三酰甘油血症急性胰腺炎的发病机制尚不明确,主要原因在于缺少合适的严重高三酰甘油血症动物模型[3-5]。
通过高脂饮食诱导动物,血浆三酰甘油浓度只能增加2~3倍,采用腹腔注射TritonWR1339抑制脂蛋白脂酶(lipoprotein lipase,LPL)活性,可使血浆三酰甘油浓度增加5~10倍,但是急性效应较短暂,且对动物应激状态影响很大。早期有使用LPL基因敲除小鼠探讨严重高三酰甘油血症-急性胰腺炎易感性的报道[4],但由于LPL基因敲除小鼠的新生期致死性,救治存活率极低,该模型应用于严重高三酰甘油血症-急性胰腺炎的病理机制研究非常困难,经济成本也很高。为了探索严重高三酰甘油血症-急性胰腺炎的病理机制,需要使用易于繁殖的严重高三酰甘油血症小鼠模型。
载脂蛋白C3(apolipoprotein C3,ApoC3)是由肝脏和小肠合成的一种载脂蛋白,ApoC3除了能够抑制LPL水解三酰甘油,还能抑制肝脏摄取乳糜微粒、极低密度脂蛋白(very low density lipoprotein,VLDL)及其残体脂蛋白,引起血浆三酰甘油浓度升高[1]。在三酰甘油代谢中,过表达ApoC3基因,能够引起血浆三酰甘油浓度极度升高。ApoC3基因发生突变后,可导致血浆三酰甘油浓度降低,与动脉粥样硬化心血管风险下降有直接相关性[6-7]。
为了验证过表达人ApoC3基因的严重高三酰甘油血症小鼠是否也发生急性胰腺炎,使用人ApoC3转基因(ApoC3 transgenic,ApoC3tg)的小鼠模型,使用雨蛙素(caerulein)诱导急性胰腺炎后,与野生型小鼠比较,ApoC3tg小鼠表现出严重高三酰甘油血症,胰腺病理损伤加重,使用抗氧化剂叔丁基-特丁基对苯二酚(tertiary-butylhydroquinone, tBHQ)预防性给药,并不能使胰腺病理损伤得到改善。
1 材料与方法
1.1 试剂
Caerulein购自美国Sigma公司,tBHQ由北京大学药学院余四旺老师赠送,生物化学检测试剂盒(淀粉酶活性试剂盒、三酰甘油试剂盒、总胆固醇试剂盒与血糖试剂盒)均购自北京中生北控生物科技公司。
1.2 小鼠分组与基因型鉴定
ApoC3tg小鼠由美国Jackson实验室提供,采用同窝对照野生型小鼠。所用小鼠均为C57BL/6J背景下8周龄雄性小鼠(LA2010-059),实验分为两组:野生型(wild type,WT)、ApoC3tg小鼠,每组6只,提取鼠尾DNA,采用PCR鉴定基因型。所采用的引物详见表1。

表1 基因型鉴定的引物序列
ApoC3tg: apolipoprotein C3 transgenic.
1.3 血脂测定
自小鼠眶静脉采血,取上层血浆,利用生物化学检测试剂盒测定野生型小鼠与ApoC3tg小鼠的血浆TG、总胆固醇(total cholesterol,TC)和血糖(glucose,Glu)。
1.4 急性胰腺炎诱导
每组小鼠自由饮水,禁食12 h,采用雨蛙素(caerulein)诱导胰腺炎,按50 μg/kg腹腔注射给药,1次/h,连续注射7次,第一次腹腔注射24 h 后处死小鼠,心脏灌流,提取胰腺组织,用于病理学分析。
1.5 血浆淀粉酶活性检测
肝素抗凝后眶静脉采血,4 °C,12 000 r/min,离心60 min,吸取3 μL下层澄清液体,加入96孔板中,吸取100 μL淀粉酶工作液,37 °C恒温孵育3 min,按多点法设置酶标仪参数,在605 nm波长处读取1、2、3 min 末的A值,血浆淀粉酶活性(U/L)=[A(3 min)-A(1 min)]/2×3 245×稀释倍数,当[A(3 min)-A(1 min)]/2>0.3时,用ddH2O稀释样品后测定。
1.6 胰腺组织染色与病理评估
胰腺组织在25%~100%(体积分数)乙醇中,分别浸泡10 min,脱水,采用二甲苯浸泡至组织透明,加入熔化好的石蜡,60 ℃下保温30 min,石蜡切片厚度为6 μm,采用二甲苯脱蜡,无水乙醇洗脱二甲苯,分别使用苏木精与伊红染色1 min,二甲苯洗脱处理后,中性树胶封片,采集图像,进行胰腺组织病理学评分,炎性细胞数量取10个,400×放大视野的平均值,实质细胞坏死与空泡化水平以腺泡细胞坏死和空泡百分比来衡量(表2)。
1.7 抗氧化剂tBHQ对ApoC3tg小鼠淀粉酶活性与胰腺病理损伤的影响
为了观察氧化应激在严重高三酰甘油血症-急性胰腺炎中的作用,ApoC3tg小鼠灌胃给予不同剂量抗氧化药物tBHQ,对照组给予空白溶剂聚乙二醇,7 d后采用上述方法诱导急性胰腺炎。

表2 胰腺组织病理评分标准

图2 ApoC3tg小鼠血浆脂质浓度升高
1.8 统计学方法
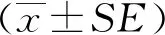
2 结果
2.1 ApoC3tg小鼠血脂升高
ApoC3tg小鼠基因鉴定如图1所示,与野生小鼠相比,ApoC3tg小鼠体质量与血糖浓度差异无统计学意义(图2A、B),血浆三酰甘油明显升高(图2C),总胆固醇含量伴随三酰甘油升高而升高(图2D)。

图1 ApoC3基因型小鼠在60 bp处有明亮条带
2.2 ApoC3tg小鼠血浆淀粉酶活性在9 h与12 h时明显升高
ApoC3tg小鼠与野生型小鼠的血浆淀粉酶活性,随时间发生显著变化(F=28.576,P=0.001),在诱导胰腺炎后9 h与12 h时明显升高,两组之间的血浆淀粉酶活性差异没有统计学意义(F=0.001,P=0.979),详见图3。

图3 不同时间点下的血浆淀粉酶活性变化
2.3 ApoC3tg小鼠胰腺病理损伤加重
与野生型小鼠相比,ApoC3tg小鼠胰腺组织水肿加重,小叶间与内部间隙增宽,结构紊乱,小叶间有大量炎性细胞浸润(图4),分别对胰腺组织水肿与炎细胞浸润指标进行病理学评分(表3),ApoC3tg小鼠胰腺组织的病理评分显著高于野生小鼠,表明ApoC3tg小鼠的胰腺炎性反应加重,对雨蛙素诱导的急性胰腺炎更加敏感。

图4 ApoC3转基因小鼠胰腺病理损伤显著加重
2.4 抗氧化剂tBHQ没有改变ApoC3tg小鼠的血浆淀粉酶活性与胰腺病理
随着时间变化,血浆淀粉酶活性发生明显改变(F=45.120,P=0.001),分组之间差异没有统计学意义(F=2.050,P=0.185)(图5)。
胰腺组织病理切片HE染色结果(图6)显示,与对照组小鼠相比,低、中或高剂量的tBHQ均未见胰腺病理损伤得到改善,对胰腺组织水肿与炎细胞浸润指标进行病理评分(表4),tBHQ 50、 100、 200 mg/kg给药组ApoC3tg小鼠的胰腺组织水肿没有减轻,小叶间与内部间隙没有缩小,小叶间炎性细胞浸润没有减轻。
表3 ApoC3tg小鼠胰腺组织病理学评分


GroupWTApoC3tgtPEdema2.8±0.845.4±1.52*2.7460.025Inflammatory infiltration2.6±0.554.6±1.14*4.1740.033
*P<0.05vsWT;WT: wild type;ApoC3tg: apolipoprotein C3 transgenic;n=6.

图5 不同剂量抗氧化药物tBHQ对ApoC3转基因小鼠血浆淀粉酶活性的影响

图6 不同剂量抗氧化药物tBHQ没有改善ApoC3tg小鼠的胰腺损伤

表4 tBHQ用药后ApoC3tg小鼠胰腺组织病理评分
n=6;tBHQ: terbiary-butylhydroquinone;ApoC3tg: apolipoprotein C3 transgenic.
3 讨论
本研究显示,ApoC3转基因小鼠血浆三酰甘油浓度明显升高,使用雨蛙素诱导急性胰腺炎后,血浆淀粉酶活性在9 h与12 h均升高,胰腺病理损伤加重,具体表现为水肿加重,小叶间与内部间隙增宽,结构紊乱,小叶间有大量炎性细胞浸润,给予抗氧化剂tBHQ后,未见淀粉酶活性改变与胰腺病理损伤的改善。
流行病学调查研究[8-9]显示,我国高三酰甘油血症患病率约为高胆固醇血症的4倍,高三酰甘油血症除了作为心血管疾病的独立危险因素,其诱发急性胰腺炎的危险性越来越受到临床关注。早期的动物实验也显示自发性严重高三酰甘油血症动物LPL基因突变的水貂,可出现自发性急性胰腺炎,但其仅存在于挪威[10-11]。LPL基因突变的小鼠虽然可以通过救治进行高三酰甘油血症急性胰腺炎研究,但国外报道[12]通过基因治疗救治存活率很低。因此,以上研究采用的动物模型有很大的局限性。
高三酰甘油血症急性胰腺炎有典型的急性发作或反复急性发作特点,部分患者出现反复腹痛症状,与非高三酰甘油血症胰腺炎相比,高三酰甘油血症急性胰腺炎患者早期容易出现血钙降低、血钠降低、低蛋白血症以及结肠中断征等主要临床表征[13]。三酰甘油受进食状态影响,在中等程度(177~885 mg/dL,2~10 mmol/L)的高三酰甘油血症状态下也会引起急性胰腺炎发作[14]。高三酰甘油血症引起急性胰腺炎的发生和发展机制目前尚不明确,推测其可能有以下三种机制[15-16]。 ① 脂肪酸学说:三酰甘油的分解产物游离脂肪酸(free fatty acids,FFA)产生过多,在胰腺内不断聚集,使胰腺腺泡细胞和较小血管受损,导致急性胰腺炎的发生与加重[17],而FFA诱导胰腺腺泡细胞受损的机制可能有以下几种情况:FFA增多引起胰腺腺泡细胞内酸碱度下降,胰蛋白酶原激活,进而导致胰腺腺泡细胞自身消化[18]。② 胰腺微循环障碍:胰腺微循环障碍在急性胰腺炎的发生与病程发展中起重要作用,在急性胰腺炎的发病过程中,微循环障碍会影响胰腺的血流灌注,从而加重急性胰腺炎[19],高三酰甘油血症患者血浆中,大颗粒的乳糜微粒会使胰腺内毛细血管发生栓塞,引起微循环障碍,从而导致胰腺缺血与坏死[20]。③ 氧化应激学说:在胰腺炎发病的初始阶段,氧化应激状态下产生氧自由基,一方面直接损伤DNA,引起蛋白质内巯基氧化直接损伤胰腺细胞[21],另一方面氧自由基的过氧化物与其他炎性介质协同作用,加重炎性反应,降低细胞膜稳定性,使胰腺腺泡细胞溶酶体酶释放和消化酶活化[22]。
为了探讨临床上常见的严重高三酰甘油血症与急性胰腺炎的关系,笔者采用ApoC3转基因的严重高三酰甘油血症小鼠,结果表明,与LPL基因敲除小鼠相似,严重高三酰甘油血症-急性胰腺炎的ApoC3tg小鼠胰腺损伤明显,表明严重高三酰甘油血症下急性胰腺炎易感性增高。腹腔注射雨蛙素诱导急性胰腺炎后,ApoC3tg小鼠与野生小鼠的血浆淀粉酶活性均在不同时间点(9 h与12 h)明显升高,但两种小鼠的血浆淀粉酶活性差异无统计学意义。在临床中也常见报道[23-24],和其他急性胰腺炎患者不同,严重高三酰甘油血症-急性胰腺炎患者的血浆淀粉酶活性并不是一个灵敏的生物标志物,对于临床诊疗意义不大。本结果显示,在严重高三酰甘油血症动物模型上,血浆淀粉酶同样不是反映胰腺病理严重程度的灵敏的生物标识物。
早期有学者使用LPL基因敲除小鼠,对严重高三酰甘油血症与急性胰腺炎的关系进行了初步探索,发现LPL基因敲除小鼠体内乳糜微粒与游离脂肪酸含量明显升高,导致胰腺细胞受损,同时胰脂肪酶水解乳糜微粒,抑制钙离子进入腺泡细胞内,促进严重高三酰甘油血症下胰腺病理损伤[25]。LPL敲除小鼠的血浆丙二醛明显高于野生型小鼠,而分离出的乳糜微粒氧化程度和年龄成正比,说明这一动物氧化应激易感性增高,并且因为氧化损伤导致自发性动脉硬化的发生[26]。这些数据提示,LPL基因敲除小鼠对胰腺炎易感性增高和发生自发性胰腺炎有可能与氧化应激损伤有关。
抗氧化剂tBHQ作为核转录因子Nrf2的激动剂,能通过上调血红素加氧酶-1、超氧化物歧化酶等氧化应激因子,对多种炎性反应与氧化应激有改善作用[27-28]。因此,使用tBHQ对ApoC3tg小鼠进行实验性预防给药,未发现其对严重高三酰甘油血症-急性胰腺炎有明显改善作用,除了tBHQ,笔者也曾使用其他抗氧化剂(二叔丁基对甲酚与普罗布考等)对严重高三酰甘油血症-急性胰腺炎进行干预,均未见胰腺病理损伤的改善(文章尚未发表)。由此推测,氧化应激可能并非ApoC3tg小鼠在严重高三酰甘油血症下急性胰腺炎易感性增高的诱导机制。
本研究使用过表达人ApoC3基因的严重高三酰甘油血症小鼠,诱导急性胰腺炎后,符合临床严重高三酰甘油血症-急性胰腺炎患者的特点,可以作为理想的研究严重高三酰甘油血症动物模型探讨急性胰腺炎发病机制。使用基因修饰的高三酰甘油血症动物模型,探讨严重高三酰甘油血症状态下急性胰腺炎发生与发展机制,对严重高三酰甘油血症-急性胰腺炎的诊断与治疗,以及药物的有效性评估,具有一定的理论意义与实用价值。
