基于氧化应激探索木犀草素对缺氧-复氧损害的H9c2心肌细胞的保护作用
2020-06-16刘琳
刘琳
作者单位:青海省心脑血管病专科医院冠心病科,青海 西宁810000
缺血性心脏病是由冠状动脉循环功能或者器质性的改变所导致的冠状动脉血流和心肌细胞需氧量之间失调而引起的心肌损伤[1],其中冠状动脉粥样硬化引起的冠状动脉狭窄和闭塞是最常见的因素[2]。因此,缓解心肌缺血是目前临床上最为有效的治疗手段,但是会出现缺血/再灌注(ischemia/reperfusion,I/R)损伤[3]。I/R损伤涉及钙超载、氧化应激、细胞凋亡等多种机制[4],其中占主要作用的是氧化应激损伤。因此,研究者们在临床和基础实验中针对I/R损伤的氧化应激机制,做了大量研究,发现可通过使用具有抗氧化功效的药物可以降低I/R损伤的发生概率,这些药物包括白藜芦醇、茶多酚、人参皂苷、东莨菪碱和维生素C、辅酶Q等[5]。木犀草素作为黄酮类化合物,具有多酚结构,存在于多种植物中,研究发现具有抗氧化、抗菌、抗肿瘤、抗炎等作用。已有研究发现木犀草素对糖尿病小鼠心肌损伤[6]、高糖诱导的心肌微血管内皮细胞损伤[7]、脑缺血再灌注损伤[8]等均具有明显的改善效果,而木犀草素对心肌缺血再灌注损伤的研究相对较少,其中姚红等人研究发现木犀草素对心肌细胞损伤具有保护作用[9],但未从缺血再灌注和氧化应激层面去阐释保护机制。因此,本研究于2017年1月至2018年6月通过体外构建H9c2心肌细胞缺氧-复氧损伤的模型,探讨木犀草素对构建的模型细胞株氧化应激的影响及其作用机制,为木犀草素在临床上应用提供理论支持。
1 材料与方法
1.1材料木犀草素(72511)购于美国Sigma公司。H9c2心肌细胞(大鼠胚胎)购于中科院上海细胞库。H-DMEM培养基购买于美国Gibco公司,胎牛血清(FBS)购于四季青公司,总谷胱甘肽(GSH)检测试剂盒(A061-1)购于南京建成生物工程研究所,丙二醛(MDA)检测试剂盒(S0131)、RIPA 裂解液(P0013C)、辣根过氧化物酶(HRP)标记山羊抗小鼠二抗(A0216)及HRP标记山羊抗兔二抗(A0208)购于上海碧云天生物技术有限公司,实时荧光定量PCR(qPCR)试剂盒(RR820A)、Trizol试剂(9109)、反转录PCR试剂盒(RR047A)购于宝生物工程(大连)有限公司,鼠抗Kelch样ECH关联蛋白1(Keap1)单克隆抗体(ab150654)、兔抗核因子E2相关因子2(Nrf2)单克隆抗体(ab62352,Abcam)购买自Abcam公司,8-羟基脱氧尿苷(8-OHdG)酶联免疫吸附剂测定(ELISA)检测试剂盒(上海酶联生物科技有限公司,ml002198)。
1.2方法
1.2.1H9c2心肌细胞缺氧-复氧损伤造模的构建及分组 模型的制备参照文献[10]的方法操作:对照组细胞的培养条件是培养箱中二氧化碳的含量为5%,温度为37℃;模型组细胞则先用含2-脱氧-D-葡萄糖(2-deoxy-D-glucose)10,4-羟乙基哌嗪乙磺酸(HEPES)5,氯化钾(KCl)12,氯化镁(MgCl2)0.5,氯化钠(NaCl)139,氯化钙(CaCl2)1.3,乳酸20,且PH值为6.2的培养液(mmol/L)进行培养,温度控制在37℃,且培养箱中通入100%氮气(氧气<1%),培养持续8 h后,更换为DMEM培养基(10%FBS),恢复正常的氧气浓度,继续培养24 h;木犀草素处理组的细胞分别用5 μM、10 μM、20 μM的木犀草素[母液溶解在二甲基亚砜(DMSO)中,DMSO终浓度为0.5%]预处理24 h,随后进行上述缺氧-复氧实验;对照组和缺氧-复氧组均加入终浓度为0.5%的DMSO。
1.2.2MTT检测木犀草素对缺氧-复氧损伤的H9c2的影响 利用胰酶消化处在对数生长期H9c2心肌细胞,制备成单细胞悬液,按照每孔4×105个细胞接种于6孔板中和每孔1.5×104个细胞接种于96孔板中,贴壁后,参考1.2.1项,利用木犀草素进行处理及缺氧-复氧损伤,处理结束,用倒置显微镜观察6孔板中细胞形态的改变;加5 mg/mL的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)20 μL到96孔板的细胞中,正常环境培养4 h,弃去上清,加入150 μL DMSO室温溶解MTT,于490 nm处在酶标仪上测量光密度(OD)值,并计算各组细胞的增殖率。计算公式为:增殖率(%)=(OD实验组/OD对照组)×100%。
1.2.3流式细胞术检测木犀草素对缺氧-复氧损伤的H9c2心肌细胞凋亡的影响 按照1.2.1项的操作对各组细胞进行处理,处理结束后,分别收集各组细胞,用预冷磷酸缓冲盐溶液(PBS)进行洗涤,按照1×106/mL的细胞密度用1×结合缓冲液(Binding Buffer)重悬细胞,在离心管中加入100 μL的重悬细胞,然后分别加入5 μL膜联蛋白V-异硫氰酸荧光素(AnnexinⅤ-FITC)及5 μL碘化丙啶(PI),混匀后,置于25℃避光的条件下孵育15 min,再加入400 μL的1×Binding Buffer,混匀后,用流式细胞仪检测(此步骤需在1 h内进行)。
1.2.4蛋白质印迹法(Western Blot)检测木犀草素对缺氧-复氧损伤的H9c2细胞中B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、Keap1、Nrf2蛋白含量的影响 按照1.2.1项下处理各组细胞后,利用RIPA裂解液提取各组细胞总蛋白,二喹啉甲酸(BCA)定量后,加入5×上样缓冲液,煮沸5 min,-20℃保存。进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),具体流程为蛋白上样电泳、条带转膜、封闭背景、加入一抗进行孵育、加入二抗孵育、利用ECL发光液显色、然后自动曝光仪曝光,最后对条带进行拍照分析。
1.2.5qPCR检测木犀草素对缺氧-复氧损伤的H9c2细胞中MDA、8-OHdG、GSH含量的影响 按照1.2.1项的步骤对各组细胞进行处理后,在PBS缓冲液中研碎细胞,然后离心取上清弃杂质,按照试剂盒说明书中的检测步骤对上清中MDA、8-OHdG、GSH含量进行检测,其中TBA法检测MDA、ELISA检测8-OHdG,微量酶标法检测GSH。
1.2.6木犀草素对缺氧-复氧损伤的H9c2细胞中γ-谷氨酰半胱氨酸合酶(γ-GCS)、血红素加氧酶(HO-1)、NAD(P)H醌氧化还原酶(NQO1)mRNA表达影响按照1.2.1项的步骤处理各组细胞后,利用Trizol法提取细胞总RNA,并用用RNase-free水溶解,按照反转录PCR试剂盒说明书合成cDNA,再按照qPCR试剂盒的步骤进行qPCR,荧光定量反应程序为:预变性:95℃、10 min、1循环数;扩增:95℃、15 s,60℃、15 s,72 ℃、30 s、40循环数。用2-△△Ct表示基因相对表达量。引物序列如表1所示。
1.3统计学方法采用SPSS 21.0软件对实验数据进行统计,以±s表示计量资料,采用单因素方差分析进行多组间比较,采用LSD-t检验进行多组间的两两比较,以P<0.05表示差异有统计学意义。
2 结果
2.1木犀草素对缺氧-复氧损伤H9c2细胞的影响如图1所示,两组细胞的形态变化:对照组的细胞生长状态良好,大部分呈梭形;而缺氧-复氧损伤的细胞大部分呈现不规则多角形,且悬浮、裂解、细胞碎片明显增多,细胞内出现细微颗粒物,表面粗糙,增殖率显著下降[对照组:(100±0)%比缺氧-复氧组:(19.73±3.56)%,t=39.054,P=0.000];经木犀草素处理后,再进行缺氧-复氧损伤,发现随着增加木犀草素的浓度,不规则细胞的数量,细胞中悬浮、裂解、细胞碎片均逐渐下降,增殖率逐渐增加,与缺氧-复氧损伤组相比,差异有统计学意义[缺氧-复氧组:(19.73±3.56)%比5 μM木犀草素组:(39.45±4.38)%、10 μM木犀草素组:(66.11±5.69)%、20 μM木犀草素组:(94.38±10.18)%,t1=3.304,P=0.027;t2=6.831,P=0.002;t3=11.989,P=0.000](F=12.486,P=0.000)。
2.2木犀草素对缺氧-复氧损伤H9c2心肌细胞凋亡的影响如图2所示,相比对照组细胞凋亡率(8.14±1.13)%,缺氧-复氧组细胞中早晚期凋亡细胞的比例明显上升(72.37±6.98)%,差异有统计学意义(t=15.733,P=0.000);经木犀草素处理后,再进行缺氧-复氧损伤,发现与缺氧-复氧组细胞凋亡相比,随木犀草素浓度的增加,实验组早晚期细胞凋亡比例逐渐减少[(65.45±5.14)%、(41.38±4.32)%、(29.67±5.67)%],其中10 μM和20 μM木犀草素组细胞凋亡显著减少(t1=6.539,P=0.003;t2=8.224,P=0.001)(F=8.863,P=0.000)。
2.3木犀草素对缺氧-复氧损伤的H9c2细胞中Bax、Bcl-2蛋白含量的影响如图3所示,相比对照组,缺氧-复氧组细胞中Bax蛋白表达量增加显著(t=11.079,P=0.000),Bcl-2蛋白含量显著减少(t=9.608,P=0.001);经木犀草素处理后,再进行缺氧-复氧损伤,发现与缺氧-复氧组细胞相比,随木犀草素浓度的增加,实验组细胞中Bax蛋白含量逐渐下降,而Bcl-2蛋白含量则逐渐上升,其中10 μM和20μM木犀草素处理组中的细胞Bax和Bcl-2蛋白变化均差异有统计学意义(Bax:t1=4.979,P=0.008;t2=10.224,P=0.001;Bcl-2:t1=6.124,P=0.004;t2=8.386,P=0.001)。见表2。
表2 木犀草素对H9c2细胞中B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)蛋白含量的半定量统计/±s

表2 木犀草素对H9c2细胞中B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)蛋白含量的半定量统计/±s
注:与对照组相比,aP<0.05;与缺氧-复氧组相比,bP<0.05
组别对照组缺氧-复氧组5 μM木犀草素组10 μM木犀草素组20 μM木犀草素组F值P值Bax相对表达量0.38±0.04 1.01±0.09a 0.83±0.05 0.71±0.06b 0.45±0.03b 11.346 0.000重复次数3 3 3 3 3 Bcl-2相对表达量0.83±0.06 0.43±0.04a 0.47±0.05 0.63±0.04b 0.74±0.05b 8.674 0.000
2.4木犀草素对缺氧-复氧损伤的H9c2细胞中MDA、8-OHdG、GSH含量的影响如表3所示,相比对照组,MDA、8-OHdG含量在缺氧-复氧组细胞中显著增加(MDA:t=17.054,P=0.000;8-OHdG:t=7.691,P=0.002),GSH含量显著减少(t=12.389,P=0.000);经木犀草素处理后,再进行缺氧-复氧损伤,发现与缺氧-复氧组细胞相比,随木犀草素浓度的增加,实验组细胞中MDA、8-OHdG含量逐渐减少,GSH含量逐渐增加,其中5 μM、10 μM和20 μM木犀草素组细胞中MDA、8-OHdG和10 μM和20 μM木犀草素组细胞中GSH含量变化均差异有统计学意义(MDA:t1=5.879,P=0.004;t2=11.748,P=0.000;t3=15.062,P=0.000;8-OHdG:t1=3.778,P=0.019;t2=6.054,P=0.004;t3=7.850,P=0.001;GSH:t1=6.326,P=0.003;t2=8.395,P=0.001)。
表3 木犀草素对H9c2细胞中丙二醛(MDA)、8-羟基脱氧鸟苷(8-OHdG)、谷胱甘肽(GSH)含量的影响/±s

表3 木犀草素对H9c2细胞中丙二醛(MDA)、8-羟基脱氧鸟苷(8-OHdG)、谷胱甘肽(GSH)含量的影响/±s
注:与对照组相比,aP<0.05;与缺氧-复氧组相比,bP<0.05
重复次数33333组别对照组缺氧-复氧组5 μM木犀草素组10 μM木犀草素组20 μM木犀草素组F值P值MDA/(nmol/mg)0.45±0.05 1.73±0.12a 1.12±0.11b 0.82±0.06b 0.63±0.04b 6.789 0.001 8-OHdG/(ng/L)183.81±20.68 316.37±21.53a 253.26±19.33b 211.45±20.98b 189.15±18.01b 14.342 0.000 GSH/(nmol/mg)193.98±12.38 88.59±7.99a 107.96±15.66 142.19±12.31b 178.67±16.78b 7.658 0.001
2.5木犀草素对缺氧-复氧损伤的H9c2细胞中γ-GCS、HO-1、NQO1 mRNA表达的影响如图4所示,相比对照组,γ-GCS、HO-1、NQO1 mRNA在缺氧-复氧组细胞中表达量均显著下降(γ-GCS:t=8.165,P=0.001;HO-1:t=40.836,P=0.000;NQO1:t=21.218,P=0.000);经木犀草素处理后,再进行缺氧-复氧损伤,发现与缺氧-复氧组细胞相比,随木犀草素浓度的增加,实验组细胞中γ-GCS、HO-1、NQO1 mRNA表达逐渐增加,其中10 μM和20 μM木犀草素组细胞中γ-GCS以及5 μM、10 μM和20 μM木犀草素组细胞中HO-1、NQO1 mRNA变化均差异有统计学意义(γ-GCS:t1=3.149,P=0.035;t2=4.649,P=0.010;HO-1:t1=5.945,P=0.004;t2=9.624,P=0.001;t3=9.126,P=0.001;NQO1:t1=5.284,P=0.006;t2=6.003,P=0.004;t3=8.764,P=0.001)。见表4。
表4 木犀草素对H9c2细胞中γ-谷氨酰半胱氨酸合酶(γ-GCS)、血红素加氧酶(HO-1)、NAD(P)H醌氧化还原酶(NQO1)mRNA表达影响/±s
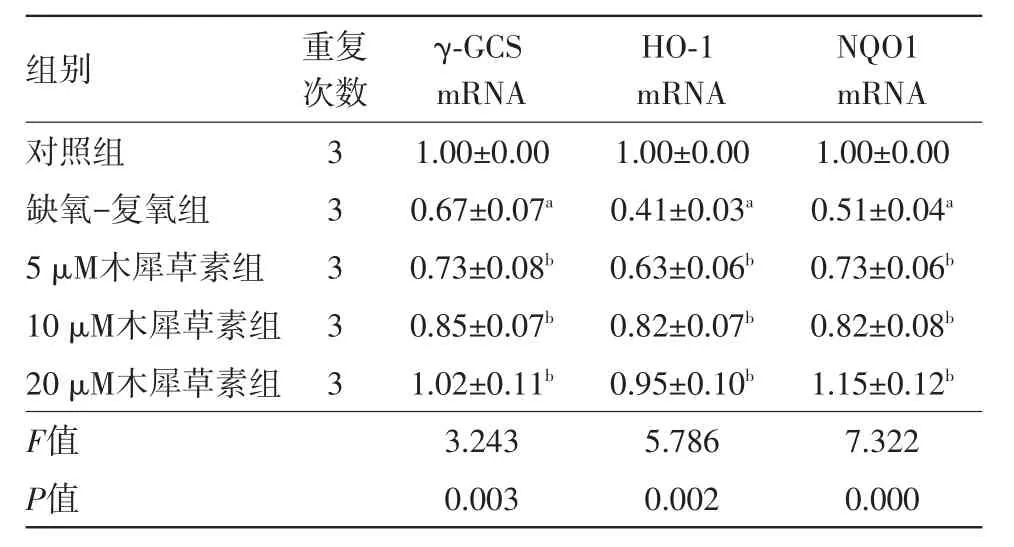
表4 木犀草素对H9c2细胞中γ-谷氨酰半胱氨酸合酶(γ-GCS)、血红素加氧酶(HO-1)、NAD(P)H醌氧化还原酶(NQO1)mRNA表达影响/±s
注:与对照组相比,aP<0.05;与缺氧-复氧组相比,bP<0.05
组别对照组缺氧-复氧组5 μM木犀草素组10 μM木犀草素组20 μM木犀草素组F值P值NQO1 mRNA 1.00±0.00 0.51±0.04a 0.73±0.06b 0.82±0.08b 1.15±0.12b 7.322 0.000重复次数33333 γ-GCS mRNA 1.00±0.00 0.67±0.07a 0.73±0.08b 0.85±0.07b 1.02±0.11b 3.243 0.003 HO-1 mRNA 1.00±0.00 0.41±0.03a 0.63±0.06b 0.82±0.07b 0.95±0.10b 5.786 0.002
2.6木犀草素对缺氧-复氧损伤的H9c2细胞中Keap1、Nrf2蛋白含量的影响如图5所示,与对照组相比,缺氧-复氧组细胞中Keap1蛋白含量有所减少(t=2.976,P=0.04),Nrf2蛋白含量有所升高(t=5.644,P=0.005);经木犀草素处理后,再进行缺氧-复氧损伤,发现与缺氧-复氧组细胞相比,随木犀草素浓度的增加,实验组细胞中Keap1蛋白含量逐渐更加减少,Nrf2蛋白含量逐渐更加升高,其中10μM和20μM木犀草素组细胞中Keap1和Nrf2蛋白变化均差异有统计学意义(Keap1:t1=17.041,P=0.000;t2=23.945,P=0.000;Nrf2:t1=4.631,P=0.010;t2=6.426,P=0.003)。见表5。

图5 木犀草素对H9c2细胞中核因子E2相关因子2(Nrf2)、Kelch样ECH关联蛋白1(Keap1)蛋白含量的影响(蛋白质印迹法条带)
表5 木犀草素对H9c2细胞中核因子E2相关因子2(Nrf2)、Kelch样ECH关联蛋白1(Keap1)蛋白含量的半定量统计/± s

表5 木犀草素对H9c2细胞中核因子E2相关因子2(Nrf2)、Kelch样ECH关联蛋白1(Keap1)蛋白含量的半定量统计/± s
注:与对照组相比,aP<0.05;与缺氧-复氧组相比,bP<0.05
组别对照组缺氧-复氧组5 μM木犀草素组10 μM木犀草素组20 μM木犀草素组F值P值Keap1相对表达量0.83±0.045 0.72±0.04a 0.61±0.05 0.28±0.02b 0.15±0.01b 5.634 0.003重复次数33333 Nrf2相对表达量0.43±0.031 0.62±0.05a 0.73±0.045 0.85±0.07b 0.97±0.08b 4.333 0.002
3 讨论
缺血再灌注可引起心肌损伤,主要原因在于缺氧-复氧引起的氧化应激与线粒体代谢障碍之间的协同作用导致心肌发生炎症、心肌细胞凋亡[11-12]。目前抗氧化药物的应用在基础和临床研究中表现出对缺血再灌注心肌损伤良好的保护效果。木犀草素是天然的抗氧化剂,可利用这一特点对多种疾病的预防及发生发展起到保护作用[13-16]。因此,本研究在体外缺氧-复氧培养H9c2心肌细胞模拟缺血再灌注,通过检测直接缺氧-复氧培养和先木犀草素再缺氧-复氧培养的H9c2细胞的损伤凋亡情况及其氧化应激水平的变化,进一步在氧化应激损伤心肌细胞的层面探索了木犀草素对缺血再灌注损害的心肌细胞的保护作用。
心肌细胞凋亡是缺血再灌注对心肌细胞最直观和最终的损伤。缺血再灌注引起的种种代谢变化最后都会引起心肌细胞的凋亡进而导致心肌损伤。细胞核内的凋亡基因Bcl-2/Bax、Bcl-xL、Fas/Fas-L等在缺血缺氧的刺激下进行高表达,迅速启动细胞凋亡程序,加重细胞的凋亡[17-18]。有研究显示,细胞凋亡在心肌缺血再灌注损伤的发生过程中会损伤心肌细胞的结构与功能损害,因此可用于部分药物干预治疗心肌缺血再灌注损伤的靶点[19-20]。在本研究中,我们发现在缺氧-复氧心肌细胞中Bax蛋白的表达量的降低和Bcl-2蛋的白表达量的增加对木犀草素具有浓度依赖性,因此木犀草素可抑制缺氧-复氧造成的心肌细胞凋亡,而在心肌细胞形态观察和流式检测的结果中均直观证实这一抑制凋亡的作用。研究表明,缺血期间心肌细胞内氧自由基大量增加和钙离子超载是缺血的心肌再灌注后启动凋亡程序的原因[21-22],首先细胞膜中的不饱和脂肪酸被大量增加的氧自由基攻击,引起细胞膜脂质过氧化及膜脂质微环境的改变,因此引发细胞膜功能和结构的障碍,细胞膜通透性增加,流动性降低,进而损伤整个细胞的结构和功能,最终导致细胞的凋亡;其次细胞内的核糖核酸也会被氧自由基氧化损伤,导致细胞的凋亡。在实验中MDA和8-OHdG分别作为脂质过氧化和DNA过氧化的标志物,在本研究中显示木犀草素可以抑制因缺氧-复氧引起胞中MDA和8-OHdG浓度,这一抑制作用具有浓度依赖性,提示木犀草素可保护缺氧-复氧心肌细胞中脂质和DNA免受过氧化损伤。
在正常心肌细胞内存在整套抗氧自由基酶系统和天然抗氧化剂,可使体内产生的氧自由基被不断消除,并维持在低水平状态,使心肌细胞免受损害。过氧化氢酶(CAT)、血红素氧合酶1(HO-1)、超氧化物歧化酶(SOD)、人醌氧化还原酶1(NQO-1)谷氨酰半胱氨酸合成酶(γ-GCS)、等都属于抗氧自由基酶,辅酶Q10、VitC、VitE、VitA、谷胱甘肽(GSH)等属于天然抗氧化剂。在发生急性心肌缺血时,体内常规消除氧自由基的酶活性受到了抑制,在进行再灌注时,有大量酶被带走,因此不能正常发挥清除作用,导致氧自由基含量增加。本研究结果显示,在由缺氧-复氧损伤心肌细胞中,木犀草素可浓度依赖的提高胞中降低的GSH含量以及增加γ-GCS、HO-1、NQO1 mRNA的表达量,说明木犀草素可有效地改善心肌细胞内抗氧化系统,进而保护心肌细胞免受缺氧-复氧造成的过氧化损伤。
近年研究发现,细胞内抗氧化应激发挥关键作用的通路是Nrf2-抗氧化响应元件(ARE)信号通路,其可以通过调控细胞抗氧化酶系和Ⅱ相解毒酶清除氧自由基等有害物质,发挥中和解读的作用[23]。在激活Nrf2-ARE信号通路后,可诱导大量保护性基因NQO1、HO-1、γ-GCS等进行转录,抵御外界刺激对机体产生的氧化应激损伤[24]。在正常状况下,Keap1与Nrf2相结合,促进Nrf2泛素化降解,抑制Nrf2进核。在氧化应激状态下Keap1与Nrf2解离,Nrf2激活进入细胞核,启动下游Ⅱ相解毒酶等一系列保护性基因的转录和蛋白表达,增强细胞的抗氧化能力[25]。本研究发现缺氧-复氧可是减少心肌细胞内Keap1蛋白含量,增加Nrf2蛋白的含量,说明Nrf2-ARE信号通路被氧化应激激活,同时木犀草素可浓度依赖的降低心肌细胞内Keap1蛋白的含量,增加Nrf2蛋白的含量,这说明在缺氧-复氧损伤的心肌细胞中,木犀草素可激活Nrf2-ARE信号通路来保护心肌细胞。
综上所述,木犀草素可抑制由缺氧-复氧导致的心肌细胞凋亡,保护心肌细胞免受缺氧-复氧损伤。一方面木犀草素通过激活细胞内抗氧化应激的关键信号通过Nrf2-ARE通路,促进细胞内抗氧自由基酶的表达,降低损伤细胞的氧化应激水平,保护缺氧-复氧损伤的心肌细胞。但是本研究仅局限于木犀草素的抗氧化性,探索其在氧化应激水平的分子机制,而木犀草素的其他药理特性是否参与保护心肌细胞免受缺氧-复氧损伤还未可知,需后续进行研究。
(本文图1~4见插图6-2)

图1 木犀草素对缺氧-复氧损伤的H9c2的影响(×100):A为对照组;B为缺氧-复氧组;C为5 μM木犀草素组;D为10 μM木犀草素组;E为20 μM木犀草素组

图2 木犀草素对H9c2细胞凋亡的影响:A为对照组;B为缺氧-复氧组;C为5 μM木犀草素组;D为10 μM木犀草素组;E为20 μM木犀草素组

图3 木犀草素对H9c2细胞中B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)蛋白含量的影响(蛋白质印迹法条带)


图4 木犀草素对H9c2细胞中γ-谷氨酰半胱氨酸合酶(图4A)、血红素加氧酶(图4B)、NAD(P)H醌氧化还原酶(图4C)mRNA表达影响(溶解曲线图)
