不同培养液及细菌HT-6 对致病疫霉 游动孢子活性的影响
2020-06-09张聪颖孟翠丽蒋继志
张聪颖,梁 娇,乔 柳,孟翠丽,蒋继志
(1. 河北大学 生命科学学院,河北 保定 071002;2. 邢台医学高等专科学校 基础医学部,河北 邢台 054000)
卵菌致病疫霉(Phytophthora infestans)主要引起马铃薯晚疫病,通过产生孢子囊或卵孢子进行繁殖,其成熟的孢子囊在水或风的作用下从孢子囊梗脱落后可以进行较长距离的传播,而且一个孢子囊在适宜条件下会释放多个游动孢子,游动孢子被誉为是卵菌尤其是疫霉菌侵染植物的核心武器,也是这一类病菌传播植物病害的主要因子之一[1-3]。游动孢子为单核、无细胞壁,具有2 根不等长的鞭毛,便于游动,通常游动30 min 或到达宿主表面后,就会失去鞭毛,形成细胞壁并萌发出芽管附着在植株上,继而芽管顶端彭大形成附着胞,再次萌发产生侵染钉侵染植物。孢子囊直接萌发产生的芽管及其菌丝直接侵染植物的能力远不及游动孢子[2,4,5]。在孢子囊释放游动孢子所必需的条件中,除温度和湿度有显著影响外[6],关于培养液或培养基对孢子囊释放游动孢子及其侵染能力的影响在苎麻疫霉(P. boehmeriae)、烟草疫霉(P. nicotianae)和多种腐霉(Pythium spp.)中已有报道[7-8],但迄今为止,不同培养液或不同培养基对致病疫霉孢子囊释放游动孢子及其侵染力的影响少有报道。
本研究室在前期连续多年监测致病疫霉生理小种动态变化以及筛选对致病疫霉游动孢子萌发和释放具有强烈抑制作用的活性物质的过程中,发现来源于植物或微生物的不同活性物质对同一致病疫霉菌株孢子囊的形成、游动孢子的释放和萌发似有不同影响[9-11],同时,在细菌HT-6 对于致病疫霉的影响方面已经明确了其对致病疫霉菌丝的抑制效果(抑制率为89.61%)、对菌丝的致畸作用(畸变率为40.33%)及对马铃薯离体组织的防病效果等[11-13],但是该菌对于致病疫霉游动孢子运动能力、侵染能力、成膜能力尚不明确。本试验通过实验室中常用的10%V8 培养液、黑麦液体培养基及无菌蒸馏水和自来水4 种培养液来处理致病疫霉孢子囊,对游动孢子的释放能力、侵染能力、运动能力和生物膜形成能力进行比较,同时探究不同浓度HT-6 菌液对游动孢子活性的抑制作用,明确拮抗细菌HT-6 对游动孢子活性的影响,为迅速获得高质量的致病疫霉游动孢子提供参考,并为加快利用该细菌防治马铃薯晚疫病提供依据。
1 材料与方法
1.1 供试菌株及培养基
致病疫霉(Phytophthora infestans (Mont.) de Bary)W101 菌株及枯草芽孢杆菌(Bacillus subtilis)HT-6 菌株均由河北大学生命科学学院植物病理研究室保存,培养基分别为黑麦固体培养基(RA)和LB 液体培养基(LB)。
诱导孢子囊释放游动孢子的培养液分别为自来水(TW,未经灭菌或去矿化)、无菌蒸馏水(SDW,经高温高压灭菌)、培养致病疫霉常用的黑麦液体培养基(RL)和10%V8 液体培养基(V8)。
1.2 不同培养液影响游动孢子各项能力的检测
1.2.1 不同培养液影响孢子囊释放游动孢子的测定 参照黄英菊[11]等的方法并作如下改进:将致病疫霉W101 接种于RA,20 ℃黑暗条件下培养至第7 天,在培养皿中分别加入15 mL 的TW、SDW、RL 和V8,淹没致病疫霉菌落,用无菌涂布棒刮取致病疫霉菌体,收集菌体于50 mL 烧杯中,经300 目筛网过滤得到孢子囊悬浮液,用无菌水将浓度调至10×10 倍显微镜下每个视野100 ~130 个孢子囊,然后置于4 ℃冰箱2.5 h 促进游动孢子释放,从均匀分布的菌悬浮液中部用移液器吸取少量悬浮液镜检,试验重复3 次,每次随机观察100 个视野,计算游动孢子释放率,同时统计菌悬液中游动孢子的浓度,经15 µm 滤膜过滤(仅含有少量孢子囊),再用培养液调整每个视野20 ~40 个游动孢子,得到游动孢子悬浮液(0.4×106cfu/mL),进行后续试验。
游动孢子释放率(%)=孢子囊空壳数/孢子囊总数×100
1.2.2 不同培养液影响游动孢子侵染马铃薯离体组织能力的测定 分别吸取50 μL 用不同培养液制备的游动孢子悬浮液,滴加并用无菌涂布棒涂抹接种于马铃薯块茎切片(2.0 cm × 2.0 cm × 0.5 cm)表面,以涂抹等量相对应的4 种培养液作为对照,接种后的块茎切片置于20 ℃黑暗保湿培养7 d,观察块茎切片的发病情况,根据文献[14]统计病情指数。试验重复3 次,每个处理设置4 个重复。
病情指数=[Σ(病级数×该病级的块茎切片数)/(调查块茎切片总数×最高病级数)]×100
1.2.3 不同培养液影响游动孢子运动能力的检测 参考杨佳瑶等[15]的方法,光学显微镜下检查游动孢子的运动状态,并统计每个视野中具有运动性的游动孢子所占比例,试验重复3 次,每次随机观察20 个视野,比较不同培养液对致病疫霉释放的游动孢子运动能力的影响。
1.2.4 不同培养液影响游动孢子生物膜形成能力的测定 依据李星星[16]的方法,并做如下改进:在24 孔板的孔中分别加入1.6 mL 的4 种培养液和 400 µL 不同培养液制备的游动孢子悬浮液,置于 20 ℃黑暗静置培养4 d 后,吸出培养液,用磷酸盐缓冲液冲洗24 孔板中形成的生物膜,再用移液器吸干缓冲液,然后加入0.2%(w/v)结晶紫水溶液染色30 min,吸出染色液,用无菌蒸馏水清洗2 次,吸干后再加2 mL 乙醇/丙酮溶液(80:20,v/v)溶解吸附于生物膜上的染料,蒸馏水稀释10 倍后,测定 540 nm 处的吸光值计算生物膜量。
每个处理设置3 个重复,试验重复3 次。
1.3 不同浓度细菌HT-6 菌液对游动孢子各项能力的影响
1.3.1 细菌HT-6 影响游动孢子释放能力的测定 由1.2.1 的结果已知,致病疫霉孢子囊在TW 中游动孢子释放率最高,因此取经过LB 活化培养24 h的HT-6 菌液(OD600=1.433)分别稀释5、10、100 倍,按照上述1.2.1 的方法,分别与用TW 制备的孢子囊悬浮液等体积混合,镜检游动孢子释放情况,评价细菌HT-6 的影响。
1.3.2 细菌HT-6 影响游动孢子侵染能力的测定 由上述的结果已知,孢子囊在V8 中释放的游动孢子其侵染能力、运动能力和成膜能力均最强,因此以下试验均选择由V8 制备的游动孢子进行。分别取50 μL 不同浓度(同1.3.1)的HT-6 菌液均匀涂抹在块茎切片上,以涂抹等体积LB 作对照,在20 ℃黑暗条件下保湿培养24 h,然后按照1.2.2的方法接种用V8 制备的游动孢子悬浮液(0.4×106cfu/mL),观察块茎切片的发病情况,评价HT-6 对游动孢子侵染能力的影响。
病害预防效果( %) =(对照病情指数-处理病情指数)/对照病情指数×100
1.3.3 细菌HT-6 影响游动孢子运动能力的测定 将不同浓度的HT-6 菌液(同1.3.1)与用V8 制备的游动孢子悬浮液(0.4×106cfu/mL)等体积混合,以加入相同体积的LB 作为对照,按照12.3 中的方法,镜检视野中具有运动性的游动孢子所占比例,测定细菌HT-6 对游动孢子运动能力的影响。
1.3.4 细菌HT-6 影响游动孢子成膜能力的测定 在24 孔板中分别加入V8(1 200 µL)、不同浓度的HT-6 菌液(400 µL)和游动孢子悬浮液(0.4×106cfu/mL,400 µL),每孔中总体积为 2 000 µL,以不加HT-6 菌液和不加游动孢子悬浮液分别为对照1 和对照2。按照1.2.4 中的方法测定各处理下游动孢子的成膜能力。
2 结果与分析
2.1 不同培养液对致病游动孢子各项能力的影响
2.1.1 不同培养液对致病疫霉释放游动孢子的影响 供试4 种培养液均能诱导致病疫霉孢子囊释放游动孢子(图1),且彼此间的游动孢子释放率均存在显著性差异(P<0.05)。释放率由高到低依次为TW(46.77 %)、SDW(25.99 %)、V8 (16.36 %)和RL(6.16 %),说明游动孢子在渗透压较低的的培养液中释放得更快更多。由4 种培养液得到的游动孢子悬浮液浓度分别为0.74×106、0.56×106、0.48×106和0.41×106cfu/mL。

图1 不同培养液对致病疫霉释放游动孢子的影响 Fig.1 Effects of different culture media on the release of zoospores of P. infestans
2.1.2 不同培养液对游动孢子侵染离体组织能力的影响 来自不同培养液的致病疫霉孢子囊释放的游动孢子对马铃薯离体块茎切片均有很强的侵染能力(见图2),但彼此间均存在显著性差异(P<0.05)。在接种后的第2 天,即可观察到块茎切片发病,第7 天时最为严重;其中接种来自V8 及RL 的游动孢子的块茎切片表面完全被菌丝体覆盖,且切片颜色发黑、腐烂变软,病情指数最高(分别为87.51 和81.25),而接种来自TW 和SDW 的游动孢子的切片表面虽也布满菌丝体,但发病较轻,仅轻微腐烂,病情指数分别为75.45 和58.33,而对照组所有块茎切片表面均鲜亮有光泽未见褐变和腐烂,表明培养基中的营养成份能显著增强孢子囊释放出的游动孢子对植物的侵染能力。

图2 不同培养液对游动孢子侵染马铃薯块茎切片的影响Fig.2 Effects of different culture media on infection of potato tuber slices by zoospore
2.1.3 不同培养液对游动孢子运动能力的影响 显微镜观察发现,来自V8 的游动孢子运动性最强(见图3),约23.25%的游动孢子具有运动性,其次是来自RL 及TW 的游动孢子,而来自SDW的游动孢子运动性最弱,具有游动性的游动孢子仅为18.41%,但4 种处理之间均不存在显著性差异(P>0.05),表明不同培养液对已经形成的游动孢子的运动能力均没有显著影响。
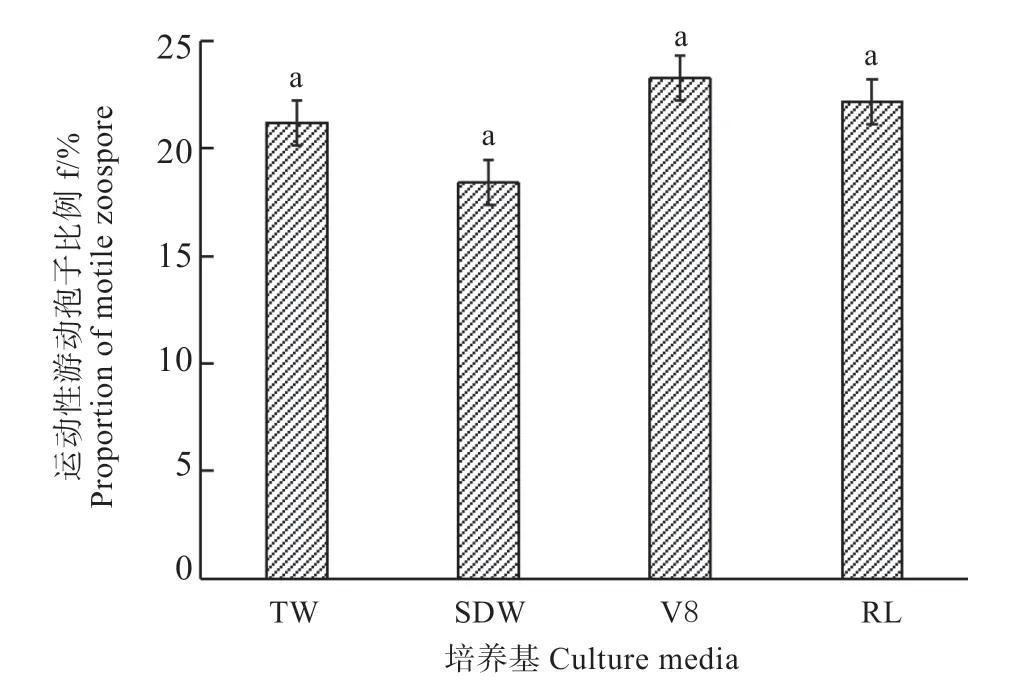
图3 不同培养液对游动孢子运动能力的影响Fig.3 Effects of different culture media on the motile ability of zoospores
2.1.4 不同培养液对游动孢子生物膜形成能力的影响 游动孢子接种到24 孔板后24 h,生物膜开始形成,至第4 天时(图4),发现来自V8 的游动孢子除在24 孔板底部形成生物膜外,还在气液界面生成生物膜,而其他3 种处理仅在24 孔板底部形成,但各处理中生物膜结构都比较完整牢固。不同培养液制备的游动孢子在形成生物膜量之间存在显著性差异(P<0.05),其中以来自V8 的游动孢子生物膜量最高(OD540=1.107),其次是RL(OD540=0.753),来自SDW 的成膜量最低(OD540=0.397),表明培养基中的营养成份可显著增强游动孢子形成生物膜的能力。
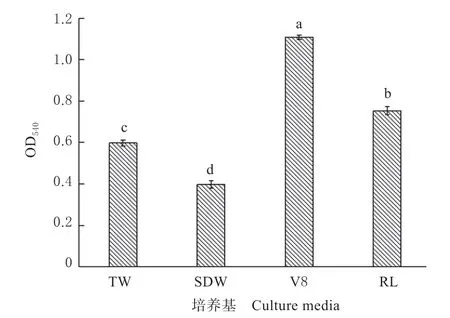
图4 不同培养液对游动孢子生物膜形成能力的影响Fig.4 Effects of different culture media on the biofilmforming ability of zoospores
2.2 不同浓度细菌HT-6 对致病疫霉游动孢子的影响
2.2.1 细菌HT-6 对游动孢子释放能力的影响 不同浓度的细菌HT-6 菌液对来自TW 的游动孢子的释放均有抑制作用,且随菌液浓度升高,释放率逐渐下降(表1)。其中HT-6 原液(OD600=1.433)的抑制作用最强(释放率仅为4.17%),随菌液浓度降低,抑制作用相应减弱,游动孢子释放率由4.17%升至18.52%,不同处理与对照之间均具有显著性差异(P<0.05)。
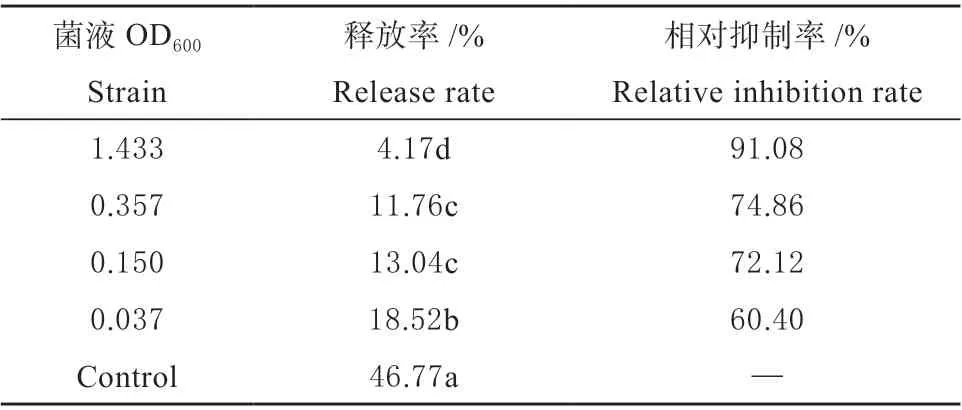
表1 细菌HT-6 对游动孢子释放能力的影响Table 1 Effect of bacterial HT-6 on zoospore release ability
此外,在观察游动孢子游动能力时,发现细菌HT-6 对游动孢子的形态也具有一定的影响,部分游动孢子形状不规则或破裂,并且大部分孢子囊不会将内容物排空(图5-A,B),而正常情况下除1 个孢子囊可以释放多个游动孢子外,释放出的游动孢子为圆球状,内含物均匀包裹于膜内(图5-C,D),内含物通常全部排空。

图5 细菌HT-6 对游动孢子形态的影响Fig.5 Effect of HT-6 strain on zoospore morphology
2.2.2 细菌HT-6 对游动孢子侵染能力的影响 因来自V8 的游动孢子对块茎切片的侵染能力最强,因此利用不同浓度的HT-6 菌液处理块茎切片,再接种来自V8 的游动孢子(图6),发现对照组块茎切片表面完全被菌丝体覆盖,且块茎腐烂变软,严重褐变(病情指数为87.05),而不同浓度的HT-6 菌液预先处理后,病情指数与对照组相比均显著降低(P<0.05),仅涂抹浓度较低的HT-6 菌液(OD600=0.037)的块茎切片上长出菌丝,出现褐变及腐烂现象,涂抹其他浓度菌液的块茎切片仅出现轻微褐变,无菌丝产生。说明不同浓度HT-6 菌液对来自V8 的游动孢子的侵染能力均有较强的抑制作用,且彼此之间存在显著性差异(P<0.05),其中OD600=1.433 的菌液的抑制效果最显著(病害预防效果72.95%)。

图6 不同浓度细菌HT-6 菌液对游动孢子侵染块茎切片的影响Fig.6 Effects of HT-6 strain at different concentrations on infection of tuber slices by zoospores
2.2.3 细菌HT-6 对游动孢子运动能力的影响 利用不同浓度的HT-6 菌液处理来自V8 的游动孢子,统计具有游动性的游动孢子所占比例(表2),发现随着HT-6 浓度的增加,具有游动能力的游动孢子比例逐渐下降,与未加入HT-6 菌液的对照组相比均具有显著性差异(P<0.05),其中,HT-6 菌液原液(OD600=1.433)对游动孢子游动能力的抑制效果最强,抑制率达87.37%,仅2.97%的游动孢子具有游动能力。
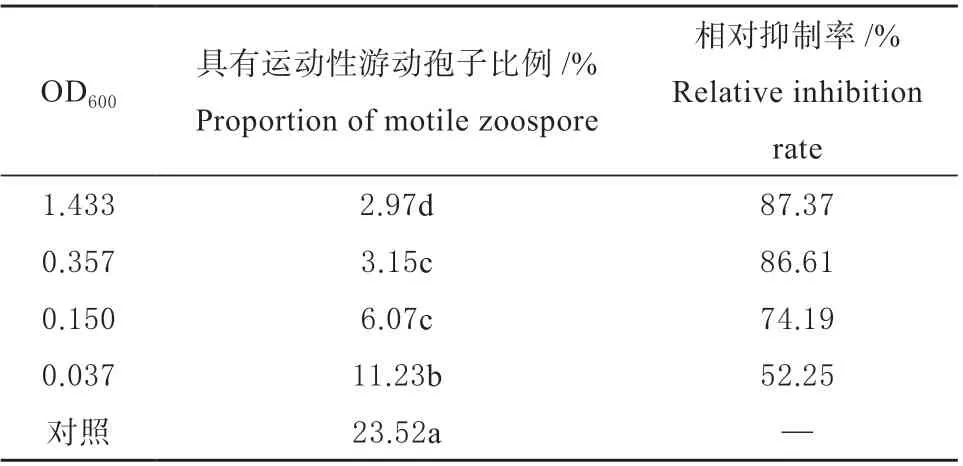
表2 细菌HT-6 对游动孢子运动能力的影响Table 2 Effect of bacteria HT-6 on zoospore motility
2.2.4 细菌HT-6 对游动孢子成膜能力的影响 将来自V8 的游动孢子与细菌HT-6 菌液接种到24 孔板,发现培养至第4 天时(见表3),加入游动孢子悬浮液且不加HT-6 菌液的对照1 形成的生物膜较稀疏,孔隙较大,形成于孔板底部,然后再延伸至气液表面,形成的生物膜总量(OD540)为1.107;而加入HT-6 菌液且不加游动孢子悬浮液的对照2 与各试验组仅在气液界面处形成较致密的细菌HT-6生物膜,未发现游动孢子形成的生物膜,表明细菌HT-6 可以抑制致病疫霉游动孢子生物膜的形成。

表3 不同浓度细菌HT-6 菌液对游动孢子成膜能力的影响Table3 Effect of HT-6 bacterial suspension at different concentrations on the biofilm-forming ability of zoospores
3 讨论与结论
卵菌的生物学性状及其遗传学研究通常以孢子囊或孢子囊释放的游动孢子为研究对象,因此选择合适的培养液诱导卵菌孢子囊产生游动孢子就显得尤为重要[7,17]。Michael 等[8]对12 株烟草疫霉(P. nicotianae)和17 种腐霉(Pythium spp.)在4 种培养基和5 种培养温度下产生游动孢子的能力进行了测定,发现大多数菌株在20%澄清V8 培养液中要比在黑麦、利马豆和胡萝卜这3 种培养基中能产生更多的游动孢子,游动孢子浓度可高达1×104cfu/mL。左豫虎等[18]探究了影响大豆疫霉游动孢子产生的条件,得出Petri 培养液诱导得到的游动孢子浓度(0.637×106cfu/mL)显著高于蒸馏水诱导的浓度(0.338×106cfu/mL)。在对马铃薯致病疫霉的研究中,通常用V8 或Rye 培养致病疫霉,但对2 种培养基诱导孢子囊释放游动孢子进行比较尚未见报道。本试验发现致病疫霉在TW 和SDW 中孢子囊游动孢子的释放率均显著高于V8 和RL,获得的游动孢子浓度同样也显著高于V8 和RL,这与Michael 等[8]得出的结论相同,即营养物质含量较少的培养液更有利于诱导孢子囊产生游动孢子。
目前在一些植物抗病性鉴定试验中有时采用经过培养的致病菌菌饼(或菌块)接种,该方法操作比较简便,但接菌量大小不易掌握,准确度不够高,且引起侵染和发病较为缓慢,而游动孢子是按照一定浓度和用量来接种,可明显提高抗病性鉴定的精确性,同时又有利于病菌侵染[19]。梁永刚等[20]在致病疫霉侵染马铃薯块茎切片的试验中发现,接种致病疫霉菌饼(φ=6 mm)3 ~4 d 后,切片开始发病,并有变色及萎缩的现象,但由于菌饼本身占据一定空间,在一定程度上影响试验的结果;孙晓慧[21]使用无菌水制备的大豆疫霉菌游动孢子接种大豆幼苗,24 h 即发病;本试验中使用不同培养液制备的游动孢子对马铃薯块茎切片进行侵染,24 h 后即可观察到发病情况,且发现由营养成分较高的培养液制备的游动孢子的侵染能力更高、活性更强。
作为植物病原菌定殖感染、增强抗药性的重要因子[22-23],生物膜已经成为了人们的研究热点之一,傅本重[24]采用结晶紫染色法分析了不同培养时间、培养温度和培养基对水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae)生物膜形成的影响,发现在M210 培养基中该菌成膜能力较强,在LB 中形成能力较弱;本研究中不同培养液对游动孢子成膜能力的影响存在显著性差异(P<0.05),其中V8 制备的游动孢子成膜能力最强,其次为RL,无菌蒸馏水制备的游动孢子成膜能力最弱,培养基对生物膜的影响可能主要是由于提供的营养条件与营养物质不同引起的[24]。
关于游动孢子的游动性,本试验中观察发现孢子囊释放游动孢子后,游动孢子在培养液中呈螺旋式绕圈运动。杨佳瑶等[15]发现抗病品种和感病品种的葡萄叶提取物,对葡萄生单轴霉菌(Plasmopara viticola)游动孢子的运动能力有不同影响,抗病品种巨峰的叶片提取物在浓度为5 mg/mL 时即可使游动孢子失去游动性,感病品种红乳和美人指叶片的提取物均在浓度为10 mg/mL 以上时才有抑制游动孢子运动的作用。Newhook 等人[25]在研究樟疫霉(P. cinnamomi)游动孢子的运动性和趋化行为时,发现细玻璃微珠、细砂或砂土混合物对游动孢子的运动能力几乎没有影响。这与本试验中观察到的不同培养液对致病疫霉游动孢子运动能力的影响无显著性差异相一致。
关于拮抗菌对致病疫霉游动孢子影响的报道主要集中于游动孢子的释放与侵染能力方面,关于成膜与运动能力较少,本研究室黄英菊等[11]对放线菌Sy11 及细菌SR13-2 影响致病疫霉游动孢子释放与萌发进行了研究,发现随着拮抗菌菌液浓度下降,游动孢子的释放率及萌发率均呈上升趋势;本试验通过前期游动孢子培养液的筛选,进一步分析了细菌HT-6 对致病疫霉游动孢子各项能力的影响,发现拮抗菌HT-6 对于游动孢子的释放、侵染、运动和成膜能力均有显著影响。不同浓度的HT-6 菌液可以在一定程度上抑制致病疫霉游动孢子的释放,并且显著降低块茎切片上的病情指数,有很好的防病效果,且随菌液浓度升高防病效果增强;此外,HT-6 菌液能显著抑制游动孢子的游动能力和生物膜形成能力。这些结果表明,细菌HT-6 可以通过影响游动孢子的各项能力来抑制致病疫霉,达到防治晚疫病的效果,这些结果深化了试验中对细菌HT-6 抑制致病疫霉的作用机制的认识,为下一步分离纯化抑菌物质并将其开发成抗马铃薯晚疫病生物制剂提供了试验依据,也为今后开发高效环保的生物农药提供了新的参考。
