hpaXm和hpaXm-IP基因对棉花角斑病菌V8表型及HR的影响
2020-06-01王清张勇跃孟凡奇刘志坚缪卫国
王清 张勇跃 孟凡奇 刘志坚 缪卫国

摘要:试验前期通过构建相应敲除载体,采用电转化的方法,分别获得Xanthmonas. citri subsp. malvacearum(简称Xcm)菌株的hpaXm基因缺失突变菌株V8ΔhpaXm和hpaXm-IP基因缺失突变菌株V8ΔhpaXm-IP。通过特殊生长平板及烟草接种试验表明,与V8菌株相比,突变菌株胞外多糖产量以及胞外纤维素酶、脂酶活性不变,V8ΔhpaXm菌株的胞外淀粉酶活性显著降低;3种菌株都不能产生胞外蛋白酶;突变菌株在烟草上形成的坏死斑面积变小。表明hpaXm和hpaXm-IP基因与病菌胞外淀粉酶活性及病菌激发烟草过敏反应的能力有关,与胞外多糖、纤维素酶、蛋白酶和脂酶产生无关。同时预示了hpaXm-IP可能具有牵引HpaXm蛋白泌出的能力,且HpaXm蛋白不是V8菌株中唯一激发烟草HR的活性物质,hpaXm及hpaXm-IP可能会影响V8菌株的致病性,但不是必然的。
关键词:棉花角斑病菌;细菌病害;表型;过敏反应;胞外多糖;胞外酶
中图分类号: S435.621.2+5文献标志码: A
文章编号:1002-1302(2020)08-0116-04
收稿日期:2019-03-08
基金项目:国家甘薯产业技术体系项目(编号:CARS-10-C-13);国家自然科学基金(编号:31360029、31160359);教育部博士点基金(编号:20124601110004、20104601110004);国家重大基础研究计划(编号:2011CB111612);国家农业产业技术体系建设(编号:CARS-34-GW8)。
作者简介:王 清(1988—),女,河南项城人,硕士,研究实习员,主要从事植物保护等研究。E-mail:1173823088@qq.com。
通信作者:缪卫国,博士,教授,主要从事分子植物病理等研究。E-mail:weiguomiao1105@126.com。
棉花细菌性角斑病是我国最早报道的重要细菌病害,在整个生育期都可侵染棉花,该病害对棉花生长过程造成较大的负面影响[1]。棉花角斑病菌于2006年正式定名为Xanthmonascitri subsp. malvacearum nov.comb.nov.nom.nov.(简称Xcm)[2],属黄单胞菌属的革兰氏阴性细菌,在含有营养琼脂的培养基平板上,菌落形态为近圆形,颜色逐渐由淡黄色变为蜡黄,边缘完整且微凸[1]。1986年决定病原菌对寄主植物致病性和诱导非寄主及抗病植物过敏性反应(HR)的hrp基因在菜豆晕斑病菌中被首次报道[3-4];1992年,人们从梨火疫病菌中发现由hrpN基因编码的第1个Harpin类蛋白HarpinEa[5],随后众多由hrp类基因编码的Harpin蛋白相继被克隆表达出来,目前大部分Harpin蛋白可激发烟草HR、异位效应等,且具有促生长等作用[6],对应编码基因被普遍研究。由于棉花角斑病菌V8小种存在限制性修饰系统,一直未能对其特定基因进行定点突变[7],因此关于hpaXm、hpaXm-IP基因对V8小种生物学特性和烟草过敏反应的影响暂未见报道。
hpaXm基因是从V8小种XCM143基因组DNA中克隆的全长为402 bp的序列[6],能编码定位于hrp区域的Harpin类蛋白HpaXm。缪卫国通过信号肽软件Signal 3.0 server对蛋白的二级结构进行预测和GST-HpaXm融合蛋白的表达进行检测,结果显示,HpaXm的N端前15个氨基酸是存在的信号肽,且信号肽缺失后该蛋白不能正常泌出胞外,hpaXm-IP则是编码该信号肽的长为45 bp的基因序列[2],这预示HpaXm蛋白的泌出方式可能不同于其他Harpin蛋白。本研究将突变菌株V8ΔhpaXm和V8Δhp6aXm-IP进行特殊营养琼脂培养基平板、营养肉汤培养基培养基生长试验以及烟草HR测定,分析hpaXm及hpaXm-IP基因对V8菌株生物学特性及其激发烟草HR能力的影响,以期为后续突变菌株致病性、Harpin蛋白泌出途径及缺失N端45个氨基酸对Harpin蛋白的影响等相关研究提供相关科学参考。
1 材料与方法
1.1 材料
1.1.1 相关基因 hpaxm基因从Xcm基因组中通过PCR扩增获得;hpaXm-IP基因为hpaxm基因中长为45 bp的编码HpaXm蛋白N端类似信号肽序列的一段基因。
1.1.2 菌株 试验用菌株棉花角斑病菌(Xanthmonas. citri subsp. malvacearum,Xcm)V8菌株(8号小种)从棉花上分离获得,V8ΔhpaXm-IP以hpaxm为靶基因构建敲除载体通过电转化野生菌Xcm同源重组获得;V8ΔhpaXm菌株以hpaXm-IP為靶基因构建敲除载体通过电转化野生菌Xcm同源重组获得[7]。
1.1.3 敲除载体 敲出载体的详细构建过程参照文献[7]。
1.1.4 植物 以盆栽种植的6~8叶期本氏烟烟株为试验植物。
1.1.5 试剂 氯化钠、牛肉浸膏、蔗糖、胰化蛋白胨、酵母提取物、琼脂、氢氧化钠[生工生物工程(上海)股份有限公司];卡那霉素、脱脂牛奶、可溶性淀粉、碘、碘化钾、羧甲基纤维素、刚果红、二水合氯化钙等(北京索莱宝科技有限公司)。
1.1.6 培养基 NB培养基:5 g聚蛋白胨,3 g牛肉浸膏,1 g酵母粉,10 g蔗糖,加水900 mL,搅拌至均匀,用5 mol/L NaOH调节pH值至6.8,定容至 1 000 mL,121 ℃灭菌20 min。NA培养基是在NB培养基的基础上加入20 g琼脂配制而成的。
1.2 菌株生物学特性的研究
胞外多糖产量的测定参考冯雯杰的方法[8],胞外酶等活性的测定参考Slater等的方法[9],其中胞外酶活性以水解圈或者透明圈直径和菌落直径大小的比值表示。
1.3 菌株激发的烟草过敏反应
菌株激发的烟草过敏反应参考李小杰的方法[10]进行检测。
2 结果与分析
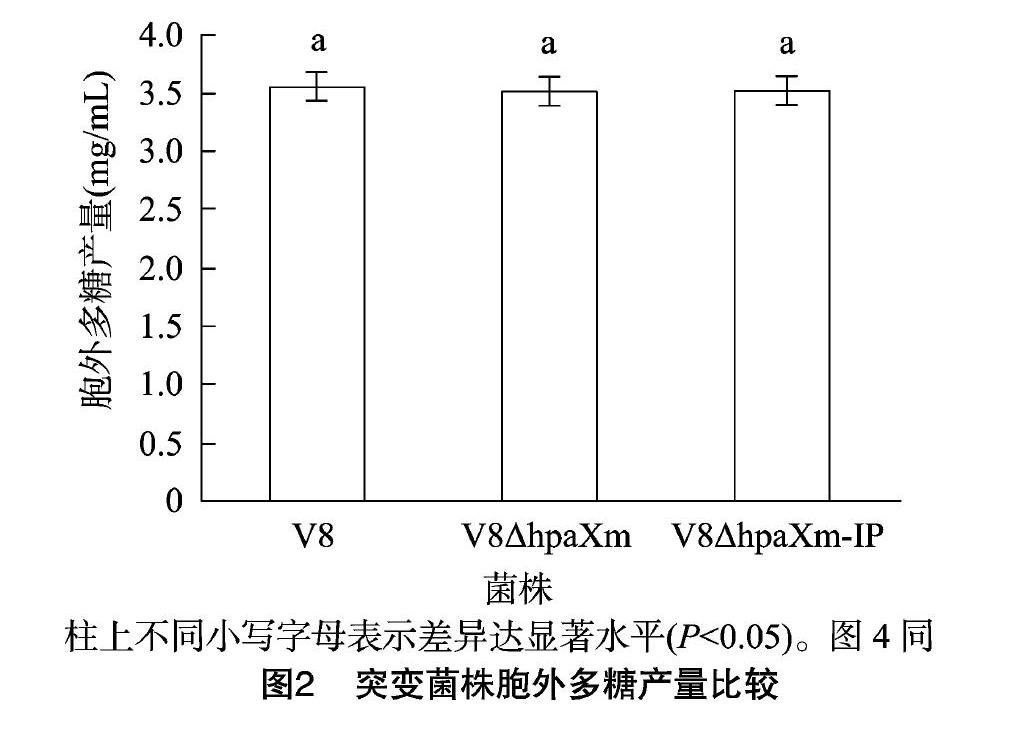
2.1 hpaXm及hpaXm-IP基因对V8菌株胞外多糖产量的影响
从图1可以看出,突变菌株1、3和野生菌株2的菌落形态及颜色基本一致,均表现为丰满、隆起,表面光滑且具光泽;统计学分析结果(图2)表明,突变菌株与V8菌株的胞外多糖产量并无显著差异。说明hpaXm及hpaXm-IP基因不具有调控V8菌株胞外多糖合成与泌出的作用。
2.2 hpaXm及hpaXm-IP基因对V8菌株胞外酶活性的影响
2.2.1 胞外淀粉酶活性变化 突变菌株单菌落周围形成的透明圈都变小(图3),统计学分析结果(图4)表明,V8ΔhpaXm-IP菌株与V8菌株的胞外淀粉酶活性大小无显著差异;V8ΔhpaXm菌株的胞外淀粉酶活性与V8菌株相比则显著上升。表明 hpaXm-IP基因对V8菌株的胞外淀粉酶活性没影响,hpaXm基因可在一定程度上抑制V8菌株胞外淀粉酶的活性或产生。
2.2.2 胞外纤维素酶活性变化 从图5可以看出,各菌株单菌落形成的透明圈大小基本一致,统计结果(图6)表明,V8ΔhpaXm、V8ΔhpaXm-IP菌株与V8菌株的胞外淀粉酶活性大小均无显著性差异。表明hpaXm及hpaXm-IP基因与V8菌株胞外纤维素酶的活性无明显相关关系。
2.2.3 胞外蛋白酶活性变化 从图7可以看出,3种菌株单菌落在脱脂牛奶平板上都不形成透明圈,表明V8菌株不能产生胞外蛋白酶。统计分析结果(图8)表明,V8ΔhpaXmV8和V8ΔhpaXm-IP菌株的菌落大小与V8菌株相比均极显著下降。表明hpaXm、hpaXm-IP基因影响V8菌株在脱脂牛奶平板上的生长能力。
2.2.4 胞外脂酶活性变化 从图9可以看出,突变菌株的单菌落周围形成的雪花状圈与V8菌株相比基本没变化,表明hpaXm及hpaXm-IP基因的缺失不影响V8菌株产生胞外脂酶的活性。
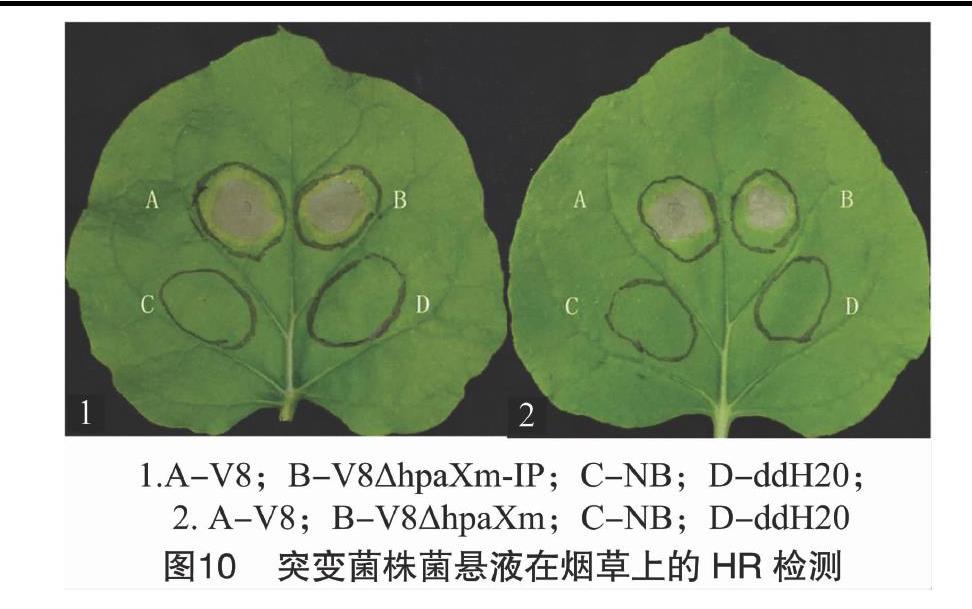
2.3 hpaXm及hpaXm-IP基因对V8菌株激发烟草HR能力的影响
从图10可以看出,在接种24 h后,突变菌株与V8菌株在烟草上的接种部位均可形成坏死斑,但突变菌株接种部位的坏死斑面积减小,初步推测,hpaXm及hpaXm-IP基因都能影响V8菌株激发烟草HR的能力。
3 讨论与结论
黄单胞菌产生的胞外多糖具有黏附性,能促使细菌附着于叶片上,不仅阻碍宿主水分运输,还能螯合激发免疫需要的信号Ca2+等,可抑制植物防卫反应机制,从而对其致病性起重要作用[3,11]。胞外酶可以帮助革兰氏阴性细菌降解摧毁植物的第1道防线——细胞壁,一旦发生分泌缺陷,其致病力会降低[12]。hrp基因突变对革兰氏阴性病原细菌激发非寄主植物HR和致使寄主植物发病能力的影响并不规律。
hpaXm基因缺失对V8菌株的胞外多糖产量及胞外纤维素酶、脂酶活性无明显影响,但使V8菌株胞外淀粉酶活性显著下降,且V8ΔhpaXm在烟草上形成的坏死斑面积变小。据报道,水稻白叶枯病菌一旦不能产生胞外蛋白酶,其致病性变弱且菌体繁殖数量减少[13];甘蓝黑腐病黄单胞菌的胞外蛋白酶也可能通过帮助其在寄主中扩展或克服寄主的防卫反应而參与致病过程[14],本试验发现,V8菌株自身无法产生胞外蛋白酶。研究表明,hpa2基因突变的野油菜黄单胞菌Xcc 8004激发非寄主植物HR的能力丧失[15];hrpN发生突变会导致梨火疫病菌的致病性和HR完全丧失[16];水稻黄单胞菌的hrpXoo基因则对水稻致病性和烟草过敏反应具有决定性作用[17];但hpaH基因突变后,菌株Xag Bra可激发非寄主植物番茄和白菜上产生HR,而使辣椒和烟草丧失了产生HR的能力[18]。V8ΔhpaXm菌株在烟草上形成坏死斑的面积仅仅变小,并未完全消失,说明hpaXm基因缺失会使V8菌株激发烟草HR的能力下降但不会丧失,hpaXm基因并不完全决定着V8菌株激发烟草HR的能力,HpaXm蛋白也不是V8产生的能够激发烟草HR的唯一活性物质。
hpaXm-IP基因缺失对V8菌株的胞外多糖产量及胞外纤维素酶、淀粉酶及脂酶活性无明显影响。V8ΔhpaXm-IP菌株在烟草上形成的坏死斑面积与V8菌株相比变小,说明hpaXm-IP缺失只是降低了V8菌株激发烟草HR的能力。一些Ⅲ型效应蛋白的分泌会依赖其N端序列,如若删除水稻黄单胞菌基因avrBs1 N端的第1~58个密码子,其编码蛋白将无法从T3SS泌出[19]。结合前期的相关预测推测,V8ΔhpaXm-IP菌株激发烟草HR的能力减弱,一方面可能是由于hpaXm-IP具有牵引HpaXm蛋白泌出的能力,hpaXm-IP基因的缺失使得HpaXm蛋白不能正常泌出胞外;另一方面可能是由于HpaXm蛋白激发烟草HR的部分功能区域是其前15个氨基酸片段。很多突变的革兰氏阴性病原菌通常一旦丧失了激发非寄主植物HR的能力,那么在寄主植物上的致病力也会相应的丧失[20],至于hpaXm及hpaXm-IP基因是否决定V8菌株在寄主棉花上的致病性,仍需要进一步深入研究。
参考文献:
[1]张明月. 棉花角斑病菌由ClpA_ATPase介导的逆境胁迫相关基因的功能[D]. 郑州:河南大学,2017.
[2]缪卫国. 转hpa1Xoo基因棉花抗病虫防卫反应与全基因组转录谱分析及棉花角斑病菌hpaXm基因的功能[D]. 南京:南京农业大学,2009.
[3]郑德洪. 水稻黄单胞菌白叶枯致病变种三对重要双组份信号传导系统调控机制研究[D]. 武汉:华中农业大学,2016.
[4]Herbers K,Conrads-Strauch J,Bonas U. Race-specific of plant resistance to bacterial spot disease determined by respetitious modifs in a bacterial avirulence protein[J]. Nature,1992,356(6533):172-174.
[5]Wei Z M,Qiu D,Kropp M J,et al. Harpin,an HR elicitor,activates both defense and growth systems in many commercially important crops[J]. Phytopathology,1998,88(9):S96.
[6]Miao W G,Wang J S. HpaXm from Xanthomonas smithii pv. smithii is a novel harpin protein with signal peptide[J]. Amino Acids,2009,37(S1):120-121.
[7]王 清,梁 鵬,李 响,等. 棉花角斑病菌遗传驯化体系的建立[J]. 江苏农业科学,2016,44(3):153-157.
[8]冯雯杰. 水稻黄单胞杆菌分子标记致病相关因子的鉴定[D]. 济南:山东农业大学,2014.
[9]Slater H,Alvarez‐Morales A,Barber C E,et al. A two-component system involving an HD-GYP domain protein links cell-cell signalling to pathogenicity gene expression in Xanthomonas campestris[J]. Molecular Microbiology,2000,38(5):986-1003.
[10]李小杰. 水稻黄单胞菌Hpa1与AvrBs2蛋白调控植物生长与抗病性研究[D]. 南京:南京农业大学,2013.
[11]李群良. 野油菜黄单胞菌野油菜致病变种一个与胞外多糖产生相关的基因的鉴定[D]. 南宁:广西大学,2002.
[12]Nomura K,Melotto M,He S Y. Suppression of host defense in compatible plant-Pseudomonas syringae interactions[J]. Current Opinion in Plant Biology,2005,8(4):361-368.
[13]Voulhoux R,Ball G,Ize B,et al. Involvement of the twin-arginine translocation system in protein secretion via the type Ⅱ pathway[J]. The EMBO Journal,2001,20(23):6735-6741.
[14]唐纪良. 野甘蓝黑腐病黄单胞菌胞外蛋白酶的致病作用[J]. 广西农学院,1992,11(1):81-84.
[15]姜伯乐,蒋国凤,黄佩芳,等. 野油菜黄单胞菌hpa2基因的突变及功能分析[J]. 广西农业生物科学,2008,27(3):206-211.
[16]Kim J F,Beer S V. HrpW of Erwinia amylovora,a new harpin that contains a domain homologous to pectate lyases of a distinct class[J]. Journal of Bacteriology,1998,180(19):5203-5210.
[17]陈功友,王金生. 植物病原细菌致病性决定因子[J]. 植物病理学报,2002,32(1):1-7.
[18]Kim J G,Park B K,Yoo C H,et al. Characterization of the Xanthomonas axonopodis pv. glycines Hrp pathogenicity island[J]. Journal of Bacteriology,2003,185(10):3155-3166.
[19]姜 佳,邹华松,李玉蓉,等. 水稻条斑病菌hrcC、hpa3和hrpE基因表达不依赖hrpG和hrpX基因调控[J]. 微生物学报,2009,49(8):1018-1025.
[20]陈功友. 水稻黄单胞(Xanthomonas oryzae)hrp基因克隆与特性研究[D]. 南京:南京农业大学,2000.
