响应面法优化舟山小带鱼蛋白抗菌肽制备工艺及其抑菌效果分析
2020-05-29何定芬郑霖波周英杰毛鹏权叶常青谢超
何定芬,郑霖波,周英杰,毛鹏权,叶常青,谢超,*
(1.浙江国际海运职业技术学院,浙江舟山316021;2.浙江海洋大学食品与医药学院,浙江舟山316022;3.舟山市常青海洋食品有限公司,浙江舟山316022)
带鱼(Trichiurus lepturu),在我国[1]乃至全世界[2],都是重要的经济鱼品种,是海洋渔业中的重要组成部分[3]。带鱼不仅肉质鲜美,口感顺滑,而且富含人体所必需的各类蛋白质,微量元素等,营养价值非常之高,是非常受欢迎的食品种类[4]。
我国带鱼年捕获量达到120万吨,其中夹带的低值小带鱼的比例在20%以上,且舟山作为中国最大的渔场,年捕捞量巨大,所以鱼类生产加工的原料非常丰富。目前低值小带鱼的加工方式较单一,主要是加工成饲料,缺乏高值化的加工方式,资源利用率低下,急需提高利用率[5]。目前国内外利用水产品制备抗菌肽的主要原料为鱿鱼[6]、罗非鱼[7]、大黄鱼[8]等,利用低值小带鱼制备抗菌肽的研究在我国鲜见报道。
量产制备抗菌肽最优的方法是酶解法,因酶解条件温和易控制无公害,被公认为最有前景的抗菌肽制备法[9]。故本研究以低值舟山小带鱼为原料,选用复合酶解法制备小带鱼抗菌肽,通过单因素试验确定复合酶种类,再结合响应面优化酶解工艺,并对其纯化,为小带鱼抗菌肽的制备提供理论依据,带来一定的社会效益和经济效益。
1 材料与方法
1.1 材料与试剂
舟山小带鱼,购于舟山老碶菜场,购买时将小带鱼放在加碎冰的泡沫箱中保存,在40 min内送到实验室,人工去除带鱼头部及内脏组织,在高速组织捣碎机中处理,得到小带鱼糜,将小带鱼糜装入保鲜袋中,每袋100 g,在-20℃环境下贮藏。试验时提前24 h将小带鱼糜取出,在4℃的冰箱冷藏室中解冻备用。
试验用酶见表1。
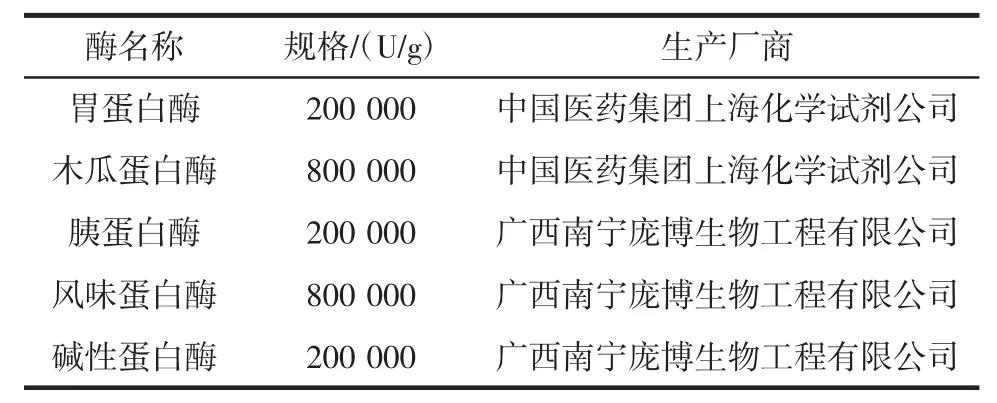
表1 试验用酶Table 1 Experimental enzymes
1.2 仪器与设备
仪器与设备见表2。
表2 仪器与设备Table 2 Instruments and equipment
1.3 方法
1.3.1 小带鱼抗菌肽的制备
取解冻好的舟山小带鱼糜10 g,溶于100 mL纯水中,调节pH值以及温度,到达蛋白酶的最适酶解pH值和温度,加入0.2 g/100 mL的蛋白酶[10];为获得好的酶解效果,在磁力搅拌机中搅拌10 min;放入180 r/min的摇床中酶解[11]。酶解完成后将酶解液进行灭酶处理(电热恒温水浴,95℃~100℃,20 min)。取灭酶后酶解液进行离心处理(4℃,8 000 r/min,15 min),离心完成后将中间清液取出,利用10 mL的离心管保存,保存时的环境温度控制在-20℃,并对其封口以防受污染,以备后续使用。
1.3.2 抑菌效果的测定
采用Dionysius DA等[12]的光密度法测定蛋白酶解液的抑菌效果,部分进行修改。选取指示菌为大肠杆菌,菌龄为18 h~24 h,菌浓度为107CFU/mL。各蛋白酶解液用0.22 μm滤膜过滤后,调节成一致浓度,各取2 mL,加入10 mL肉汤液体培养基中;同时加入200 μL指示菌,37℃培养24 h后测定其吸光值(A样品)。不加入菌悬液,剩余条件相同的为空白样品,测定其吸光值(A空样);2 mL灭菌生理盐水代替2 mL蛋白酶解液,剩余条件相同的为对照样品,测定其吸光值(A对照)。所有样品均进行3次平行试验。试验空白调零10 mL肉汤液体培养基和2 mL灭菌生理盐水混合液;测定吸光值时波长为570 nm,计算公式为式(1):

1.3.3 酶的筛选
选用胃蛋白酶、胰蛋白酶、风味蛋白酶、木瓜蛋白酶、碱性蛋白酶在各蛋白酶的最适酶解条件下进行酶解,获得酶解液。测定酶解液的抑菌率,通过对比抑菌率,选取两种抑菌效果最好的酶作为复合酶,复合酶质量比为1∶1。最适酶解条件及添加量[13]见表3。
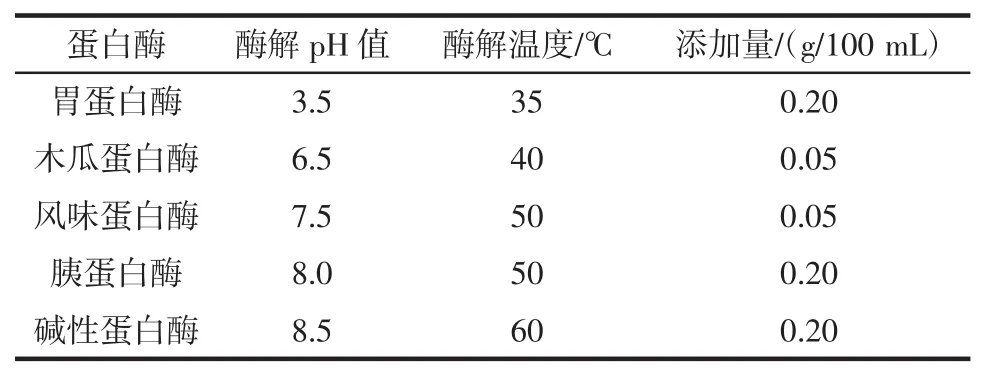
表3 二次酶酶解条件及添加量Table 3 Secondary enzyme enzymatic hydrolysis conditions and addition amount
1.3.4 单因素试验
在确定复合酶的筛选后,根据1.3.1节方法制备小带鱼抗菌肽,进行3个因素的试验:复合酶酶解时间(2、2.5、3、3.5、4、4.5、5、5.5、6 h)、复合酶酶解温度(25、27.5、30、32.5、35、37.5、40、42.5、45 ℃)以及复合酶酶解pH 值(3.5、4.0、4.5、5.0、5.5、6.0、6.5),单独考察上述变量下酶解液的抑菌效果,通过比较抑菌效果确定复合酶解各因素的最佳值。
1.3.5 响应面试验设计
使用软件Design-Expert 11.0进行响应面分析,确定复合酶解过程中的最适条件。响应面试验三因素为复合酶解时间、温度、pH值;响应值为抗菌率,最终得出优化结果。
1.3.6 水解度及蛋白质含量测定
氨基态氮含量的测定采用甲醛滴定法[14],水解度计算公式为式(2):

采用凯氏定氮法[15]测定酶解液中蛋白质浓度,每组做3个平行试验。
1.3.7 Sephadex G-25凝胶层析分离
最佳复合酶解条件下酶解制得小带鱼酶解液粗品,对粗品使用超滤法[16]获得超滤样品后用Sephadex G-25凝胶层析柱进行层析分离[17],测定280 nm[18]处吸光值。收集每一组分进行抑菌率的测定,选取抑菌率最好的组分进行下一步纯化。
1.3.8 反相高效液相色谱纯化
取1.3.7节获得的组分,采用莫加利等[19]的方法进行反相高效液相色谱纯化,测定280 nm处的吸光值。对每一组分进行抑菌率测定,选取最佳组分,达到纯化目的。
2 结果与分析
2.1 蛋白酶的筛选
不同蛋白酶酶解液对指示菌的抑菌效果见图1。

图1 不同蛋白酶酶解液对指示菌的抑菌效果Fig.1 Antibacterial effect of different protease hydrolysates on indicator bacteria
由图1可知,抑菌效果最强的蛋白酶种类为胃蛋白酶,其酶解得到的小带鱼酶解液抑菌率达到33.68%;木瓜蛋白酶酶解所得的小带鱼酶解液抑菌率次之,达到15.81%;而效果较差的是胰蛋白酶酶解得到的小带鱼酶解液,抑菌率为6.42%。风味蛋白酶与碱性蛋白酶没有表现出抑菌性,甚至对大肠杆菌的生长可能存在不同程度的促进作用。通过对比抑菌率,本试验验最终选取复合酶制剂组合为胃蛋白酶和木瓜蛋白酶,以此复合酶酶解制备小带鱼抗菌肽。
2.2 单因素试验
2.2.1 复合酶酶解时间对抑菌效果的影响
酶解条件固定值为:复合酶酶解温度35℃,pH 4.5。自变量为复合酶酶解时间,经过试验测得数据,结果见图2。

图2 复合酶酶解时间对酶解液抑菌率的影响Fig.2 Effect of enzymatic hydrolysis time on the inhibition rate of enzymatic hydrolysate
分析图2可得,在复合酶解时间从2 h延长到4 h的过程中,酶解液抑菌率呈现出增长趋势,并且在4 h的时候达到最高值,抑菌率为42.86%;出现此趋势的原因是伴随酶解时长的增加,有抑菌作用的多肽被不断酶解出来导致的。随着酶解时长的继续增加,抑菌效果较明显的下降,酶解时间在5 h时抑菌率为37.31%;抑菌效果的衰弱可能是因为具有抑菌性的多肽分子在长时间的酶解作用下进一步缩短肽链,导致原本具备的抗菌性消失[20]。酶解5 h~6 h时抑菌率变化很小,原因可能是底物蛋白中能够结合复合酶分子的所有酶切位点已被酶解,且有抗菌性的小分子肽不受复合酶酶解作用,因此抑菌性保持相对稳定。综上分析,复合酶解最适时间为4 h。
2.2.2 复合酶解温度对抑菌效果的影响
酶解条件固定值为:复合酶解时间4 h;复合酶解pH3.5。自变量为复合酶解温度,试验测得数据,结果见图3。
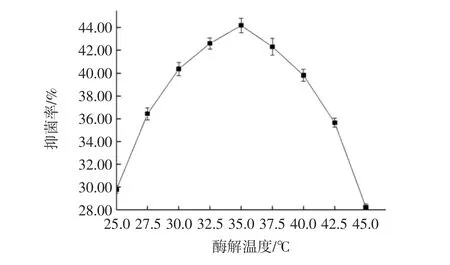
图3 复合酶酶解温度对酶解液抑菌率的影响Fig.3 Effect of enzymatic hydrolysis temperature on antibacterial rate of enzymatic hydrolysate
由图3可得,在复合酶酶解温度从25℃升高到45℃的过程中,酶解液抑菌率呈现出A型趋势,抑菌率最高值出现在35℃时,为44.19%。酶解温度从25℃升高至35℃时抑菌率的上升是因为复合酶活性增强以及分子之间自由碰撞概率上升,两者共同作用,同时促进了酶促反应[21];而在35℃到45℃区间内抑菌率明显从44.19%下降到28.23%,分析其原因是复合酶分子结构遭到热破坏,致使绝大部分的酶失活,进而导致了酶促反应的停滞,所以抑菌效果显著下滑[22]。由此,可以确定35℃是复合酶的最适酶解时间。
2.2.3 复合酶解pH值对抑菌效果的影响
酶解条件固定值为:复合酶解时间4 h、温度35℃;自变量为胃蛋白酶酶解pH值,试验测得数据,结果见图4。

图4 复合酶酶解pH值对酶解液抑菌率的影响Fig.4 Effect of enzyme hydrolysis on the antibacterial rate of enzymatic hydrolysate
由图4可得,在复合酶酶解pH值从2.5升高到4.5的过程中,酶解液抑菌率不断增长,抑菌率最高值出现在pH值为4.5时,为44.24%。在pH值继续升高至6.0时抑菌率迅速下降至21.19%,其原因可能是此时的pH值迅速远离复合酶中胃蛋白酶的最适酶解pH值,致使胃蛋白酶大量失活,胃蛋白酶主导的酶促反应基本停止,此时复合酶解过程中木瓜蛋白酶主导酶促反应。而在pH值区间为6.0~6.5时,胃蛋白酶基本不进行酶促反应,且此区间为木瓜蛋白酶作用的较适值,故而抑菌率变化较不明显。酶在作用时,所处的环境pH值对酶活影响明显,为了使酶活达到较高水平,应当调整pH值至该酶最适pH值区间,加强酶促反应中酶分子的结合能力,最终增强酶解效果[23]。由此,复合酶的最适酶解pH值确定为4.5。
2.3 响应面试验结果
2.3.1 响应面设计方案及结果
结合单因素试验结果,确定响应面试验三因素的设计水平,完成对三因素的设计方案,结合软件给出的具体组合着手试验操作,记录数据。其设计方案见表4,试验结果见表5。

表4 响应面设计试验因素与水平Table 4 Response surface design test factors and levels
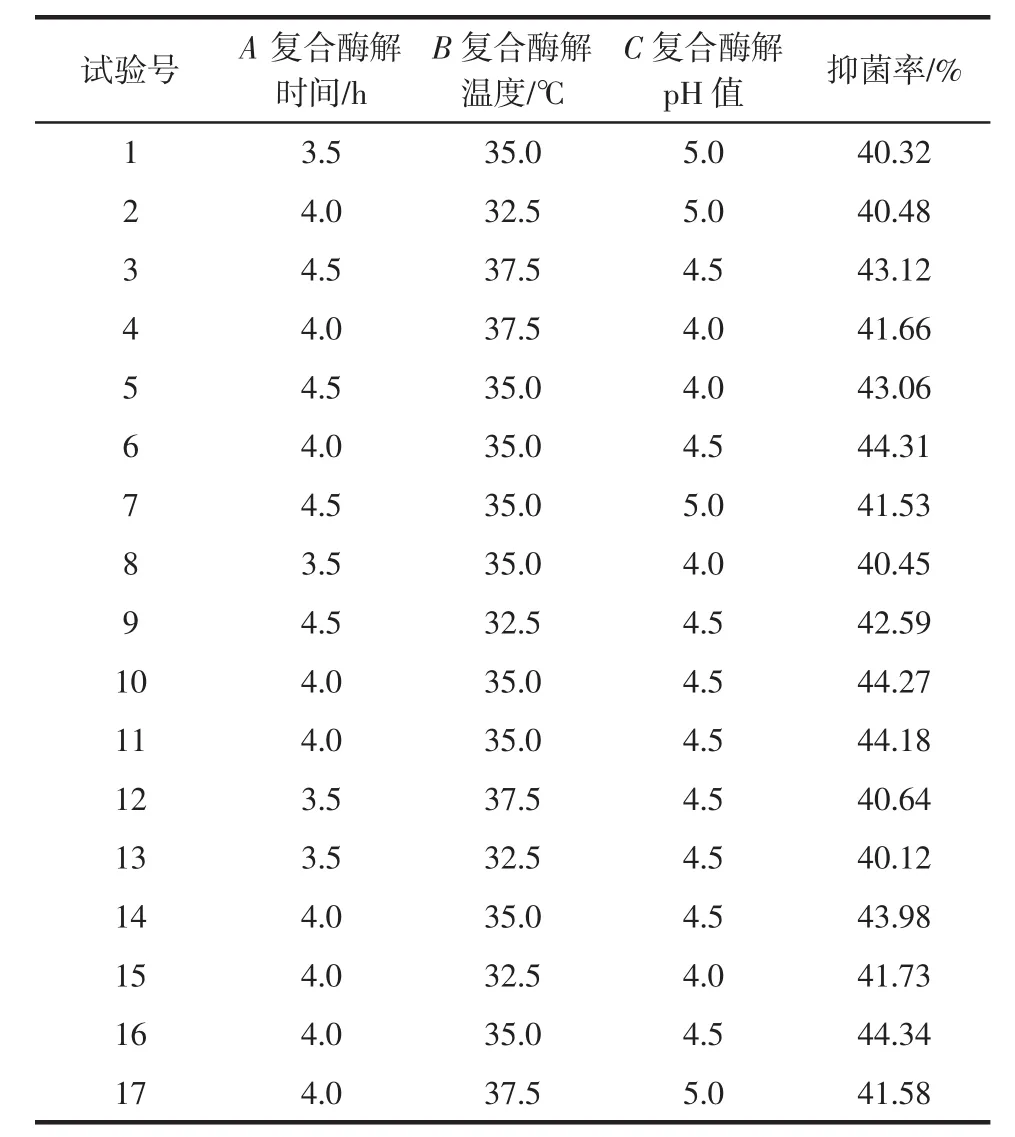
表5 响应面设计试验结果Table 5 Response surface design test results
2.3.2 回归方程建立及方差分析
对表5中数据进行分析,参照软件,得到三因素对抑菌率得率的二次多项回归方程如下:
Y=44.22+1.10A+0.26B-0.373 8C+0.002 5AB-0.35AC+0.292 5BC-1.31A2-1.29B2-1.57C2
对抑菌得率的影响程度大小表现为式中的各项系数的绝对值;单因素的影响方向为方程中各系数的正负号。回归方程的方差分析结果见表6。
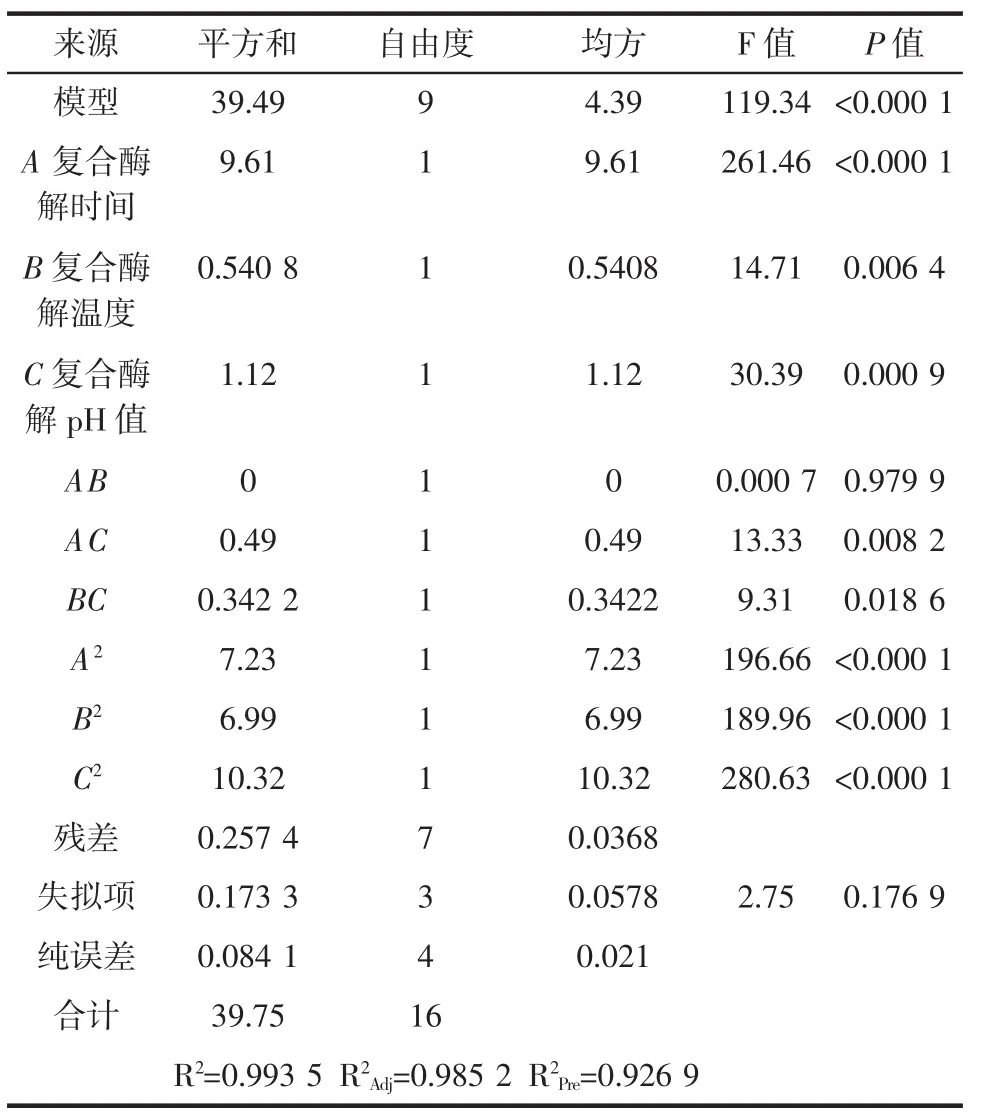
表6 回归模型方差分析Table 6 Analysis of variance(ANOVA)regression equation
分析表6,模型P<0.000 1,证明极显著;失拟项中P=0.176 9>0.05,F 值为 2.75,表明不显著;模型的回归系数 R2=0.993 5,R2Adj=0.985 2,R2Pre=0.926 9。综上可得,此模型拟合度较高,对响应中的各项变异能够解释,故此模型对小带鱼复合酶解条件能够很好地进行预测,能够得出较好的结果。
PA小于0.000 1,表明这一次项达到极显著水平,PB以及PC均小于0.05,表明这两个一次项达到显著水平;通过比较3个一次项A、B、C的F值大小可得,3个因素中对酶解过程的影响最大的是复合酶酶解时间,其次是复合酶解pH值,影响作用最小的是复合酶解温度。此外,在交互项中对酶解液的抑菌性影响不显著(P>0.05)的项是AB,而AC和BC两项对酶解液的抑菌性影响显著(P<0.05);所有的二次项(A2、B2、C2)对酶解液的抑菌性的影响极显著(P<0.01)。
图5所示的三维响应面图可以较直观的阐明3个交互项(AB、AC、BC)之间的相互作用[24]。经响应面分析,得到最佳的小带鱼复合酶解条件为复合酶水解时间4.2 h、复合酶解温度36.5℃、复合酶解pH值为4.4。
2.3.3 响应面最佳条件验证
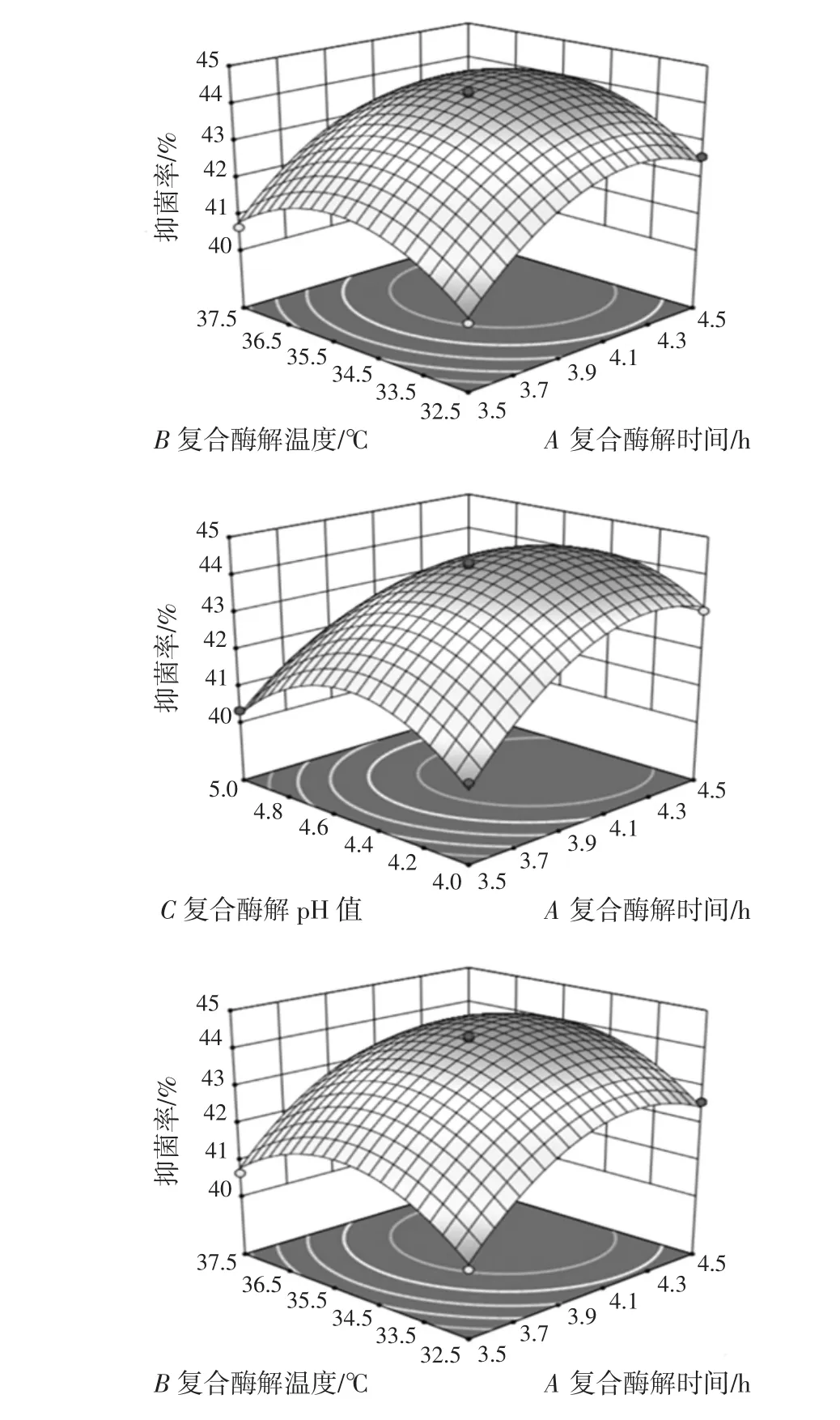
图5 酶解液对抑菌率的响应面分析Fig.5 Response surface analysis of enzymatic hydrolysate to inhibition rate
结合实际情况下的试验操作可行性,对小带鱼抗菌肽的制备条件进行一定程度上的修改,调整后复合酶解时间4.2 h、复合酶解温度36.5℃、复合酶解pH4.4。最终根据此条件酶解所得酶解液抑菌率44.48%,与响应面优化预测结果相差0.8%。由此可证,该试验设计的模型效果良好,优化作用真实有效。对比胃蛋白酶解得到的小带鱼酶解液抑菌,抑菌率提高了24.28%,证明利用复合酶解替代单酶酶解的制备工艺行之有效,能够获得更佳的小带鱼抗菌肽。在最佳酶解条件下测得酶解液的水解度为32.64%,蛋白质含量浓度为0.45 mg/mL。
2.4 Sephadex G-25凝胶层析分离
图6所示为超滤后的样品经Sephadex G-25凝胶层析后出现的3个组分,分别为T1、T2、T3。同浓度(1.0 mg/mL)[25]下测定各组分抑菌率,结果见表7。
表7 Sephadex G-25凝胶层析后各组分抑菌率对比各组分的抑菌率,选择T2组分进行下一步纯化
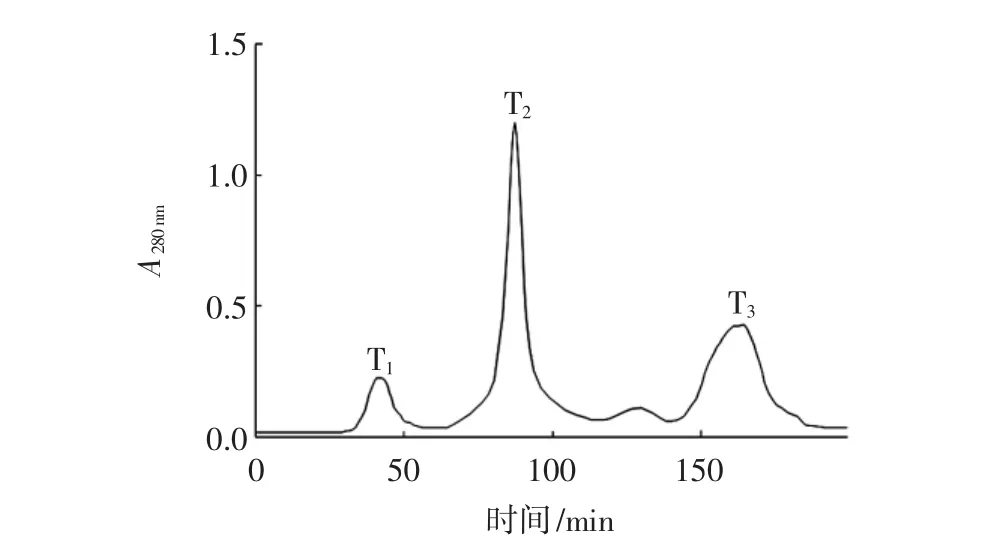
图6 酶解液超滤后Sephadex G-25凝胶层析Fig.6 Sephadex G-25 gel chromatography after ultrafiltration of the enzymatic hydrolysis solution

表7 Sephadex G-25凝胶层析后各组分抑菌率Table 7 Antibacterial rate of each component after Sephadex G-25 gel chromatography
2.5 反向高效液相色谱纯化
凝胶层析后样品反向高效液相色谱纯化结果见图7,反向高效液相色谱纯化后各组分抑菌率见表8。
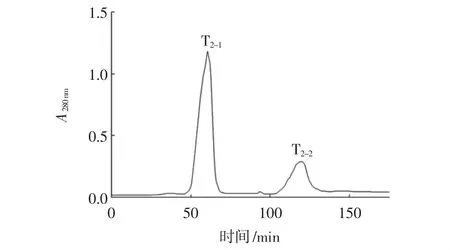
图7 凝胶层析后样品反向高效液相色谱纯化结果Fig.7 Purification results of samples after gel chromatography by reversed-phase high performance liquid chromatogra(RP-HPLC)

表8 反向高效液相色谱纯化后各组分抑菌率Table 8 Antibacterial rate of each component after RP-HPLC purification
对图7及表8分析得出,经反向高效液相色谱纯化后,只出现了两个峰,通过测定两者抑菌率,得出T2-1组分的抑菌率高达78.56%,相比纯化前的小带鱼酶解原液,抑菌率提高了77.61%,证明纯化效果显著。
3 结论
本文以舟山小带鱼为研究对象,优化了小带鱼抗菌肽制备工艺,同时探究其抗菌肽的抑菌效果,并对其纯化。经过试验得出的复合酶制剂组合为胃蛋白酶加木瓜蛋白酶;通过响应面优化了小带鱼抗菌肽的复合酶解条件,获得最佳酶解条件:复合酶解时间4.2 h、复合酶酶解温度36.5℃、复合酶酶解pH值为4.4,该条件下实际测得小带鱼复合酶解液抑菌率为44.87%,相比胃蛋白酶单独水解提高了24.28%,表明此复合酶解效果显著,能获得更好抑菌效果的抗菌肽。此时水解度为32.64%,蛋白质含量浓度为0.45 mg/mL。Sephadex G-25凝胶层析分离和反向高效液相色谱纯化后抑菌率为78.56%,提升了77.61%,纯化效果显著。该研究结果对酶解小带鱼制备抗菌肽的工艺及深入研究具有一定的指导意义。
本研究初步探究了小带鱼抗菌肽的制备及其抑菌效果,而该抗菌肽对其他代表性菌的抗菌效果以及抗菌机理未深入讨论。在此试验结果基础上,继续深入研究小带鱼等低值水产品抗菌肽,将其制成保健食品或在食品保鲜领域加以应用,达到高值化利用低值小带鱼的目的,带来一定的社会效益以及经济效益。
