四种β-环糊精制备鞣花酸包合物的抗氧化性研究
2020-05-15娄兴维罗志军胡鹏刚李家斌王绍江赵玲燕潘雪梅
娄兴维,罗志军,胡鹏刚 *,李家斌,王绍江,赵玲燕,潘雪梅
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵阳单宁科技有限公司,贵州 贵阳 550200)
鞣花酸(ellagic acid,EA)是没食子酸的二聚衍生物,是一种天然的多酚类化合物,广泛地存在于石榴、覆盆子、草莓、黑莓、核桃、枸杞等软果、坚果植物中[1]。鞣花酸具有许多有益的药理功能,如抗氧化,它具有较强的脂质抗氧化和捕捉自由基的能力[2],早有研究表明在体内鞣花酸对线粒体和微粒体中的脂质化合物有良好的抑制作用[3];抗癌、抗突变,特别是对结肠癌、食管癌、肝癌、肺癌、舌以及皮肤肿瘤等有很好的抑制作用,主要从抑制致癌物的代谢活动、消除致癌物的毒性和清除致癌物[4]等方面来抑制癌症。此外,鞣花酸还可预防和治疗炎症、糖尿病并发症、高血压和哮喘等[5-6]疾病,它的抗氧化性和增白功效也在化妆品中被普遍的使用。鞣花酸具有优异的药理功能,但它的溶解性却大大的限制了它的使用,因此需要改善鞣花酸的水溶性。
包合技术,简而言之就是将一种分子包藏于另一种分子的空穴结构内,形成包合物,常被使用在药物的制备中。而形成的包合物可以提高药物的溶解度、液体药物粉末化和防止挥发、调节药物释放速率来提高药物的生物利用度、掩盖药物的特殊气味和增加药物的稳定性等[7]。β-环糊精具有“内疏水,外亲水”的空腔结构,所以常常被用作包合材料。对β-环糊精(β-cyclodextrin,β-CD)进行化学结构修饰,得到β-CD衍生物,如羟丙基-β-环糊精(hydroxypropylβ-cyclodextrin,HP-β-CD)、二甲基-β-环糊精(dimethyl-βcyclodextrin,DM-β-CD)、磺丁基-β-环糊精(sulfobutyl-βcyclodextrin,SBE-β-CD),这些β-环糊精衍生物的水溶性就远远高于β-环糊精,包合物之间的水溶性也相差很大[8]。有研究表明,鞣花酸经过包合作用后溶解度增加了10倍[9],包合物有着更好的体外抗炎活性[10-11],生物利用度也会显著提高[12]。除此之外,包合技术应用广泛,如儿茶素[13]、阿魏酸[14]、白杨素[15]、壳聚糖[16]、芒果苷[17]等许多难溶于水的物质,与环糊精形成包合物后,溶解度显著增加,抗氧化性、稳定性和药理活性也随之增加。
利用β-CD、HP-β-CD、DM-β-CD、SBE-β-CD四种环糊精制备鞣花酸包合物,使其提高鞣花酸溶解度,使用高效液相色谱(high performance liquid chromatography,HPLC)测定其包合物中鞣花酸的含量和包合率,采用傅里叶红外光谱(fourier transfer infrared spectroscopy,FT-IP)、X-射线衍射(x-ray diffraction,XRD)、差示扫描量热分析、扫描电镜表征包合物是否形成,同时通过自由基清除能力评价鞣花酸包合物的抗氧化性强弱,为进一步开发和有效利用鞣花酸抗氧化性作为保健食品、化妆品等领域提供了一定的理论依据和参考。
1 材料与方法
1.1 材料与试剂
鞣花酸原样(纯度≥90%):贵阳倍隆生物科技公司;β-环糊精、羟丙基-β-环糊精、磺丁基-β-环糊精:山东滨州智源生物科技有限公司;二甲基-β-环糊精、邻苯三酚(均为分析纯):美国阿拉丁公司;鞣花酸标准品(纯度≥99%):美国Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):梯希爱(上海)化成工业发展有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS):上海源叶生物科技有限公司;三(羟甲基)氨基甲烷(tris(hydroxymethyl)aminomethane,Tris):国药集团化学试剂有限公司;邻菲罗啉、硫酸铁(均为分析纯):天津市政远化学试剂有限公司;过硫酸钾(分析纯):天津市大茂化学试剂有限公司。
1.2 仪器与设备
ATY224电子分析天平:日本岛津公司;HY-5回旋振荡器:金坛市富华仪器有限公司;-86 ℃冰箱:中国AUCMA股份有限公司;SCIENTZ-10N冷冻干燥机:宁波新芝生物科技股份有限公司;UV-2700紫外可见分光光度计:日本岛津公司;L6-P6高效液相色谱仪:北京谱析通用仪器有限公司;Bruker D8型X射线衍射仪:德国布鲁克公司;Nicolet IS50傅里叶变换红外光谱仪:美国赛默飞世尔科技公司;ΣIGMA+X-Max20电子扫描显微镜能谱仪:德国蔡司公司。
1.3 方法
1.3.1 包合物的制备
根据范高福等[9]制备石榴鞣酸-羟丙基-β-环糊精的方法,稍加修改制备四种鞣花酸包合物。精密称取鞣花酸样品0.151 0 g,加入乙醇溶解,同时按照摩尔比1∶2准确称取四种环糊精,分别用纯水溶解。将制取好的鞣花酸溶液在搅拌下缓慢滴入到环糊精溶液中,超声20 min后在室温下振荡搅拌36 h,再使用0.45 μm微孔滤膜过滤混合溶液,混合溶液放入-80 ℃冰箱中预冻24 h后放入真空冷冻干燥机干燥,即得包合物。
1.3.2 物理混合物的制备
精密称取鞣花酸样品0.151 0 g,按照摩尔比1∶2分别准确称取四种环糊精,将称取好的鞣花酸与环糊精直接混合即得。
1.3.3 鞣花酸包合物溶解度的测定
精密称取0.002 4 g鞣花酸标准品于100 mL容量瓶中用水定容,超声30 min,配制成0.024 mg/mL的标准品溶液待用。再分别取标准品0.024 mg/mL标准品溶液1 mL、2 mL、3 mL、4 mL、5 mL于10 mL容量瓶中加水定容。配制成0.0024mg/mL、0.0048 mg/mL、0.007 2mg/mL、0.009 6 mg/mL、0.012 0 mg/mL的鞣花酸标准品溶液,于波长254 nm条件下测定吸光度值,以鞣花酸标准溶液质量浓度为横坐标(X)、对应吸光度值(Y)为纵坐标绘制标准曲线,并对标准曲线进行线性回归,得回归方程。取10 mL水溶液于烧杯中,分别加入过量的鞣花酸和四种鞣花酸包合物,使之得到鞣花酸和鞣花酸包合物的饱和溶液,将饱和溶液经0.45 μm微孔滤膜过滤,分别稀释一定倍数后在254 nm处测量吸光度值,代入标准曲线回归方程,计算得到鞣花酸和鞣花酸包合物的溶解度。
1.3.4 鞣花酸包合物的包合率
鞣花酸包合物的包合率采用高效液相色谱(high performance liquid chromatography,HPLC)法进行测定,其色谱条件为[18]:Pgrandsil-STC-C18色谱柱(4.6 mm×150 mm),流动相乙腈-甲酸(1 mL/L)(17∶83,V/V),检测波长254 nm,进样量10 μL,流速1.0 mL/min,柱温30 ℃。
精密称取鞣花酸标准品12.30 mg,甲醇溶解,分别稀释成质量浓度为0.123 μg/mL、0.615 μg/mL、1.23 μg/mL、2.46 μg/mL、4.92 μg/mL、9.84 μg/mL、19.68 μg/mL的对照品溶液,使用HPLC测定其对应质量浓度下的峰面积,以溶液质量浓度(X)为横坐标、对应峰面积(Y)为纵坐标绘制标准曲线,并对标准曲线进行线性回归,得回归方程。再精密称取四种鞣花酸包合物适量,测定其峰面积,将测得的峰面积代入测得的线性回归方程得到四种包合物中鞣花酸的质量浓度,根据质量浓度计算包合物中鞣花酸的量,进一步求得到包合物的包合率,包合率计算公式如下:

1.3.5 傅里叶红外光谱表征包合物
分别取适量的鞣花酸、环糊精、物理混合物、包合物放入研钵中,加入溴化钾(KBr),研磨均匀后分别压片扫描,波数范围4 000~400 cm-1,分辨率4 cm-1。
1.3.6 X-射线衍射表征包合物
分别取适量的鞣花酸、环糊精、物理混合物、包合物,在CuKα辐射,管电压40 kV,管电流40 mA,所有样品均在10~80°之间的2θ角范围内测量,扫描速率10°/min,步长为0.017°。
1.3.7 扫描电镜表征包合物
分别取鞣花酸、环糊精、物理混合物、包合物适量,在加速电压5.0 kV下分别扫描各样品的形态。
1.3.8 抗氧化活性
(1)DPPH自由基清除试验
采用饶凤等[19]的方法,稍加修改测量鞣花酸包合物对DPPH自由基的清除率。分别称取四种鞣花酸包合物适量,配制成质量浓度为2.0μg/mL、4.0μg/mL、6.0μg/mL、8.0μg/mL、10.0 μg/mL鞣花酸包合物样品溶液。再准确称取DPPH 0.019 7 g,甲醇定容至100 mL得储备液,取10 mL储备液定容至100 mL量瓶中待用。在试管中加入1 mL样品溶液与3 mL DPPH溶液,混匀后在室温下避光静置30 min后,在波长517 nm条件下测定吸光度值A1。以1 mL甲醇代替样品溶液测定吸光度值A0,以3 mL甲醇代替DPPH溶液测定吸光度值A2。DPPH自由基清除率由以下公式计算:

(2)ABTS自由基清除试验
参照徐洪宇等[20]的方法,稍加修改。将7 mmol/L的ABTS溶液与2.45 mmol/L的过硫酸钾溶液等体积混合,室温下避光静置16 h,即得ABTS自由基储备液。用无水乙醇稀释该储备液,使其在734 nm处的吸光度值为0.7±0.2,即得ABTS自由基工作液。取不同鞣花酸包合物样品溶液1 mL,ABTS自由基工作液4 mL加入到试管中,静置6 min后于734 nm处测吸光度值,按以下公式计算ABTS自由基清除率:
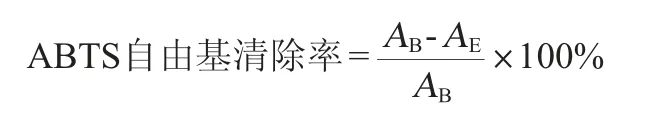
式中:AB、AE分别为空白组和样品组的吸光度值。
(3)羟基自由基清除试验
按照表1[21]反应液的组成,在试管中一次加入磷酸缓冲溶液、邻菲罗啉、硫酸铁溶液、样品溶液、蒸馏水和过氧化氢。然后将试管置于37 ℃恒温水浴锅中保温60 min,在波长510 nm处测定各组吸光度值,按照以下公式计算羟基自由基清除率:
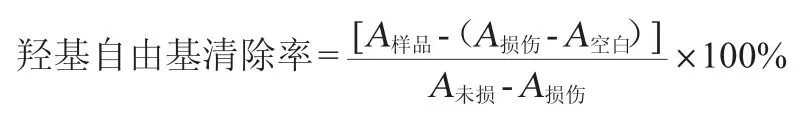
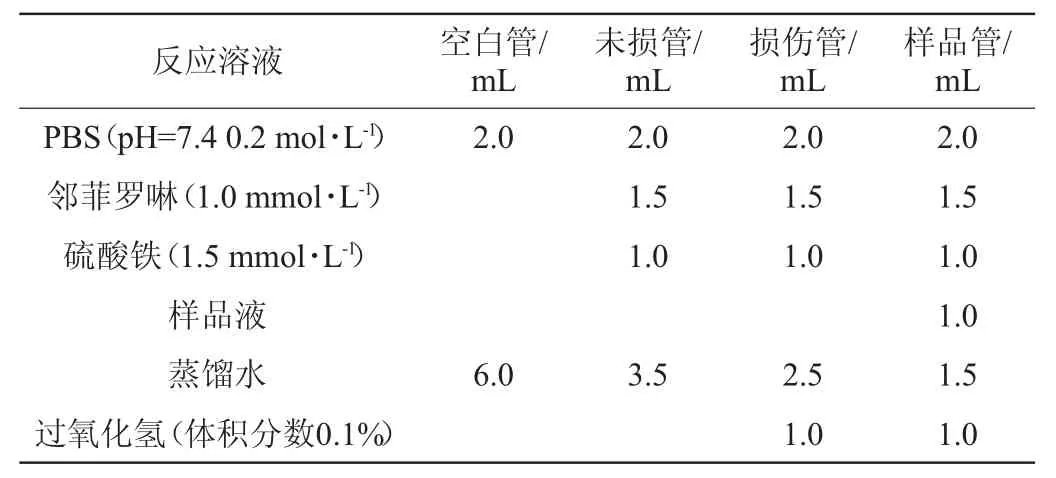
表1 反应液的组成Table 1 Compositions of reaction solution
(4)超氧阴离子自由基清除试验
以柏宏伟等[22]的方法,略作修改。向pH=8.2、5.7 mL、50 mmol/L Tris-HCl缓冲溶液中加入0.2 mL的四种鞣花酸包合物不同浓度的样品溶液,在25 ℃下保温10 min,然后加入25 ℃预热6 mmol/L的邻苯三酚0.1 mL,总体积6 mL。迅速摇匀反应1 min后在波长320 nm下测定吸光度值A,同时用相同浓度的样品溶液作参比,扣除样品本身颜色的干扰;另取试剂同上,等体积的Tris-HCl缓冲溶液+邻苯三酚溶液代替样品溶液,Tris-HCl缓冲溶液作空白,测定反应1 min时的吸光度值A0。按照以下公式计算超氧阴离子自由基率:
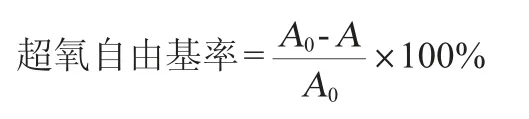
2 结果与分析
2.1 鞣花酸包合物溶解度的检测
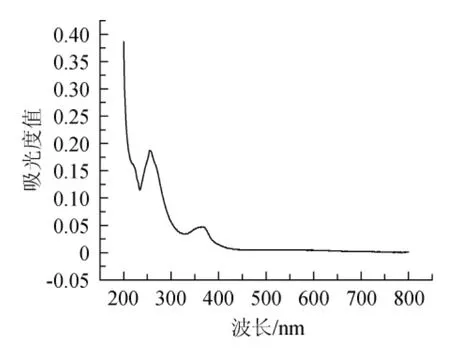
图1 鞣花酸紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of ellagic acid
取标准品溶液适量,以空白水溶液为对照,在200~800 nm波长下全波段扫描,结果见图1。由图1可知,测得鞣花酸的最大紫外吸收波长为254 nm,以鞣花酸质量浓度(X)为横坐标、吸光度值(Y)为纵坐标绘制标准曲线回归方程为Y=8.166 7X-0.006,相关系数R2=0.999 7。结果表明,鞣花酸在0.002 4~0.012 0 mg/mL范围内线性关系良好。经检测几种鞣花酸包合物的溶解度从低到高分别为:EA=0.011mg/mL、EA/β-CD包合物=0.0373mg/mL、EA/DM-β-CD包合物=0.0938mg/mL、EA/SBE-β-CD包合物=0.0956mg/mL、EA/HP-β-CD包合物=0.123 2 mg/mL,四种鞣花酸包合物相比单体鞣花酸,溶解度增加了240%、750%、770%、102‰。
2.2 HPLC法测定鞣花酸包合物的包合率
以鞣花酸质量浓度(X)为横坐标、对应峰面积(Y)为纵坐标,绘制标准曲线回归方程为Y=98 153X+2 670.9,相关系数R2=0.999 5,结果表明,在0.123~19.68 μg/mL范围内线性关系良好。测得EA/β-CD包合物、EA/HP-β-CD包合物、EA/DM-β-CD包合物、EA/SBE-β-CD包合物中的鞣花酸包合率分别为82.58%、89.80%、87.42%、84.64%。
2.3 鞣花酸包合物的表征
2.3.1 傅里叶红外光谱分析
四种鞣花酸包合物的傅里叶变换红外光谱图见图2。

图2 鞣花酸包合物的傅里叶红外光谱图Fig.2 Fourier transfer infrared spectroscopy of ellagic acid inclusion complexes
由图2可知,鞣花酸在波数3 474 cm-1处为-OH伸缩振动吸收峰,波数1 720 cm-1处为C=O伸缩振动吸收峰,波数1 617 cm-1、1 583 cm-1、1 510 cm-1处是苯环的典型特征吸收峰。β-CD、HP-β-CD、DM-β-CD、SBE-β-CD的FT-IR谱图分别在波数3 381 cm-1、3 414 cm-1、3 440 cm-1、3 432 cm-1处显示的宽吸收峰为-OH伸缩振动吸收峰。物理混合物的FT-IR谱图中观察到鞣花酸的特征吸收峰,可以看出为鞣花酸与四种环糊精的FT-IR谱图的叠加。四种包合物EA/β-CD、EA/HP-β-CD、EA/DM-β-CD、EA/SBE-β-CD分别在波数3 385 cm-1、3 410 cm-1、3 419 cm-1、3 425 cm-1处有-OH的宽吸收峰,鞣花酸的-OH特征吸收峰消失,苯环特征吸收峰消失或减弱,包合物的C=O伸缩振动吸收峰已位移变化至波数1 641 cm-1、1 633 cm-1、1710 cm-1、1 654 cm-1处,表明鞣花酸已经包合在环糊精的空腔中,形成包合物。
2.3.2 X-射线衍射分析
四种鞣花酸包合的X-射线衍射见图3。

图3 鞣花酸包合物的X-射线衍射图Fig.3 X-ray diffraction of ellagic acid inclusion complexes
由图3可知,鞣花酸在13.98°、20.89°、23.68°、26.13°、28.01°、29.11°处有强烈特征尖峰,表明鞣花酸有晶体性质,β-CD在10.69°、11.7°、12.48°、14.71°、15.40°、16.09°、17.11°、18.86°、19.58°、20.77°、22.72°、24.30°、27.08°处有强烈特征尖峰,表明β-CD有晶体性质,且与EA晶体性质不同,其余三种环糊精的XRD谱图中显示出宽峰,无晶体衍射峰,无晶体性质。物理混合物的XRD谱图可以看出,物理混合物中可以找出鞣花酸的特征峰,表明物理混合物XRD谱图只是简单的叠加。然而在EA/β-CD包合物的XRD谱图中显示在11.97°、17.54°处出现新的晶体峰,鞣花酸的特征峰消失或减弱,表明EA/β-CD包合物形成。在其余三种鞣花酸包合物中也未出现鞣花酸的特征峰,表明鞣花酸已经被包合在环糊精的腔中,形成包合物。
2.3.3 扫描电镜分析
四种鞣花酸包合物的扫描电镜图见图4。
由图4可知,鞣花酸形态呈不规则絮状结构,β-CD、HP-β-CD、SBE-β-CD、DM-β-CD四种环糊精分别呈不规则块状结构、球形腔、球体腔、腔体碎片结构,在物理混合物中,可以观察出是鞣花酸与环糊精的混合形态结构,表明鞣花酸与环糊精是简单的混合,主客分子之间的形态并未改变,而包合物显示的结构中完全与物理混合物截然不同,EA/β-CD包合物呈现出规则的块状结构,EA/HP-β-CD、EA/DM-β-CD、EA/SBE-β-CD三种包合物中的球形腔体结构完全消失,表明包合物形成。

图4 鞣花酸包合物的电镜扫描图Fig.4 Scanning electron microscope of ellagic acid inclusion complexes
2.4 鞣花酸包合物抗氧化性试验
2.4.1 DPPH自由基清除分析
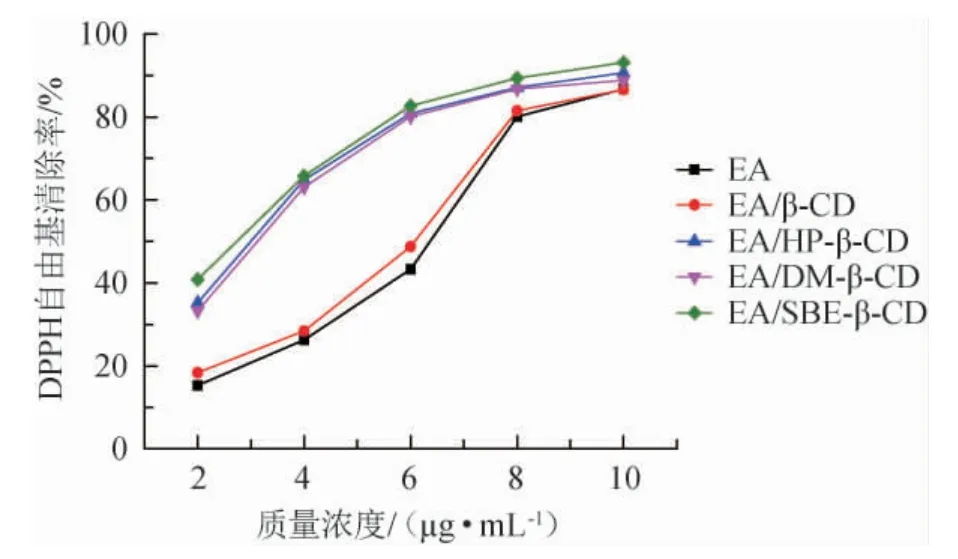
图5 DPPH自由基清除率Fig.5 Scavenging rate of DPPH free radical
由图5可知,在质量浓度2~10 μg/mL范围内,随着质量浓度的增加,鞣花酸以及四种包合物对DPPH自由基的清除率也随之增加,达到一定质量浓度时,清除率逐渐趋于平稳,这与刁玉林等[23]测定秀丽莓中鞣花酸抗氧化性得到的数据结果变化相似,只是达到相同清除率所需鞣花酸浓度不同,原因可能为不同样品之间含量不同。半数清除率半数清除率(50%elimination ratio,EC50)可以判断抗氧化能力的强弱,EC50值越小,表明物质抗氧化能力越强。鞣花酸和四种鞣花酸包合物EA/β-CD、EA/HP-β-CD、EA/DM-β-CD、EA/SBE-β-CD的EC50值分别为6.47 μg/mL、6.31 μg/mL、3.45 μg/mL、3.63 μg/mL、3.92 μg/mL,DPPH自由基的清除能力顺序为:EA/HP-β-CD>EA/DM-β-CD>EA/SBE-β-CD>EA/β-CD>EA。从EC50值可以得到鞣花酸包合物对DPPH自由基清除能力都高于鞣花酸,EA/HP-β-CD、EA/DM-β-CD、EA/SBE-β-CD包合物的DPPH自由基清除率相差不大,但明显高于EA,说明包合作用可以增加EA对DPPH自由基的清除能力。
2.4.2 ABTS自由基清除分析

图6 ABTS自由基清除率Fig.6 Scavenging rate of ABTS free radical
由图6可知,EA/β-CD、EA/HP-β-CD、EA/DM-β-CD、EA/SBE-β-CD四种鞣花酸包合物对ABTS均有较好的清除作用,随着质量浓度的加大,ABTS自由基的清除率也随之加大,达到一定浓度时,清除率趋于平稳。EA和EA/β-CD、EA/HP-β-CD、EA/DM-β-CD、EA/SBE-β-CD包合物的EC50值分别为13.53 μg/mL、12.11 μg/mL、7.00 μg/mL、7.66 μg/mL、7.77μg/mL,ABTS自由基的清除能力顺序为:EA/HP-β-CD>EA/DM-β-CD>EA/SBE-β-CD>EA/β-CD>EA。EA/HPβ-CD包合物清除ABTS自由基能力最强,EA/DM-β-CD、EA/SBE-β-CD包合物没有太大悬殊,但与EA相差很大,说明包合作用可以提高EA对ABTS自由基的清除能力。
2.4.3 羟基自由基清除分析

图7 羟基自由基清除率Fig.7 Scavenging rate of hydroxyl free radical
由图7可知,四种不同鞣花酸包合物对羟基自由基均有清除作用,在0.05~0.15 μg/mL时,鞣花酸和鞣花酸包合物对羟基自由基的清除率和鞣花酸质量浓度存在线性正比关系,0.15~0.25 μg/mL时,随着质量浓度的变化,羟基自由基的清除率变化逐渐平缓,虽与崔珊珊等[24]在研究树莓鞣花酸羟基自由基清除试验中浓度变化不同,但数据趋势变化类似。EA和EA/β-CD、EA/HP-β-CD、EA/DM-β-CD、EA/SBE-β-CD 包合物的EC50值分别 为0.133 6 μg/mL、0.136 3 μg/mL、0.108 2 μg/mL、0.108 3 μg/mL、0.105 5 μg/mL,羟基自由基的清除能力顺序为:EA/SBE-β-CD>EA/HP-β-CD>EA/DM-β-CD>EA>EA/β-CD,从EC50的数值得到,与其他类型自由基清除相比,羟基自由基EC50值的变化没有那么显著,但根据EC50值微弱的变化,以及图像中的清除率的变化,基本可以得出鞣花酸包合物的羟基自由基清除能力高于EA,说明包合作用可以提高EA对羟基自由基的清除能力。
2.4.4 超氧阴离子自由基清除分析
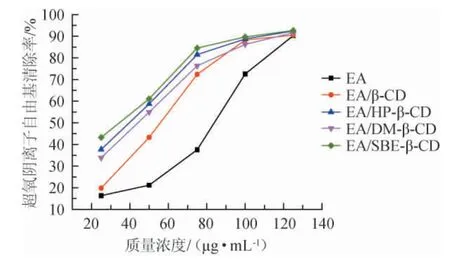
图8 超氧阴离子自由基清除率Fig.8 Scavenging rate of superoxide anion free radical
由图8可知,四种不同鞣花酸包合物对超氧阴离子自由基都具有较强的清除能力,与其他三种自由基清除有着类似情形,随着浓度的增加,自由基清除率也会随之增加,这与杨笑笑[25]提取石榴中鞣花酸超氧自由基清除试验得到的结果相似。EA和EA/β-CD、EA/HP-β-CD、EA/DM-β-CD、EA/SBE-β-CD包合物的EC50值分别为89.41 μg/mL、59.71 μg/mL、55.20 μg/mL、58.32 μg/mL、55.29 μg/mL,超氧自由基清除能力顺序为:EA/HP-β-CD>EA/SBE-β-CD>EA/DM-β-CD>EA/β-CD>EA。从EC50值可以看出,其中EA/HP-β-CD的超氧阴离子自由基的清除能力最好,与EA/DM-β-CD、EA/SBE-β-CD包合物差异不大,但四种鞣花酸包合物的明显高于EA,可以得出包合作用可以提高EA对超氧自由基的清除能力。
3 结论
本研究通过四种不同环糊精制备鞣花酸包合物,并使用HPLC测定包合物中鞣花酸的含量和包合率,采用傅里叶红外光谱、X-射线衍射、差示扫描量热分析、扫描电镜四种方法进行包合物的鉴定,同时通过自由基清除能力评价鞣花酸包合物的抗氧化性强弱。实验结果表明,EA/β-CD、EA/DM-β-CD、EA/SBE-β-CD和EA/HP-β-CD包合物的溶解度与单体鞣花酸相比,四种鞣花酸包合物溶解度分别增加了240%、750%、770%、102‰。四种包合物的DPPH自由基清除能力:EA/HP-β-CD>EA/DM-β-CD>EA/SBE-β-CD>EA/β-CD>EA,ABTS自由基清除能力:EA/HP-β-CD>EA/DM-β-CD>EA/SBE-β-CD>EA/β-CD>EA,羟基自由基清除能力EA/SBE-β-CD>EA/HP-β-CD>EA/DM-β-CD>EA>EA/β-CD,超氧自由基清除能力:EA/HP-β-CD>EA/SBE-β-CD>EA/DM-β-CD>EA/β-CD>EA。四种鞣花酸包合物的溶解度和清除自由基能力都优于单体鞣花酸,结果表明包合作用可以提高鞣花酸的溶解度与抗氧化性。
