高酸度水果果酒酿造产酯酵母的鉴定及发酵特性研究
2020-05-15邓梦菲陈延儒刘成梅付桂明
李 棒,邓梦菲,陈延儒,万 茵,刘成梅,付桂明
(1.南昌大学 食品学院 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 国际食品创新研究院,江西 南昌 330047)
酵母是果酒酿造过程中决定果酒品质、口感和风味的关键因素[1-2]。传统葡萄酒酿造过程中,除了酿酒酵母产酒精以外,常常伴有一些产酯(产香)酵母在发酵过程中起到增强特征果香味的作用[3]。有报道从各类水果果皮中筛得各种产酯酵母,包括戴尔有孢圆酵母(Torulaspora delbrueckii)[4]、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)[5]、异常威克汉姆酵母(Wickerhamomyces anomalus)和美极梅奇酵母(Metschnikowia pulcherrima)等[6-7]。同样,在白酒酿造过程中,酒醅中微生物的代谢作用会产生丰富的微生物代谢产物,这些物质直接或间接地形成了白酒突出而独特的香气风味特征。其中产酯酵母对于提高酒中主体香气(如乙酸乙酯、己酸乙酯、乳酸乙酯等)含量以及乙酸甲酯、辛酸乙酯等其他香气物质具有重要作用[8],大部分香味物质都具有明显的果香特性,将其应用于果酒酿造过程中能够较好地改善果酒的香气特性。徐丽萍等[8-9]分别从泸州大曲和安徽古井大曲中筛选得到数株产酯酵母,并发现它们具有良好的发酵特性。
本研究通过对本实验室前期从蓝莓果皮和特香型白酒酒醅中筛选得到的6株产酯酵母进行分子生物学鉴定和发酵特性(生长情况、产酒精、产总酯、耐受能力)研究,比较它们的发酵性能及对不同生长环境的抗逆性和耐受性。旨在筛选出适合用于果酒发酵的产酯酵母,用于高酸度水果果酒的生产,以提高果酒品质和改善酒的风味。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
分别从蓝莓果皮(江西思科有限公司种植园)及特香型白酒酒醅(江西省樟树市樟树贡酒业有限公司)中先后筛得40株酵母,通过形态观察、生理生化试验初步鉴定出6株产酯酵母,分别命名为E1~E6(菌株E1~E5来自特香型白酒酒醅,菌株E6来自蓝莓果皮)。
1.1.2 化学试剂
酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物科技技术有限责任公司;琼脂(生化试剂):北京索莱宝科技有限公司;苹果酸、果糖(均为分析纯):阿拉丁试剂(上海)有限公司;酵母脱氧核糖核酸(deoxyribonucleic acid,DNA)提取抽提试剂盒:天根生化科技(北京)有限公司;其余试剂均为国产分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g,蛋白胨20 g,酵母浸粉10 g,用蒸馏水溶解定容到1 000 mL,自然pH,121 ℃灭菌20 min。
酵母浸出粉胨葡萄糖琼脂(yeastextractpeptone dextrose agar,YPDA)培养基:YPD培养基中加入20 g/L的琼脂。
麦芽汁培养基:130 g/L麦芽浸粉,0.1 g/L氯霉素,自然pH,121 ℃灭菌20 min。
模拟葡萄汁合成培养基:100 g/L葡萄糖,100 g/L果糖,1.5 g/L酵母提取物,0.3 g/L柠檬酸,5 g/L酒石酸,5 g/L苹果酸,2 g/L硫酸铵,5 g/L磷酸二氢钾,0.5 g/L硫酸镁,0.2 g/L氯化钠和0.05 g/L硫酸锰。用0.5 mol/L氢氧化钠溶液将培养基的pH值调节至3.2。
1.2 仪器与设备
SP-756P紫外可见分光光度计:上海光谱仪器有限公司;PH50-3A43L-A光学显微镜:凤凰光学股份有限公司;2720 Thermal Cycler 聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技(中国)有限公司;ZHWY-2102C型恒温培养振荡器:上海智诚分析仪器制造有限公司;HWS-250型恒温恒湿培养箱:上海森信实验仪器有限公司;FE28型pH计:梅特勒-托利多仪器有限公司;ZDX-35BI型立式压力蒸汽灭菌器:上海申安医疗器械厂;JA5003分析电子天平:上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 菌种的活化及种子液的制备
菌株E1~E6在YPDA固体培养基上活化后,挑取酵母菌株接种于YPD液体培养基中,于28 ℃、180 r/min条件下摇床培养24 h至对数生长期,通过光学显微镜血球计数法计算菌体浓度,再将菌液用无菌水稀释至菌浓度为1×107CFU/mL,制成种子液。
1.3.2 菌种的鉴定及系统发育树的构建
将菌种活化后,液体培养至对数生长期,用酵母DNA提取抽提试剂盒进行菌株总DNA提取。利用通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')/ITS4(5'-TCCTCCGCTTATTGATATGC-3')对酵母5.8S rDNA ITS区序列进行PCR扩增,扩增条件参照文献[10]。PCR产物送至上海生工生物技术有限公司测序。所获5.8S rDNA ITS区序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)GenBank 数据库中利用Blast程序进行核酸序列比对,采用MEGA5.0软件中的邻接(neighborjoining,NJ)法构建系统发育树,并进行亲缘关系分析。
1.3.3 酵母菌株生长曲线的测定
将酵母种子液以1×105CFU/mL的接种量接种于YPD液体培养基中,于28 ℃、180 r/min条件下摇床培养,每隔4 h取1 mL菌液,血球计数法计算菌体浓度,绘制生长曲线。
1.3.4 酵母菌株发酵力的测定
采用CO2失重法[11],将活化好的菌种按1×105CFU/mL接种量接入麦芽汁液体培养基,于26 ℃条件下静置培养。每12 h测定1次质量,培养7 d。以CO2失质量为纵坐标,发酵时间为横坐标,绘制菌株发酵力曲线。
1.3.5 酵母产总酯能力测定
参照GB/T10345—2007《白酒分析方法》[12],将酵母种子液以1×105CFU/mL的接种量接种于麦芽汁培养基中,单向出气发酵栓密封,26 ℃静置发酵7 d,采用皂化中和滴定法,测定总酯产量。
1.3.6 酵母菌的耐受性测定
参照吴启凤等[13]方法略有改进后进行酒精、SO2、pH和高糖耐受性测定。
(1)酵母耐酒精能力测定
将对数生长期酵母种子活化液,以5×105CFU/mL接种量接入不同酒精度(3%vol、6%vol、9%vol、12%vol、15%vol、18%vol、21%vol)的模拟葡萄汁合成培养基中,在26 ℃下静置发酵培养3 d(每隔12 h振荡悬浮一次),采用光学显微镜血球计数法测定各菌液的酵母细胞生长数。
(2)酵母耐SO2能力测定
将对数生长期酵母种子活化液,以5×105CFU/mL接种量接入不同SO2质量浓度(0、50 mg/L、100 mg/L、150 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L)的葡萄汁合成培养基中,在26 ℃下静置发酵培养3 d(每隔12 h振荡悬浮一次),采用光学显微镜血球计数法测定各菌液的酵母细胞生长数。
(3)酵母耐pH能力测定
将对数生长期酵母种子活化液,以5×105CFU/mL接种量接入不同pH值(1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0)的模拟葡萄汁合成培养基中,在26 ℃下静置发酵培养3 d(每隔12 h振荡悬浮一次),采用光学显微镜血球计数法测定各菌液的酵母细胞生长数。
(4)酵母耐糖能力测定
将对数生长期酵母种子活化液,以5×105CFU/mL接种量接入不同糖含量(30%、40%、50%、60%、70%、80%)的葡萄汁合成培养基中,在26 ℃下静置发酵培养3 d(每隔12 h振荡悬浮一次),采用光学显微镜血球计数法测定各菌液的酵母细胞生长数。
1.3.7 数据处理
采用Excel 2013、Origin 9.0软件进行数据处理分析,SPSS 25.0进行数据单因素方差分析,MEGA5.0进行系统发育树构建。每组实验重复测定3次。
2 结果分析
2.1 菌株的分子生物学鉴定
6株酵母的5.8S rDNA ITS区序列的NCBI比对结果见表1,将其构建系统进化树所得6株酵母菌株之间的亲缘关系见图1。由表1可知,在ITS区,菌株E1与异常毕赤酵母(Pichia anomala)相似性为99.32%,菌株E2与库德里阿兹威毕赤酵母(Pichia kudriavzevii)相似性为100%,菌株E3与异常威克汉姆酵母(Wickerhamomyces anomalus)相似性为99.83%,菌株E4与光滑假丝酵母(Candida glabrata)相似性为99.65%,菌株E5与戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)相似性为99.22%,菌株E6与德巴利汉逊酵母(Debaryomyces hanseni)相似性为100%。可鉴定菌株E1为异常毕赤酵母(P.anomala)、菌株E2为库德里阿兹威毕赤酵母(P.kudriavzevii)、菌株E3为异常威克汉姆酵母(W.anomalus)、菌株E4为光滑假丝酵母(Candida glabrata)、菌株E5为戴尔凯氏有孢圆酵母(T.delbrueckii)、菌株E6为德巴利汉逊酵母(D.hanseni)。由图1可知,菌株E1(P.anomala)和E3(W.anomalus)位于同一小分枝,说明之间有很近的亲缘关系,在系统发育树上形成同一类群,而其余菌株各自亲缘关系差异明显,各自形成独立小分枝。在大分枝上菌株E1(P.anomala)、E2(P.kudriavzevii)、E3(W.anomalus)、E6(D.hanseni)亲缘性靠近,属于同一大分枝;菌株E4(Candida glabrata)、E5(T.delbrueckii)亲缘性靠近,属于同一大分枝。

表1 被测序菌株来源与相关菌株序列相似性Table 1 Sequence similarity between sequenced strains and related strains

图1 基于5.8S rDNA ITS区基因序列的产酯酵母菌系统发育树Fig.1 Phylogenetic tree of ester-producing yeast strains based on 5.8S rDNA ITS region gene sequence
2.2 酵母菌的生长曲线
对6株产酯酵母进行生长性能的测定并绘制生长曲线,结果见图2。

图2 6株产酯酵母菌生长曲线Fig.2 Growth curves of 6 strains of ester-producing yeast
由图2可知,6株酵母均在0~8 h处于延滞期,8 h后进入对数生长期,而菌株E1(P.anomala)和E3(W.anomalus)在20 h后进入平稳期,其余菌株均在32 h后进入平稳期,其中菌株E1(P.anomala)和E3(W.anomalus)在44 h后开始进入衰亡期。于洋等[14]认为非酿酒酵母一般在发酵前期生长旺盛,能够产生较高含量的香气物质,但随着酒精体积分数的不断升高其优势逐渐被酿酒酵母所替代。6株产酯酵母中,菌株E1(P.anomala)生长速度最快,4 h结束延滞期进入对数生长期,且能达到最高的菌体浓度,为10.5×108个细胞/mL,菌株E6(D.hanseni)生长速度最慢,32 h才结束延滞期进入对数生长期,48 h时菌体浓度为9.2×108个细胞/mL。但生长48 h菌体浓度最低的是E4(C.glabrata),仅为3.2×108个细胞/mL。刘灿珍等[15]研究发现,陆生伊萨酵母(Lssatchenkia terricola)、浅白隐球酵母(Cryptococcus albidus)、葡萄汁有孢汉逊酵母(H.uvarum)、美极梅奇酵母(M.pulcherrima)和戴尔有孢圆酵母(T.delbruecki)5株产酯酵母在0~5 h为延滞期,5~22 h为对数生长期,22 h后进入平稳期;原苗苗等[16]研究发现,H.uvarum、M.pulcherrima和T.delbruecki这三株产酯酵母在0~4 h为延滞期,4~14 h为对数生长期,14 h后进入平稳期。产酯酵母的生长速度存在一定差异,可能由于菌种个体差异及培养过程中基质条件动态变化引起的,菌株E1(P.anomala)生长速度最快,有利于酿造过程快速起酵。
2.3 酵母菌的发酵力
发酵力反映酵母发酵糖产生酒精能力的大小,可以衡量产酯酵母在厌氧条件下生存能力。发酵力越强,表明酵母在厌氧情况下生长优势明显,在混合发酵前期能累积更多的香气物质。6株酵母菌发酵力测定结果见图3。由图3可知,6株酵母菌种普遍在发酵后0.5~1.5 d之间生长最为旺盛。菌株E1(P.anomala)、菌株E3(W.anomalus)、菌株E4(T.delbrueckii)和菌株E5(C.glabrata)这4株菌株具有较强的发酵力,其中菌株E1(P.anomala)的发酵力最强,7 d最高总失质量为1.30 g,在发酵初期(1 d)时失量高达1.18 g/d,而菌株E2(P.kudriavzevii)和E6(D.hanseni)发酵力较弱,7 d总失质量分别为0.61 g和0.32 g,低于牛广财等[17]所报道的酿酒酵母发酵力最高值(2.73 g/d)。结果表明,菌株E1具有最好的生长和发酵性能。

图3 6株产酯酵母菌发酵力测定结果Fig.3 Determination results of fermentation abilities of 6 strains of ester-producing yeasts
2.4 产酯酵母产总酯能力
酯类物质是果酒香气物质的主要组成成分之一,总酯的高低可以在一定程度上反映酵母产生香气物质的情况。对6株产酯酵母所产生的总酯进行测定,结果见表2。由表2可知,菌株E1(P.anomala)和E4(C.glabrata)总酯产量分别为3.71 g/L和3.53 g/L,菌株E3(W.anomalus)产总酯能力最强,达3.91 g/L,菌株E6(D.hanseni)产酯能力最弱,仅为3.39 g/L。与许多研究报导的W.anomalus是产总酯能力强的酵母一致。史雁飞等[18]报道一株固定化后的W.anomalus所产总酯含量高达3.4 g/L。FAN G S等[19]报道W.anomalus能够有效地改善发酵过程中的香味物质,通过W.anomalus和Saccharomyces cerevisiae两种酵母的协同发酵不仅提高了乙酸乙酯的产量,还增加了β-苯乙醇和苯乙基的含量,从而改善了白酒的风味。菌株E3(W.anomalus)最高的产总酯能力可以为改善风味提供更大地潜能。

表2 6株产酯酵母菌株产总酯结果Table 2 Results of total ester production capacity of 6 strains of ester-producing yeasts
2.5 产酯酵母耐受性比较
2.5.1 酒精耐受性比较
由图4可知,在酒精耐受性方面,6株产酯酵母普遍在6%vol酒精度下能够具有良好的生长状态,当酒精度>9%vol之后生长受到较大抑制,菌体生长细胞数显著下降。其中菌株E1(P.anomala)对酒精耐受性最强,在9%vol酒精度下生长状态最好;菌株E6(D.hanseni)对酒精最敏感,在6%vol酒精度下生长就基本被完全抑制。刘灿珍等[15]报道中产酯酵母的生长随着酒精度的增长呈下降趋势,且在酒精度到达6%vol时生长量骤然下降,于洋等[14]也报道3株非酿酒酵母,东方伊萨酵母(Issatchenkia orientalis)、发酵毕赤酵母(Pichia fermentans)和季也蒙有孢汉逊酵母(Hanseniaspora guilliermondi)在酒精度到达6%vol之后抑制效果显著。张莉等[20]认为,耐酒精能力强的酵母菌株可以发酵更加完全、彻底。菌株E1(P.anomala)良好的酒精耐受性能,使其在果酒发酵中可维持良好的生存状态,累积更多的香味物质,满足果酒酿造的需要[21]。

图4 6株产酯酵母菌酒精耐受能力比较Fig.4 Comparison of alcohol tolerance of 6 strains of ester-producing yeasts
2.5.2 SO2耐受性比较
在果酒酿造过程中,适量SO2可以抑制某些微生物(包括乳酸菌和醋酸菌)的生长,防止果酒的二次发酵和果酒的腐败。但是SO2添加量太多会影响酵母的活性,使其发酵迟缓,酒体变苦[10]。因此,良好的SO2耐受性可以保证产酯酵母在发酵前期不受SO2添加量的影响。由图5可知,6株酵母均在SO2<200 mg/L的质量浓度下能够良好的生长;当SO2质量浓度>200 mg/L之后,6株酵母的生长逐渐受到抑制,随着SO2质量浓度升高,抑制效果越显著,其中菌株E5(T.delbrueckii)对SO2耐受性最强,300 mg/L SO2质量浓度下仍能良好的生长,菌株E3(W.anomalus)对SO2耐受性最弱,与张莉等[20,22]报道筛选酿酒酵母菌株研究结果相符。

图5 6株产酯酵母SO2耐受能力比较Fig.5 Comparison of SO2 tolerance of 6 strains of ester-producing yeasts
2.5.3 pH耐受性比较
酵母酸度耐受性差可能导致发酵初期起酵速度缓慢,严重时甚至会提前终止果酒发酵[1]。因此筛选出对低pH高耐受性的菌株对于果酒至关重要。蓝莓果实中果汁的pH约为3.2,青梅、李子等水果pH约为3.0。对低pH的耐受性是优良蓝莓酿造酵母的重要值特性。由图6可知,6株产酯酵母在pH 3.5~5.0能够呈现良好的生长状态,而产酯酵母E1(P.anomala)和E4(C.glabrata)pH耐受性最强,在pH 3.0的培养基中能良好的生长,分别达到菌体浓度5.47×107个细胞/mL和6.17×107个细胞/mL。另外,菌株E6(D.hanseni)pH耐受性最差,只能在pH 4以上才能正常生长。石阳明等[23]从沙果和桃子中筛得8株产酯酵母在pH 2.5的条件下开始缓慢生长,在pH 3.5之后生长状态良好,与本研究基本相符。

图6 6株产酯酵母pH耐受性比较Fig.6 Comparison of pH tolerance of 6 strains of ester-producing yeasts
2.5.4 高糖耐受性比较
在一些甜型果酒酿造过程中,需要额外添加一定量的蔗糖保证发酵后的酒精度和甜度,但发酵醪糖度过高,会使酵母细胞处于高渗透压环境,生长受抑制。对糖度耐受性强的菌株可以更好地适应环境,快速地生长[14]。6株产酯酵母糖耐受性结果见图7。
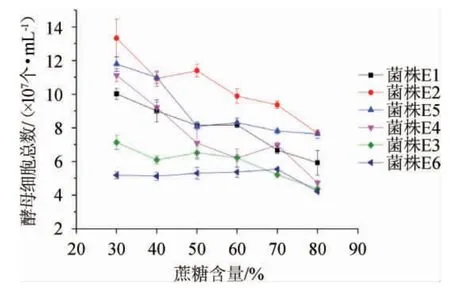
图7 6株产酯酵母高糖耐受性比较Fig.7 Comparison of high sucrose tolerance of 6 strains of ester-producing yeast
由图7可知,在糖度<70%时受高糖抑制效应影响较小,糖度>70%则随着蔗糖浓度升高抑制效果显著增强,但菌株E2(P.kudriavzevii)在高蔗糖环境下生长最好,菌株E6(D.hanseni)在高蔗糖环境下生长最差。
3 结论
对前期从蓝莓果皮及特香型白酒酒醅中筛得的6株产酯酵母进行分子生物学鉴定,确定它们的种属和物种亲缘性。同时通过生长曲线和发酵力的测定,比较了这6株产酯酵母好氧及厌氧情况下的生长状况及产气能力。
结果表明,菌株E1(P.anomala)具有最快的生长速度和最强的发酵力。通过产总酯能力比较发现,菌株E3(W.anomalus)产总酯能力最高达3.91 g/L,其次是菌株E1(P.anomala)总酯产量为3.71 g/L。菌株E1(P.anomala)对酒精耐受性最强,在9%vol酒精浓度下可以呈现良好生长状态;且在SO2<200 mg/L的质量度下,pH 3.0的培养基环境中,蔗糖含量<70%时能够良好的生长。所以菌株E1(P.anomala)是具有突出的起酵、产总酯能力和较好的耐受性能菌株,可作为蓝莓等高酸度水果果酒酿造的优良产酯酵母菌株。
