山羊基因组与遗传变异图谱研究进展
2020-05-13李晓凯范一星乔贤张磊王凤红王志英王瑞军张燕军刘志红王志新何利兵李金泉苏蕊张家新
李晓凯 范一星 乔贤 张磊 王凤红 王志英 王瑞军,2,3 张燕军,2,3 刘志红,2,3 王志新 何利兵 李金泉,2,3 苏蕊,2,3 张家新
(1. 内蒙古农业大学动物科学学院,呼和浩特 010018;2. 农业部肉羊遗传育种重点实验室,呼和浩特 010018;3. 内蒙古自治区山羊遗传育种工程技术研究中心,呼和浩特 010018;4. 内蒙古金莱牧业科技有限责任公司,呼和浩特 010018)
基于考古学和遗传学等方法的研究表明,家山羊是约在10 000 年前的新石器时代由西亚肥沃新月地带的野山羊(Bezoars,Capra aegagrus)驯化而来,是最早驯化的反刍动物之一[1-2]。随着人类的迁徙与演化,山羊是目前全球范围内分布最广泛的牲畜物种之一,主要用于生产肉、奶、皮和毛(绒)等农业生产资源[3-4]。据统计资料显示,全世界范围内共有10 亿多只不同生产用途的山羊饲养在各种生态区内,超过90%的山羊分布在亚洲和非洲;其次是美洲、欧洲和大洋洲,包括肉用、乳用、皮毛用、绒毛用和普通山羊等不同生产用途的576 个山羊品种(http://www.fao.org/faostat/en/)[4-5]。山羊是发展中国家农牧民重要的家畜之一,但相对于奶牛、家猪、绵羊和家马等经济效益较高的牲畜品种,山羊的分子生物学研究和遗传育种工作总体相对落后,严重阻碍了发展中国家贫困偏远地区的经济发展[6]。
随着人类基因组计划的实施与完成,单核苷多态性(Single-nucleotide polymorphism,SNP)因具有数量多,分布广泛,易于快速、规模化筛查,便于基因分型等特点,已成为动物种质资源遗传多样性评估和基因功能定位研究的有力工具[7-9]。高通量测序技术的应用极大地促进了家畜基因组组装和遗传变异检测的研究[10-11],如家牛[12]、家马[13]、家猪[14]、山羊[15]和绵羊[16]等参考基因组组装以及第一款家牛商业化芯片的研制[17]。2010 年,国际山羊基因组协会(International goat genome consortium,IGGC)成立,标志着高通量测序(Next generation sequencing,NGS)技术开始广泛应用于山羊的基因组研究[18-19];2013 年完成了世界上首个山羊参考基因组草图[15],并推出Goat SNP50K 磁珠芯片[20]和66K 目标捕获芯片[21]。2017 年,Bickhart 等[22]组装的近乎完整的参考基因组精细图谱ARS1,为山羊功能基因的精细定位提供了更加可靠的基因组信息。通过对基因组的重测序、简化基因组测序、外显子测序和RNA-seq 等技术方法,与参考基因组(CHIR_1.0、CHIR_2.0 和ARS1)比对,获得了大量的遗传变异信息,为更全面的揭示山羊的遗传多样性、环境适应以及人工选择反应提供了遗传标记信息。因此,本文主要对山羊基因图谱(遗传图谱、物理图谱、转录图谱与表达图谱)以及分子遗传变异信息的检测进展进行了综述,以期为进一步利用参考基因组信息和遗传变异标记对山羊进行经济性状的遗传基础研究和分子育种提供参考。
1 山羊基因组图谱
1.1 遗传图谱
1996 年,Vaiman 等[23]基于微卫星标记和共线性分析,利用12 个半同胞家系山羊(萨能奶山羊和阿尔卑斯山羊杂交种)构建得到了低分辨率的连锁图谱,并利用荧光原位杂交技术(Fluorescence in situ hybrid,FISH)确定了204 个微卫星标记;最终得到全长为2 300 cM 的连锁图谱,覆盖了山羊基因组长度的80%。1998 年,Schibler 等[24-25]构建了山羊BAC 文库,并通过ZOO-FISH 技术在山羊染色体上定位了202 个基因,同时在已有的山羊遗传图谱上增加了30 个微卫星标记,以此构建的细胞遗传-遗传连锁合成图含有307 个微卫星标记257 个基因,遗传图谱长度约2 737 cM,覆盖了山羊基因组的88%。2005 年,Maddox[26]对绵羊和山羊的遗传图谱进行比较,结果显示有218 个公共共有基因座,同时发现它们的同源基因座在图中的位置很一致。
1.2 物理图谱
1975 年,Goss 和Harris[27]共同创立了体细胞杂交技术,即辐射杂交(Radiation hybrid,RH)基因组作图技术,其原理是用辐射来诱导染色体断裂,并将辐射过的细胞与正常细胞进行杂交,获得含有染色体片段的杂种细胞。随后利用辐射杂交技术成功在人类、家属、家牛等不同物种中构建了基因组长范围的高分辨连续物理图谱,极大了促进了人类、小鼠及不同家畜物种的基因组研究进展。Du 等[28-29]利用辐射杂种嵌板技术,首次构建了山羊全基因组辐射杂种图谱(CHIRH5000),为标记密度最高的的辐射杂种图谱。随后,更多的标记定位在山羊细胞遗传-遗传连锁合成图,这些研究和相应建成的山羊图谱数据(http://locus.jouy.inra.fr)加深对哺乳动物染色体进化的了解,加速反刍动物图位克隆的研究[30]。
1.3 EST与转录表达图谱
基因组中仅包括2%左右的序列为编码蛋白质,表达序列标签(Expressed sequence tags,ESTs)和RNA-seq 测序可以最有效率的进行基因识别。构建生物特定组织、器官或细胞的cDNA 文库并进行大规模EST 测序和RNA-seq 测序分析,能直接获得大量的功能基因结构及表达特征,并以此来构建各种组织器官的基因表达谱和对基因组结构和功能进行注释。1996 年,Le Provost 等[31]首次采用泌乳期的山羊乳腺组织构建了cDNA 文库,经过筛选对其中的435 个cDNA 克隆进行EST 测序,确认了77 个与山羊泌乳有关的基因或者蛋白。2000 年,Le Provost等[32]进一步采用图位克隆的技术,结合EST 测序和细胞遗传定位技术鉴定了25 个可能与产奶性状有关的新的基因,其中6 个定位在牛的产奶QTL 区域。
RNA-seq 技术与生物信息学的快速发展,为理解基因组结构和基因功能奠定了基础。Dong 等[15]对云南黑山羊不同组织(肝脏、心脏、肺、肾脏、脾脏、淋巴结、前脑皮层、肌肉、膀胱和卵巢)的mRNA 进行了转录组测序,为基因功能注释奠定了坚实的基础。不同组织、细胞的非编码RNA 的检测研究,如miRNA(乳腺[33]、皮肤毛囊[34-35]、卵巢[36]、垂体[37]、真皮乳头细胞[38],以及背最长肌[39])、LncRNA(骨骼肌[40]、卵巢[41]和毛囊[42])等的分析研究,也为精细山羊基因组的功能结构、调控元件和基因功能注释提供了数据支持。
1.4 参考基因组组装
2010 年3 月,国际山羊基因组合作联盟(International goat genome consortium,IGGC)在中国深圳正式成立,由中国科学院昆明动物所、深圳华大基因和内蒙古农业大学等10 多个国家的20 个科研机构或组织参与,旨在通过国际间的交流合作,加快山羊基因组图谱构建、山羊遗传多样性、环境适应基础和分子育种等方面的研究进展[43]。通过各个研究机构的合作努力和不同的技术方法,先后构建了家山羊参考基因组(CHIR_1.0、CHIR_2.0、ARS1 和CVASU_BBG_1.0)和野山羊参考基因组(CapAeg_1.0 和Caeg1),为加快山羊的分子生物学研究和今后的基因组选择育种奠定了基础。
1.4.1 家山羊参考基因组(CHIR_1.0 与CHIR_2.0)2013 年,Dong 等[15]利用Illumina 测序和光学图谱(Optical mapping)技术以及Fosmid 和辐射杂种嵌板技术的数据对云南黑山羊进行基因组从头组装和染色体定位。对云南黑山羊母羊采用双末端测序,构建了7 个不同大小片段文库用于基因组测序,共产生191.5 Gb 高质量数据。首先,由17-kmer 推算和c-value 计算山羊的基因组大小,约为2.92 Gb。其次,利用SOAPdenovo 软件经过初步组装后的contig N50 为18 kb;scaffold N50 为2.2 Mb。最后,利用Fosmid 和Optical mapping 技术方法辅助构建Superscaffold,获得最终的super-scaffold,获得2.66 Gb 大小的参考基因组(CHIR_1.0),组装出的基因组序列占预测基因组大小的92%(2.92 Gb),其Scaffolds N50 的大小为18 Mb,无法定位到染色体的superscaffold 归类为chromosome U[15]。此外,利用RH技术对山羊第1 号染色体构建了高密度SNP 标记的辐射杂种图谱,并与Optical mapping 数据组装的长超级支架(Super-scaffold)进行了比对,成功证明了山羊序列的组装质量的可靠性[29]。山羊基因组中含有大量重复序列,约占基因组42.2%。使用从头注释、基于人和牛的基因同源注释和基因预测,总共注释出山羊蛋白编码基因有22 175 个,平均转录本长度为29 969 bp,CDS 平均长度为1 385 bp,每个基因平均含有8 个外显子,每个外显子的平均长度为168 bp,内含子平均长度为3 956 bp。随后,研究人员进一步通过增加Illunima 测序数据,对参考基因组CHIR_1.0 进行了的一些修正,并利用辐射杂交技术修正了一些scaffold 的方向和顺序以及挂载了CHIR_1.0未能成功挂载的scaffold[29]。通过一系列的组装优化工作,最终获得了山羊的基因组序列大小2.85 Gb,contig N50 的长度为29.87 kp,scaffold 的N50 长度为8.92 Mb,其中染色体的 GC 含量为 40.73%,;在使用CHIR_1.0 为模板挂载染色体后,同样使用了野山羊染色体和绵羊染色体的作为模板挂载了剩余部分中未成功定位的scaffold,最终在CHIR_2.0 中的scaffold 序列中能成功挂载到山羊染色体上的序列占总序列的93.2%[44]。总的来说,相较于CHIR_1.0 版本的基因组,CHIR_2.0 在基因组完整性、功能注释等方面都有较大的提升,极大地促进了山羊遗传变异检测和功能基因定位的研究 工作。
1.4.2 家山羊参考基因 组(ARS1) 2017 年,Bickhart 等[22]首先利用Illumina 的Goat SNP50K 芯片从96 头山羊(6 个品种)中,筛选出基因型纯和度最高的候选个体用来进行基因组从头组装(San clemente)。第一 步, 用Celera Assembler PacBio corrected Reads 流程对Pacbio 技术的465 个SMRT cell 产生的long-read,覆盖深度达69X 的194 Gb基因组数据进行初步组装,共获得3 074 个contig(2.63 G),其中N50 为4.159 Mb。第二步,基于Irys optical mapping 技术对其雄性后代测序产生的256 Gb光学图谱数据,并利用IrysView 软件构建scaffold,组装产生了842 个scaffold,其中,scaffold N50 为13.408 Mb(最长 的scaffold 为66.728 Mb),contig N50 为10.858 Mb。第三步,基于PacBio 和光学图谱组装的结果,构建Hi-C 文库并物理方法打断成300-500 bp 大小,双末端(PE101),共产生115 Mb reads的数据量,调用Lachesis 软件包,整合PacBio-Irys-PGA(PBIP),获得Scaffold N50 为87.347 Mb 较为完美的组装结果。第四步,利用Illumina 技术,构建PE251 测序,获得23X 的基因组数据,用来进行一致校正和最后的补洞。最后,利用Kraken v0.10.5 去除有病毒和细菌污染的序列,去掉有NCBI vector污染的序列,获得最终的2.924 Gb 大小的参考基因组图谱ARS1,包含31 个scaffold,663 个gap 区和680 条contig。此外,利用6 个组织(大多和脑组织相关)RNA-seq 测序数据、13 个SRA 下载数据,用PASA 软件将stringtie、cufflinks 和Trinity 分析结果整合在一起;用exonerate 和tblastn 软件比对到几个近缘物种的Ensembl 基因集上,获得同源预测基因集;用Braker1 做Ab initio 预测;CHIR_1.0 版本的注释基因集;最后,用EVM+PASA 把以上4 种数据整合成一个最终的基因集(设置的权重为RNAseq> cDNA/protein>ab initio gene predictions)。此版本基因组是目前组装结果最好的山羊参考基因组,相应的组装策略和技术为其他物种的参考基因组提供了参考,如最新获得水牛基因组组装就采用相似的 方法[45]。
1.4.3 家山羊参考基因组(CVASU_BBG_1.0) 2019年,Siddiki 等采用Illumina 测序平台对孟加拉黑山羊进行深度为14X的150 bp 双末端测序,利用ABySS v.2.1.5 组装软件初步获得3 294 295 个contigs(最小contig 大小为200 bp)[46-47];进一步利用ABACAS v.1.3.1 组装流程与参考基因组ARS1比较[48],进行从头组装基因组的排列、排序和定向,最终获得了基因组大小为3.04 Gb 的孟加拉黑山羊参考基因组(CVASU_BBG_1.0);BUSCO 评估基因组的完整性为82.5%[49],基因注释共发现了26 458个基因[50]。孟加拉黑山羊的基因组组装结果为今后深入研究其种群遗传结构、遗传多样性,评估该山羊品种的未来育种潜力奠定了坚实的基础[51]。该研究中利用Illumina 短读长数据进行初步组装[47];随后与参考基因组精细图谱(ARS1)比较,利用ABACAS 等组装进行基因组序列的排序和定向研究,为今后不同山羊品种的参考基因组组装和进行山羊的泛基因组研究提供了可行性参考。
1.4.4 野山羊参考基因组(CapAeg_1.0) 2015 年,Dong 等[44]采用家 山羊CHIR_1.0 的DNA文库构建方法对一只雄性野山羊进行测序,基于Illumina Hiseq 2000 测序平台共获得了381.50 Gb 大小的基因组数据;使用SOAPdenovo 软件初步组装获得了野山羊基因组序列;随后,基于野山羊与家山羊基因组的共线性关系,使用LASTZ 软件与家山羊参考基因组比对信息,构建了野山羊常染色体基因组。为进一步构建野山羊Y 染色体基因组数据,首先利用BLAT 软件将常染色体组装中未锚定位置的Scaffolds与家牛Y 染色体(家牛Btau_4.6.1 的NC_016145.1染色体)参考基因组进行比对;反过来利用LASTZ软件将家牛Y 染色体的contigs 比对到野山羊Scaffolds 上,通过过滤检验分析,最终获得野山羊参考基因组CapAeg_1.0,其中contig N50 为18.97 Kb,scaffold N50 为2.06 Mb;Y 染色体大小为17.3 Mb,包含79 个锚定的scaffolds。为注释野山羊基因组的蛋白编码基因,采用了从头预测,同源蛋白比对,转录组测序数据和序列表达标签信息,注释出了23 217 个基因;其中注释到了57 个Y 染色体基因,包括11 个已知的雄性特有基因(Male specific region genes,MSY)。获得了大量的遗传变异信息,其中揭示了ASIP基因的拷贝数变异与家山羊的被毛变化相关。
到目前为止,获得的从头组装的参考基因组共有4 个品种的个体,其中以ARS1 组装注释结果最好(不同参考基因组详细信息见表1),这些组装到的基因组在一定上促进了山羊泛基因组的研究,为揭示基因组水平大规模的变异奠定的基因组水平的数据基础。
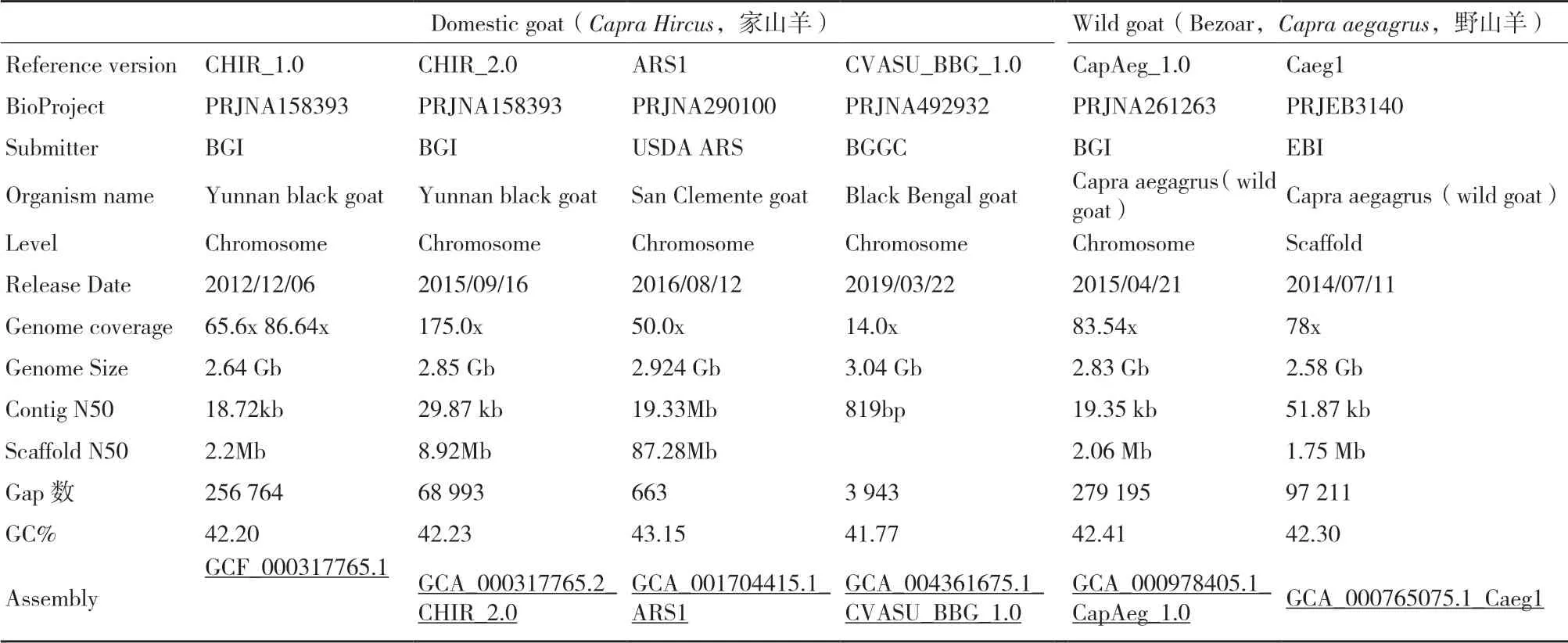
表1 不同山羊基因组de novo 组装版本信息
2 全基因组变异图谱
随着测序技术的不断成熟及测序成本的不断降低,利用高通量测序技术检测山羊全基因组水平的遗传变异逐渐成为可能。此外,随着研究对象样本量和品种数的增加,山羊遗传变异的信息也逐渐增加和丰富,极大了加深了我们对的山羊遗传多样性和环境适应性的理解(http://www.genome.gov/sequencingcosts/)。根据遗传变异形成机制、存在形式以及对基因组结构和表型的影响,可分为以下类型,即单核苷酸多态性、1-50 bp 的小片段的插入或缺失、50 bp 以上的拷贝数变异以及由位置变化引起的易位或倒位等,详细信息如图1 所示[52]。
2010 年,Fontanesi 等[53]利用牛- 山羊间的微阵列比较基因组杂交(Array comparative genome hybridization,aCGH)技术,首次对山羊基因组拷贝数进行了检测研究,共发现了161 个CNVs 变异。Liu 等[54]利用CaprineSNP50 芯片和PennCNV 软件对ADAPTmap 项目产生的基因组数据进行CNV 分布分析,从50 个山羊品种的1 023 个个体中共获得包含6 286个CNVs的978个区域,约262 Mb(8.96%)。基于SNP 芯片检测CNV 的研究,扩展了SNP 芯片的应用范围,加深了对CNV 变异在家畜遗传多样性和经济性状差异的理解,但因为SNP 芯片的敏感性等原因,其准确性和可靠性需要进一步验证。
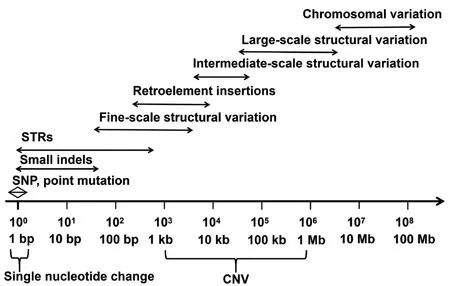
图1 人类基因组的变异图谱[52]
基于全基因组个体重测序的方法,Tosser-Klopp[20]、Dong[44]、Benjelloun[55]、Zhang[56]、Florian[55,57]、Li[58]、Lee[59]、Kim[60]和Cao[61]等对阿尔卑斯山羊、克里奥山羊、Katjang 山羊、Savanna 山羊、萨能奶山羊、波尔山羊、澳大利亚野化山羊、澳大利亚绒山羊、野山羊、摩洛哥山羊、辽宁绒山羊、内蒙古绒山羊、雷州山羊、韩国黑山羊、努比亚山羊和云岭黑山羊等进行了2.7-30X不同深度的全基因组测序;采用全基因组混合池测序方法,Lai[62]、Zhang[63-65]、E[65-66]和Wang[67]等通过对崂山奶山羊、大足黑山羊、太行黑山羊、西藏山羊、内蒙古绒山羊、陕北绒山羊、安哥拉山羊、萨能奶山羊、波尔山羊和贵州小山羊等进行了10-30X的混合池测序;基于简化基因组测序方法,Song 等[68]对西藏班戈山羊和日土山羊、柴达木山羊、南疆绒山羊、内蒙古绒山羊二狼山型及辽宁绒山羊)不同个体进行了外显子测序;Wang 等[69]利用RNAseq 技术对内蒙古绒山羊阿尔巴斯型进行了遗传变异检测分析。通过与参考基因组比对(CHIR_1.0、CHIR_2.0 和ARS1),检测出大量的SNP、Indel 和CNV 等遗传变异数据,为今后山羊分子遗传标记的开发和利用以及遗传资源保护奠定了坚实的基础。
目前,随着山羊分子生物学的不断发展及对家畜分子育种的重视,许多研究机构对山羊的环境适应性和表型多样性等方面进行了不同程度的研究,详细信息见表2。因为测序项目实施的时间不同,所用到的山羊参考基因组信息有所不同,导致山羊遗传变异在基因组上位置信息有所差异,为统一山羊基因组变异的相对位置,国际山羊基因组联盟首先对Goat SNP50K 芯片的SNP 位置信息与ARS1 进行了比较和校正。由于NCBI 在2017 年逐渐停止对dbSNP 和dbVar 中的所有非人类生物的支持,目前山羊等物种的基因组变异数据存储在Ensemble 数据库 中(ftp://ftp.ensembl.org/pub/release-97/variation/gvf/capra_hircus/)。截止到2019 年5 月8 日,以参考基因组ARS1 版本的作为参考构建的遗传变异信息,主要包括33 996 708 个SNP 和Indel,而CNV和SV 等的变异信息目前尚未公布。
3 遗传变异信息的利用
山羊全基因组重测序研究的主要目标就是通过生物信息学方法检测不同品种特有的选择信号特征,揭示不同品种特异性的遗传基础;其次是构建不同品种的全基因组单倍型图谱,为今后利用低密度芯片进行基因型填充、增加基因组信息的可利用率做基础数据支持;再次是利用全基因组水平的遗传变异信息,针对不同的研究群体和目标对SNPs 等遗传变异信息进行过滤和筛选,进而开发不同密度的SNP 分型芯片。目前,利用不同品种的基因组遗传变异信息,已经成功设计出了Goat SNP50K 芯片[20]和66K 目标捕获芯片[21]。
基于全基因组重测序数据,在山羊的高海拔环境适应(EPAS1、EDNRA、SIRT1、PASK、PTPRZ1、NPC1L1和RYR1)[68]、脂肪代谢(ACSL1、LRP1、PLIN4、FASN)、绒用性状(FGF5、PRDM6)[56,58,67]、被毛颜 色(KITLG、MC1R、ASIP、ATRN、GNAQ、
HELLS、MUTED、OSTM1、TRPM7、VPS33A、Ada-mts20,MITF、OCA2、SLC7A11和AHCY)[44,55,57]、 神经系统发育(ADRA2A、FXR2、HTR3A、CACNA1、CCHD5、ULK1、TMEM132A、SYNDIG1、ERC2和GABRB2)[44,56]、繁殖性状(NR6A1、STK3、IGF2-BP2、NPTX1、ANKRD17、DPYD、CLRB、PPP3CA,PLCB1,STK3 and HMGA2,PRP1、PRP6、CCNB2、A R、ADCY1、DNMT3 B、SMAD2、AMHR2、ERBB2、FGFR1,MAP3K12、SETDB2、CDH26和THEM4)[62,64-65]、体尺性 状(NR6A1、TNFSF13、STIM1、IGF1R)[44,56]、肉用性 状(GDF5、LRP4、HMGXB3、SLC26A2、goat_GLEAN 10018710、SLC-35A3、HIAT1、SASS6和GOAT_ENSBTAP00000044-216)[56]、疾病抗性(HTT、CCR3)[55,59]、生长性状(CCKAR、IGF1R、MYADM)[44]、免疫系统(ABCC4、PRAME、CD163L1、KIR3DL1、CFH和TRIM5)[44]、精子发生(PRAME)[44]和乳用性 状(BTN1A1、RSRC1、SHOX2、VPS13A、VPS13B、VPS13C和RPL3)[44,56]等遗传基础的解析方面取得了众多研究成果。
4 展望
目前,山羊重要经济性状遗传基础的研究正在由候选基因、单一性状的方法向全基因组水平、多性状和多组学等联合分析的方法进行转变。高通量测序技术的进一步发展和新的分析方法的不断涌现,加快了研究人员研究、挖掘全基因组范围内山羊的遗传多样性信息及经济性状相关的分子基础,如Guan 等[71]基于共享基因组数据分析山羊酪蛋白基因家族变异的起源与演化过程。山羊大多数经济性状属于数量性状,遗传因素如单碱基突变(SNP)、插入缺失(Indel)、结构变异(SV)和表观遗传修饰调控(甲基化修饰、组蛋白修饰和非编码RNA 调控)以及环境和营养因素等均会影响到山羊的表型性状和生产性能。为揭示复杂性状的遗传基础和调控机制,高通量技术下的研究方法主要包括对不同组织器官的差异基因表达的RNA-seq 分析、基于不同品种杂交个体的等位基因特异性表达分析、基于全基因组重测序技术的选择性清除分析、复杂性状基因定位的全基因组关联分析、表观遗传调控组蛋白修饰和甲基化分析以及非编码RNA 调控的研究以及逐渐在上述技术方法基础上衍生的多组学方法,如RNA-seq+GWAS、WGS+GWAS、eGWAS和BSA+RNA-seq 等联合分析进行精确定位的研究方法[71-73]。通过合理的选择研究对象、构建理想的试验群体并适当的组学技术,借助公共数据库基因组信息和生物信息学方法挖掘其潜在的与生产性状相关的基因或基因组区域、影响效应和调控互作机制将是今后的研究重点,也对推动山羊分子育种和基因组选择研究工作具有重要的理论和实践意义。

表2 国际山羊遗传资源与研究机构相关网站
