滴定曲线中水的电离程度的定量认识
2020-05-07柳先美
柳先美
(广东省广州市实验中学 510375)
近些年的全国高考卷中,有一道选择题是考查水溶液中离子平衡的一些知识点,涉及到溶液溶质的判断、K值的计算、浓度大小的比较、水的电离程度大小的比较.从平时测试的数据来看,这一题的得分率偏低的,说明学生在该知识点的理解和认识上还是比较困难的.
根据该知识点的属性和笔者的教学经验,建议教学中能够抓住溶质微粒这个基本的化学核心素养的微粒观,分析出每个状态下的溶质,通过适当的定量计算,以数据再结合图像曲线呈现给学生,让学生对该知识点有一个全面、深刻的认识.有助于学生吃透该知识点,提高得分率.
一、水的电离
水是一个极弱的电解质,在常温的情况下,c水(H+)=c水(OH-)=1×10-7,所以Kw=c水(H+)·c水(OH-)=1×10-14(这里在浓度c右下角加上水,表示由水电离产生的离子).水的电离存在平衡,就会受到一些离子的影响.水的电离程度关键在于求出c总(H+)、c总(OH-)和c水(H+)、c水(OH-),同时必须搞清他们的关系,不能混淆.
二、水的电离的促进与抑制
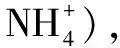

表1 不同溶液中水的电离
注:常温下
通过数据分析,酸碱中算“小的”,水解盐算“大的”,还可以得到下面几点规律:
①常温下水溶液中,c水(H+)=c水(OH-)=1×10-7水的电离不被抑制也不被促进.
②c水(H+)=c水(OH-)<1×10-7水的电离被抑制;c水(H+)=c水(OH-)>1×10-7水的电离被促进.
③pH相加等于14的酸和碱,抑制程度相等,pH相加等于14的盐,促进程度相等.
④c水(H+)越小,水的电离越被抑制;c水(H+)越大,水的电离越被促进,但溶液的pH都是越远离7的.
详细的关系可以看图1.
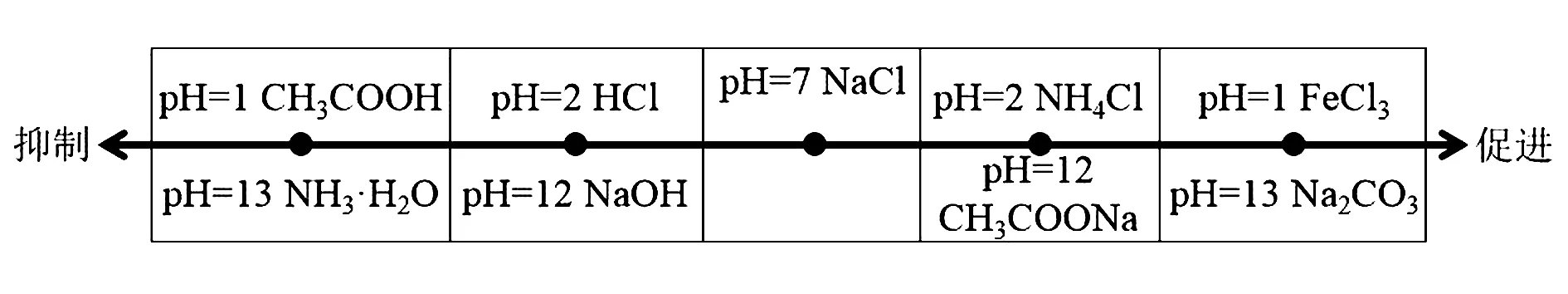
图1
三、中和滴定曲线中各个点水的电离程度情况
以这样一个题目来分析中和滴定曲线中水的电离程度.
常温下,向20mL 0.1mol·L-1的CH3COOH溶液中加入0.1mol·L-1的NaOH溶液的滴定曲线如图2所示.

图2
当溶质是纯CH3COONa溶液的时候,水的电离程度是最大的.左极限VNaOH=0mL时,纯CH3COOH溶液水的电离被抑制.右极限VNaOH无限大时是NaOH溶液,水的电离是被抑制.因此,在这个左极限与最高点之间,有一个点水的电离既不被抑制也不被促进;最高点和右极限之间也有一个点水的电离既不被抑制也不被促进.
这两个点的溶质是什么,溶液的酸碱性以及横坐标是多少,这是常考的一个难点.可以先分析清楚曲线上每一个点的溶质是什么,如图3所示,左极限点①是纯CH3COOH,抑制水的电离;最高点⑤是纯CH3COONa,促进水的电离.再以这两个点为参考,一定有一个点④水的电离既不被促进也不被抑制,这个点④是少量CH3COOH和过量CH3COONa的混合溶液,且溶液pH=7,CH3COOH抑制水的电离与CH3COONa促进水的电离相互抵消,既不抑制也不促进水的电离.同理,也有⑦水的电离既不被促进也不被抑制,这个点⑦是NaOH和CH3COONa的混合溶液,NaOH抑制水的电离与CH3COONa促进水的电离相互抵消,既不抑制也不促进水的电离,但溶液pH>7.
点③是等量的CH3COOH和CH3COONa,CH3COOH电离大于CH3COONa的水解,所以是抑制水的电离;点②靠近点①是过量CH3COOH和少量CH3COONa的混合溶液,抑制水的电离; 点⑥溶质中NaOH较多,水的电离被抑制.
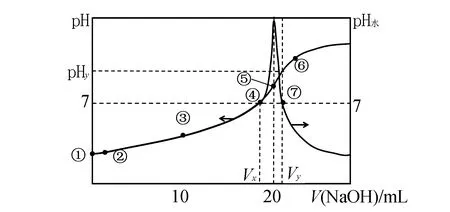
图3
通过计算可以得到点④和点⑦的V(NaOH).
点④,电荷守衡:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)=c(OH-),所以
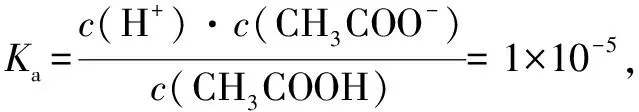
c(CH3COO-)+c(CH3COOH)
解得Vx=19.8mL
点⑦,CH3COONa的促进等于NaOH的抑制,可以近似认为CH3COONa水解产生的c(OH-)与NaOH电离产生的c(OH-)相等.
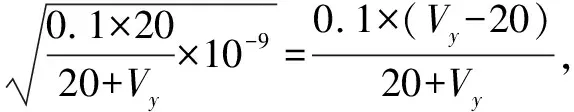
根据数据可以得知,两个点④和⑦都与点⑤极其靠近,特别是点⑦的Vy=(20+3.38×10-7)mL≈20mL,并没有什么意义.
该文通过图表结合数据计算的形式,清晰的呈现了中和滴定过程中水的电离变化的情况.通过这些形象的图表和具体的数据,可以帮助学生更深层次的认识水的电离这个知识点.
