肽酶体系生成高F 值寡肽机制的探讨
2020-05-01柳佳芸高思宇朱运平郦金龙李秀婷
柳佳芸 高思宇 朱运平 滕 超 郦金龙 李秀婷 熊 科*
(1 北京工商大学 北京食品营养与人类健康高精尖创新中心 北京 100048 2 北京工商大学 北京市食品添加剂工程技术研究中心 北京 100048 3 北京工商大学 北京市质量与安全重点实验室 北京 100048 4 北京工商大学 北京市风味化学重点实验室 北京 100048)
随着人们生活水平的不断提高,人们的消费观念、饮食习惯、营养要求等都发生了巨大的转变,从简单的吃饱吃好到营养健康,甚至防病治病。一直以来,人们普遍认为蛋白质只有消化分解成游离氨基酸才能被机体吸收利用。而近年来许多研究表明蛋白质被人体吸收利用不仅是以游离氨基酸的形式存在,还存在其它的方式[1]。有研究表明,肽同样能为人体提供营养物质,许多具有独特氨基酸组成的肽,还具有特殊的生理功能,尤其是一些低分子质量的活性寡肽,在当前食品科学界受到高度关注,成为热门的研究课题之一。其中高F 值寡肽就是一种功能肽。由于其独特的生理功能,在食品和医药界受到高度关注。
1 高F 值寡肽的概述
高F 值寡肽是一个混合小肽体系,可以将其分为寡肽和高F 值两个部分予以解释。寡肽是由2~10 个氨基酸组合而成的短肽。与氨基酸或蛋白质相比,寡肽的吸收有以下特点:不需要消化,直接吸收;吸收时不消耗人体能量;优先吸收;吸收速度快;具有载体作用;将各种微量元素运输到人体所需部位,这些特点赋予小肽独特的吸收性能。此外,小肽还有许多重要的生理功能,如促进氨基酸吸收,蛋白质合成,矿质元素吸收以及免疫活性[2],清除自由基,改善食品风味和质地[3]等功能。F值是纪念德国学者Fischer J.E.提出的“伪神经递质假说”,具体指支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)与芳香族氨基酸(色氨酸、酪氨酸、苯丙氨酸)含量的摩尔数比值,高F 值寡肽的F 值一般应大于20[4-5]。近年来,大量研究表明高F 值寡肽具有良好的生理功效。对其功效研究主要集中在以下方面:谷文英[6]、Kuwahata 等[7]、Muto 等[8]在 高F值寡肽对保肝、护肝及肝性脑病的辅助治疗方面做了大量研究;李晓雯等[9]、Calcar 等[10]、Pimentel等[11]的研究表明高F 值寡肽有治疗苯丙酮尿症的功效;王海波等[12]、Monteiro 等[13]、Howatson 等[14]在高F 值寡肽具有抗疲劳,耐缺氧作用方面做了相关研究;郑惠娜等[15]、Ichikawa 等[16]研究表明高F值寡肽有抗氧化、防衰老的功效。此外,张洪伟等[17]研究表明高F 值寡肽有抑制癌细胞增殖等作用。在高F 值寡肽对降低神经生长因子损伤[18],修复空间记忆和提高大脑神经营养因子[19]等方面也有相关研究。
2 高F 值寡肽的生产现状
目前,国内外制取功能性多肽的方式有酶水解法、分离提取天然活性肽、化学合成法以及其它多种方法。分离提取天然活性肽法具有高效、低毒、无污染等特点,然而,在生物体内生物活性肽的含量一般是极其微量的,且目前从生物体中直接分离提取活性肽的成本较高、效率低。化学合成法的研究目前尚不成熟,存在合成序列短,成本高,毒性大等缺点[20]。也有学者提出基因重组的方法制备活性肽,而该法易出现翻译后难以修饰,易形成包涵体等不利情况[21]。与以上方法相比,酶水解法具有较大的优势。酶法制备生物活性肽是以动植物来源的蛋白质为底物,利用蛋白酶在适宜条件下将其水解,经分离纯化获得生物活性肽的过程[22]。该法作为目前生产活性肽的主要方法,具有成本低,生产条件温和等特点,而且获得的活性肽安全性高,溶解性好,稳定性及功能特异性良好[23-24]。
国内外用于生产高F 值寡肽的原料来源十分广泛。如表1 所示,原料广泛来源于动植物蛋白。

表1 制备高F 值寡肽的部分原料来源Table 1 Sources of partial raw materials for making high Fischer ratio oligopeptides
由于原料蛋白来源的多样性及复杂性,不同来源的材料需要用不同酶体系水解制备高F 值寡肽。表2 是部分高F 值寡肽制品所用的酶及制品品质。
酶法制备高F 值寡肽时,需要充分分析原料中蛋白质的氨基酸序列和酶的作用位点,优化工艺条件[4]。因此,每种酶体系水解制备高F 值寡肽的方法局限性较大,只能适用于特定的蛋白质原料。同时酶解过程中,长链烷基氨基或芳香族氨基酸的疏水基团的暴露容易使酶解液呈现苦味,导致后续的分离纯化及脱苦等处理工序繁琐,纯化成本较高,纯化吸附过程中氨基酸和多肽损失较大,再生困难等诸多问题[39]。要解决这些问题,需要对酶解生成高F 值寡肽的原理、酶解机制做深入了解及研究,在此基础上不断提高寡肽的F 值及得率,降低其芳香族氨基酸的含量,简化工序,降低成本等。
如何提高F 值和得率,降低芳香族氨基酸的含量,以解决方法的局限性,简化工序,降低成本等。要解决这些问题,需要对生产高F 值寡肽的原理,酶解机制做深入的了解及研究,在此基础上提出可靠的解决方法。
3 肽酶催化多肽底物机制
蛋白酶是一类酶的总称,它可以水解蛋白质肽链。根据水解肽链的方式可分为内肽酶和外(端)肽酶。内肽酶是将分子质量大的多肽链从中间切断,得到分子量质较小的朊和胨;外肽酶分为羧肽酶和氨肽酶,它们分别裂解肽链的羧基末端或氨基末端的氨基酸。
肽酶催化与一般的酶促反应相似,具有专一性、高效性,易受外部环境的影响。这些特性与肽酶的结构密切相关,由于每种肽酶的空间结构都具有各自的特点,使得不同的肽酶具有不同的催化功能和活性。肽酶蛋白独特的生物学功能主要取决于其天然的空间构象。根据酶活性中心不同区域所起功能的不同,可将酶活性部位分为催化中心和结合部位两个部分。催化中心直接参与底物分子的成键与断键,决定了酶的催化能力。结合部位与酶和底物分子的结合相关,决定了酶对底物的专一性。制备高F 值寡肽的酶解过程可分为两步,首先由内切酶水解蛋白质原料形成可溶性肽,然后由外切酶切下芳香族氨基酸,再分离去除芳香族氨基酸,获得高F 值寡肽。生成高F 值寡肽常用的内切酶,如碱性蛋白酶、胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶等,外切酶有风味蛋白酶、木瓜蛋白酶、羧肽酶等。胰蛋白酶能把多肽链中赖氨酸和精氨酸残基中的羧基侧切断[40],是特异性最强的蛋白酶。胃蛋白酶裂解芳香族氨基酸之间形成的肽键;而枯草杆菌碱性蛋白酶切割羧基侧为疏水性芳香族氨基酸的肽键;胰凝乳蛋白酶主要切割芳香族氨基酸的羧基肽键[4,41]。羧肽酶A 主要切割C 末端是芳香族和较大空间的脂肪类氨基酸残基的肽键,末端是碱性氨基酸残基和脯氨酸残基的肽键,无法裂解[42]。本研究中,内切酶及外切酶以胰凝乳蛋白酶和羧肽酶为例,简要介绍其结构及酶解机制。图1 和图2 分别是牛胰凝乳蛋白酶和棉铃虫的羧肽酶A 的结构[43-44]。牛胰凝乳蛋白酶由3 段肽链组成,经折叠后形成椭球状的三级结构。棉铃虫的羧肽酶A 是单链蛋白质,紧密结合着Zn2+离子,在该酶的三维结构中,Zn2+处于接近酶表面的沟槽中。
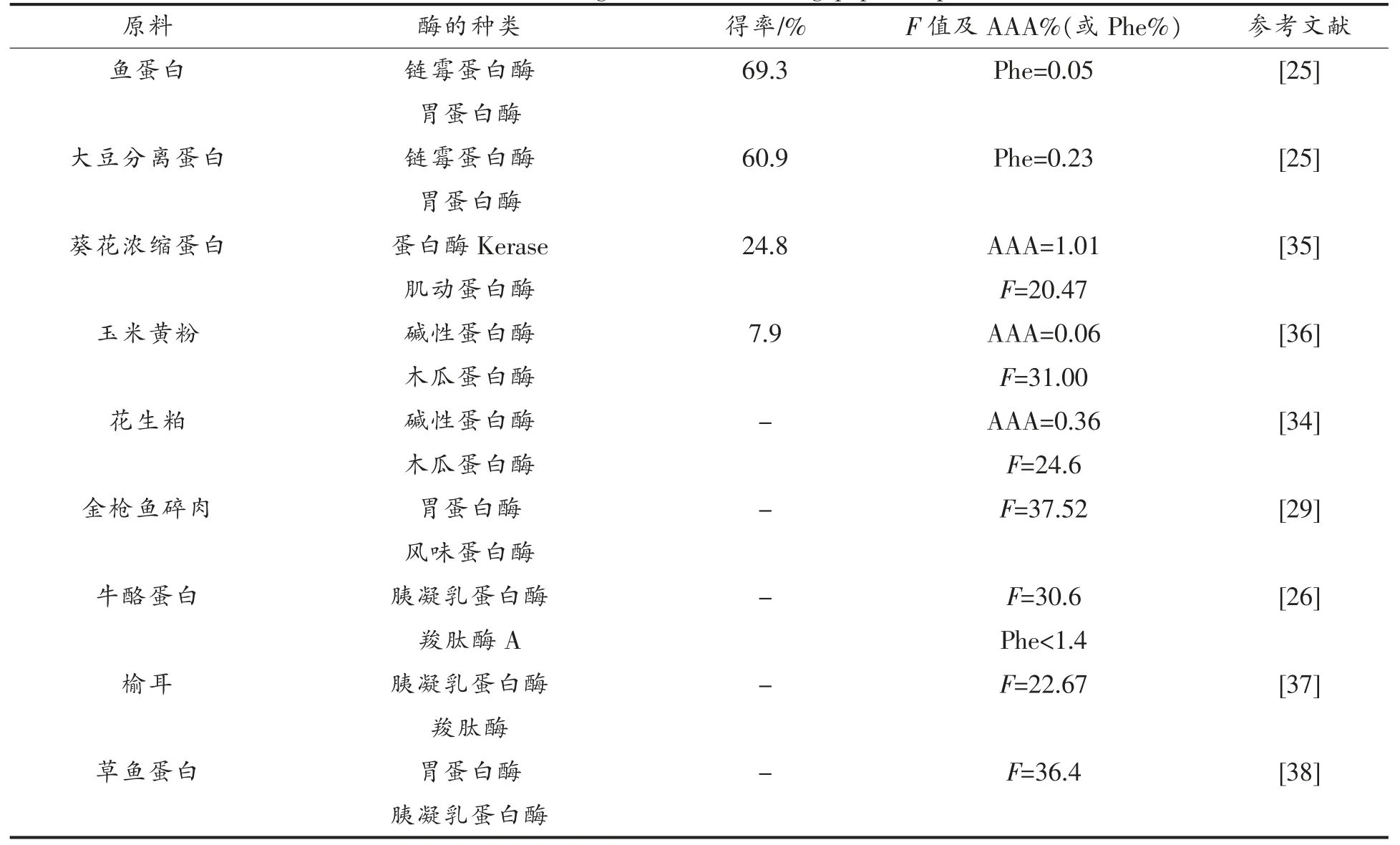
表2 部分高F 值寡肽制品Table 2 Partial high Fischer ratio oligopeptides products
酶是一种高效生物催化剂,其催化效率受多种因素影响。而起着决定性作用的因素究竟是什么,目前尚无定论。一般认为酸碱催化、底物变形及诱导契合[45]、邻近效应和定位效应、共价催化、协同效应和多元催化在其高效催化效率上起着重要影响[46]。酸碱催化和共价催化是较为广泛的重要催化机理,以下对其做简要的介绍。
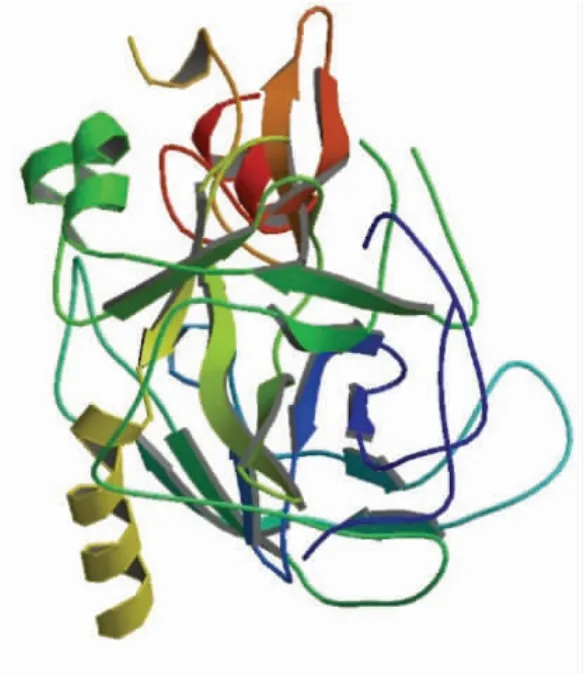
图1 牛胰凝乳蛋白酶的晶体结构Fig.1 Crystal structure of bovine chymotrypsin
依据酸碱催化理论在肽酶的酶解反应中,一些酶蛋白的氨基酸残基可作为质子供体或受体,在反应中提供或接受质子以稳定过渡态,从而反应的活化能得以降低,反应速率加快。组成酶蛋白的20 种氨基酸中,可以作为质子供体和受体的氨基酸残基有8 种,分别是天冬氨酸、酪氨酸、谷氨酸、丝氨酸、精氨酸、赖氨酸、组氨酸和半胱氨酸。其中,组氨酸由于其咪唑环上的两个氮原子,既可作为质子的受体,又可作为质子的供体同时参与酶解反应。在许多酶中组氨酸的含量虽然很少,但却起着重要作用。
共价催化理论分为亲核催化和亲电催化。亲核催化是在酶催化反应中亲核催化剂提供电子并进攻底物的缺电子中心。而亲电催化则是亲电催化剂作用于底物的富电子中心。形成非常不稳定的酶-底物中间复合体,降低反应所需活化能,加快反应。
4 高F 值寡肽酶解形成机制
目前,酶法制备高F 值寡肽通常需要4 步:预处理、内切酶作用、外切酶作用、分离纯化。其中,第1 步预处理方法通常有物理剪切、NaOH 增溶、Na2SO3还原、除糖等;第2 步水解预处理后的原料使其成为多肽并尽可能使芳香族氨基酸暴露于肽链末端;第3 步酶解肽链末端的芳香族氨基酸;第4 步去除水解液中游离的芳香族氨基酸[39]。酶法生产高F 值寡肽时,对其作用过程及其机理的深入探究具有重要作用,可为解决现有方法的局限性,简化工序,提高寡肽F 值及得率,降低成本提供关键理论技术基础。
4.1 肽链中芳香族氨基酸的暴露
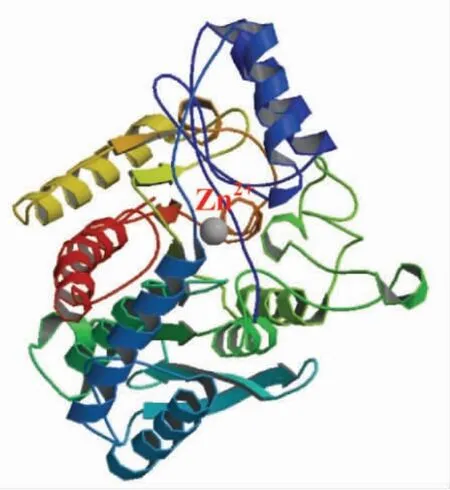
图2 棉铃虫的羧肽酶A 的晶体结构Fig.2 Crystal structure of carboxypeptidase A from cotton bollworm
将预处理后的原料水解成多肽,使多肽中的芳香族氨基酸暴露于肽链末端,这一过程中,主要是内切酶起作用。首先,内切酶水解蛋白质原料形成可溶性肽时要尽量确保水解发生在特定的位置,使得切下的肽段N-末端或C-末端为芳香族氨基酸。内切酶若能高效充分的识别切断与芳香族氨基酸相连的肽键,将可以有效暴露肽链中芳香族氨基酸,提高最终产品中活性肽的F 值。常用于制备高F 值寡肽的内切酶主要有碱性蛋白酶、胃蛋白酶、胰凝乳蛋白酶、枯草杆菌蛋白酶等[1]。这里以胰凝乳蛋白酶为例,简要阐述其识别切断与芳香族氨基酸相连的肽键过程及作用机制。
只有内切酶充分使肽链中的芳香族氨基酸暴露,将原料水解成芳香族氨基酸位于末端的多肽,才有利于下一阶段外切酶进一步作用肽链末端释放出芳香族氨基酸。胰凝乳蛋白酶属于丝氨酸蛋白酶,具有组氨酸、苏氨酸、天冬氨酸组成的“催化三联体”(His57-Asp102-Ser195)。其暴露芳香族氨基酸过程如图3 所示,当肽链靠近酶的疏水口袋后,疏水口袋上方有一个较宽的底物结合口袋,且口袋壁上分布的是疏水性氨基酸,所以特别适合与芳香族氨基酸与酶的结合。肽链中芳香族氨基酸的侧链进入酶的底物结合口袋,随后底物肽链的特定部位锚定在酶分子底物结合口袋附近的Ser195 上。这一过程使内切酶能有效识别到芳香族氨基酸。肽链与酶结合后,由酶的催化部位His57 作用使敏感肽键断裂。Ser195、His57、Asp102 作为酶活性中心构成一个氢键体系,His57的咪唑基是Asp102 羧基及Ser195 羟基间桥梁,受His57 和Asp102 影响,Ser195 成为较强的亲核基团。在此反应中,His57 咪唑基起着广义酸碱化作用:(1)促进具有亲核性的Ser195 中的羟基与底物感肽键的羟基碳原子形成共价的酰化中间产物;(2)促进已经被酰化的中间产物上的酰基转移到水或其它的酰基受体(如氨基酸)上。这样,便切断了肽链中与芳香族氨基酸相连的肽键,使芳香族氨基酸得以暴露。
图3 胰凝乳蛋白酶识别切断与芳香族氨基酸相连的肽键过程的简图Fig.3 Schematic representation of chymotrypsin cleavage of peptide bonds linked to aromatic amino acids
4.2 肽链末端芳香族氨基酸的释放
在肽链末端芳香族氨基酸的释放过程中,起主要作用的是外切酶。外切酶的作用是将内切酶水解得到肽段的末端芳香族氨基酸切断,将其从肽段中释放出来。充分切除肽链末端的芳香族氨基酸,将可有效提高活性肽的F 值。外切酶有氨肽酶和羧肽酶,常用的外切酶是羧肽酶A。
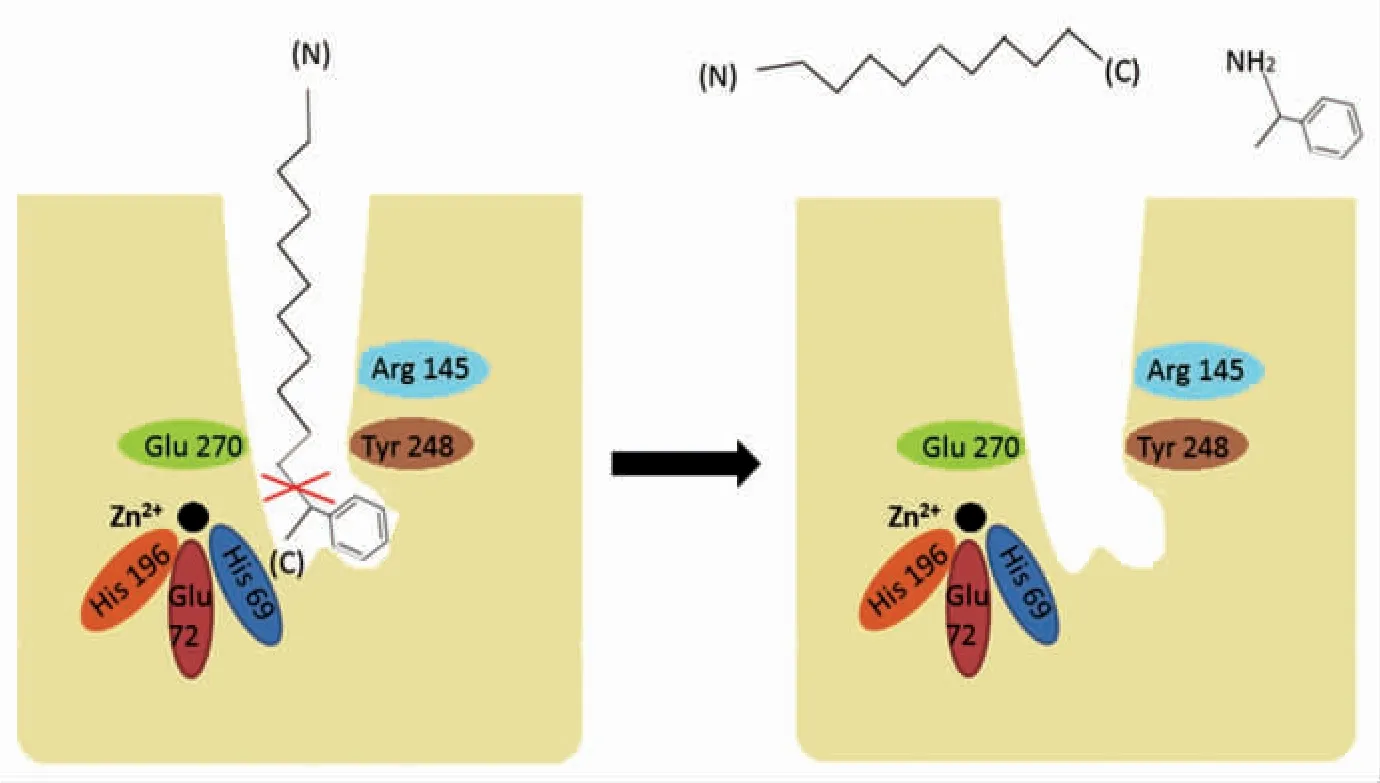
图4 羧肽酶A 识别切断肽链末端芳香族氨基酸过程的简图Fig.4 Carboxypeptidase A schematic diagram of the process of cutting off aromatic amino acids at the end of the peptide chain
肽酶A 的作用过程如图4 所示,在羧肽酶A的结构中,锌离子形成了5 个配位键。分别是同His196、His69 的侧链和Glu72 的2 个羧基氧以及一个水分子。锌离子附近有一个较深的裂缝。当肽链靠近酶时,酶活性中心的结构发生变化,肽链的“靠近”和“定向”效应十分显著。肽链的C-末端氨基酸残基上羧基的负电荷与酶侧链中Arg145 上的正电荷发生静电吸引作用,从而使肽链的C-末端进入酶的裂缝中。裂缝的顶部有一个非极性的口袋,可以接受C-末端的R 基团,根据口袋的结构和性质,其最适合与芳香侧链和大的脂肪族侧链相结合。C-末端进入裂缝之后,肽链C-末端的芳香侧链进入酶的非极性口袋中。酶的Try248、Arg145、Glu270 及锌离子将肽链适当地定位于活性中心。这个过程实现了C-末端为芳香族氨基酸的肽链与酶的结合。肽链与酶结合后,通过Zn2+、Glu270、Tyr248 的作用,使敏感肽键断裂。即使肽链末端与芳香族氨基酸相连的肽键断裂,肽链末端的芳香族氨基酸得以释放。
4.3 酶解生成高F 值寡肽探讨
如何能使内切酶高效充分的识别切断原料蛋白中的芳香族氨基酸,外切酶高效的切下肽链末端的芳香族氨基酸,是最终产物中高效生成高F值寡肽的关键。根据酶解机制来研究其作用原理,改进方法,找到合适的双酶催化识别的酶解体系,是解决这一问题的突破口。在酶解过程中,酶能否准确的识别作用位点与酶和底物的结合定位有关,酶与底物的结和定位与酶与底物的结构互补性有关,其中多数与酶分子的底物结合口袋有关。如胰蛋白酶倾向于切割与具有较长侧链的碱性氨基酸相连接的肽键,因为它的底物结合口袋较深且底部又是Asp;胰凝乳蛋白酶主要作用于与芳香族氨基酸相连的肽键,由于其底物结合口袋虽不深但比较宽,而且壁上分布的是疏水性氨基酸;弹性蛋白酶主要作用于与侧链较小的氨基酸相连的肽键,因为其底物结合口袋很浅。基于此,对于酶的底物结合口袋的修饰与改造研究将是提高酶准确识别并高效催化底物的有效手段。同时,内切酶与外切酶的协同配合也是高效生成高F值寡肽的关键。研究内切酶与外切酶的底物识别特异性,设计能高效生成高F值寡肽的双酶切体系将能有效解决目前酶解生成F值寡肽存在的问题。
实际酶解体系应用中为解决酶解方法的局限性,简化工序,降低成本等问题,一般考虑利用微生物发酵法来制备高F值寡肽。是利用某些特殊的微生物,在其作用下将蛋白质分解,并利用其产酶特性来制备高F 值寡肽。该方法将产酶和酶解合成一步,省去了酶的分离提纯,缩短了生产时间。最后,寡肽经分离纯化即可得到,提高了生产效率。此外,还可以利用某些微生物产生的特定酶在生成高F值寡肽体系中来起到脱苦作用,而且有些还能产生发酵的特殊香味[47]。利用微生物发酵法来制备高F值寡肽其微生物蛋白酶来源广,酶的产量较高,生产成本低,因此具有较好的发展前景[48]。
目前,在制备高F 值寡肽的过程中,判断酶解效果主要是通过其水解度来判断[49],并没有考察其有效酶切的效果。具体来说就是通过内切酶作用后有多少芳香族氨基酸暴露于肽链末端,有多少芳香族氨基酸处于肽链中间未暴露;外切酶对肽链末端芳香族氨基酸水解释放效率。在研究如何高效生产高F 值寡肽的过程中,不仅要通过水解度来判断其水解为寡肽的程度,还可通过测定其酶解产物的结构来评价其酶解效果。
5 高F 值寡肽分离体系
为了最终获得高F 值,需要纯化产品,必须从酶解后的寡肽混合物中除去芳香族氨基酸[50]。为了提高产品的F 值,在去除芳香族氨基酸(AAA)的过程中,还要尽可能保留支链氨基酸(BCAA)。目前有多种方法可以分离氨基酸和肽,如凝胶过滤法、离子交换法、膜分离法、高效液相层析法以及活性碳吸附色谱法等。而相关文献[35]中报道的分离寡肤和芳香族氨基酸的方法主要有凝胶过滤色谱法和活性炭吸附色谱法。如果能够充分高效的通过酶解体系将芳香族氨基酸释放出来,通过后期的纯化除去芳香族氨基酸,就可以大大提高制得活性肽的F 值。Yamashita 等[25]的研究表明凝胶过滤色谱法虽然可以分离低聚肽混合物,却无法将AAA 完全分离。活性碳具有很高的吸附效率,并且对疏水性的化合物的亲和力极高,BCAA和AAA 均是疏水性氨基酸,非极性苯环侧链还与活性炭表面上的非极性吸附位相互作用。因此,当同时存在BCAA 和AAA 时,活性炭会优先吸附AAA。对于大规模工业化生产来说,活性炭吸附法成本较低,可重复利用,更适合大规模生产应用。并且对于酶解产生的一些疏水性氨基酸暴露在外面的苦味寡肽,活性炭对其具有较好的吸附效果,起到一定的脱苦作用。
6 结语
高F 值寡肽是一种功能性多肽,可作为保健品原料,具有多种保健功能和药物疗效。近年来,有许多关于高F 值寡肽制备的研究,然而,由于工艺复杂,成本较高等限制,大部分研究只停留于实验室阶段,很少用于实际生产[51]。而要解决酶解方法的局限性,提高寡肽F 值及其得率,降低芳香族氨基酸的含量,简化工序,降低成本等问题,就需要针对高F 值寡肽形成的酶解机制做深入研究。并通过对酶解体系进行改造修饰,提高其高效识别特异性及催化效率,设计能高效生成高F 值寡肽的酶解体系以及利用微生物发酵法等多种手段,来解决这些问题。由于现代人的生活节奏加快、工作压力增大以及不健康的饮食习惯等,导致越来越多的人处于亚健康状态,罹患慢性疾病的风险不断增加。而高F 值寡肽作为一种功能性多肽,具有改善精神状况,抗疲劳,抗氧化,解酒、保肝护肝、纠正血浆及脑中氨基酸病态模式,治疗苯丙酮尿症,平衡蛋白质营养等生理功能。对提高食品营养价值,改善人体健康状态,预防疾病等具有一定功效,因此,开发高F 值制品必将带来较大的经济和社会效益,前景十分广阔。
