新型冠状病毒肺炎、血管紧张素转换酶2和血压管理
2020-04-25李华俊潘小宏
李华俊 潘小宏

潘小宏,心血管内科博士,浙江大学医学院附属二院心内科主任医师。曾多次到国外进修,临床经验丰富,参与多项大型临床试验研究,擅长起搏器植入术和起搏电生理、心肌病、心力衰竭、高血压和遗传性原发性心律失常综合征的诊治,发表SCI论文十余篇。浙江省预防医学会高血压病预防和控制专业委员会委员,浙江省肿瘤心脏病学协作组成员。
截至2020年3月1日,全国确诊新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)感染的病例数已7万余例,死亡人数近3 000例,远超2003年严重急性呼吸综合征冠状病毒(SARS-CoV)感染情况,对公共卫生安全造成了极大的威胁。根据现有统计结果,感染并死亡的患者中合并高血压比例较高,引发了各界对其相关联系的各种猜测。目前对于新型冠状病毒的研究仍非常有限,而关于其情况的了解大多基于以往有关严重急性呼吸综合征(SARS)的研究,关于新型冠状病毒如何感染人体,血管紧张素转化酶2(ACE2)在其中扮演的角色以及感染患者的血压管理仍是值得探讨的问题,本文根据现有资料汇总报道如下。
1 新型冠状病毒简介及感染情况
根据系统分类,冠状病毒属于套式病毒目冠状病毒科冠状病毒属,具有囊膜,基因组为线性单股正链的RNA病毒,广泛存在于自然界。冠状病毒直径约80~120nm,基因组5′端具有甲基化的帽状结构,3′端具有 poly(A)尾,全长约 27~32kb,是目前已知RNA病毒中基因组最大的病毒[1]。1965年,科学家首次在人体上分离出冠状病毒。全球范围曾历经数次冠状病毒感染流行,包括:2003年非典型肺炎的SARS-CoV,2012年的中东呼吸综合征冠状病毒(MERS-CoV)以及此次新型冠状病毒感染等。SARS-CoV在2002年11月至2003年7月共向全球30个国家或地区传播,感染8 098例,导致774例患者死亡,病死率达9.6%[2]。而MERS-CoV在2012年9月至2019年9月,导致全球范围内27个国家或地区的2 494例感染,858例死亡,病死率高达34.4%[3]。
本次新型冠状病毒肺炎感染最早也是按2003年和2012年世界卫生组织(WHO)推荐的SARS和MERS标准定义的“病因不明的肺炎”确定的,病因不明的肺炎定义为一种无病因的疾病,需符合以下标准:发热(≥38℃),有肺炎的影像学证据,白细胞计数正常或减低,淋巴细胞计数减低,遵循临床指南标准抗菌治疗3~5d,症状没有明显改善[4]。截至2020年1月7日,实验室分离到新型冠状病毒,其全基因组序列与SARS-CoV的基因特征高度相似,分析病毒蛋白核衣壳和棘状核蛋白的结构,证实了其与蝙蝠状SARS-CoV高度相似[5]。至获得PCR诊断试剂后,更容易识别出确诊病例,缩短了病例确诊时间[6]。
早期统计数据显示,截至2020年1月25日下午24时,中国大陆共确诊1 975例新型冠状病毒感染病例,死亡56例,病死率约为2.84%,低于SARS-CoV的9.6%。国家卫健委报道了前17例死亡病例的详细情况。包括男性13例和女性4例。死亡者的平均年龄为75(48~89)岁。在死亡者中,发热(64.7%)和咳嗽(52.9%)是最常见的首发症状。从出现第一症状到死亡的平均天数为14.0(6~41)d,≥70岁者为 11.5(6~19)d,明显短于<70岁者 20(10~41)d;P=0.033。在老年人中,疾病进展更快,病死率更高[7]。
目前已证实新型冠状病毒对人群普遍易感,《新京报》分析目前已公布的死亡病例发现,有高血压、糖尿病、心脑血管疾病等基础疾病的老年患者,病死率更高。统计分析发现,其中60.9%的死亡病例合并有高血压,47.8%合并有糖尿病,17.4%合并有冠心病。
2 ACE2
ACE2蛋白是一类跨膜糖蛋白,其基因位于X染色体(Xp22),长约 3.4kb,全长 805个氨基酸,包括17个氨基酸组成的N端信号肽序列和一个C端膜锚定区。ACE2与ACE均属于肾素-血管紧张素系统(RAS),他们之间具有42%同源性,但与ACE不同,ACE2中还有一个特异的collectrin结构域。ACE2最初认为只分布于心脏、肾脏和胃肠道中,随着研究进展,逐渐发现ACE2在睾丸、肺、结膜、角膜等多个组织中都有表达[8]。只是在其他组织中分布较少而已。
在RAS中,ACE作为一种血管紧张素转换酶,可以将血管紧张素Ⅰ转换为有活性的血管紧张素Ⅱ,从而升高血压。ACE2的作用则存在两条通路,一部分可通过间接通路将血管紧张素Ⅰ(AngⅠ)水解为无活性的血管紧张素(1-9),继而通过中性肽链内切酶(NEP)/ACE,将血管紧张素(1-9)进一步水解为具有活性的血管紧张素(1-7),具有扩张血管、抗炎、抗心肌重构等功能。直接通路中,ACE2将血管紧张素Ⅱ(AngⅡ)水解为血管紧张素(1-7),其催化活性是间接通路的400倍。最终两者产生的血管紧张素(1-7),共同作用于Mas受体,起到扩张血管、抗增殖,增加一氧化氮释放,减少氧化应激等作用[9],与高血压、肾脏疾病、糖尿病等发生密切相关。两者在经典的RAS系统中,通过两条相互制衡的通路,维持RAS系统平衡(图1)。
在肺组织中,ACE2分布于血管内皮细胞、Ⅰ型和Ⅱ型肺泡上皮细胞、肺血管平滑肌细胞和支气管上皮细胞。根据最近研究结果,0.64%的肺组织细胞表达ACE2,其中80%以上位于Ⅱ型肺泡上皮细胞[10]。作为SARS-CoV感染入侵的受体,ACE2同时也介导肺保护机制,它催化AngⅡ水解,减少血管紧张素受体1(AT1)激活所致的肺部毛细血管通透性增高,生成血管紧张素(1-7),作用于Mas受体,减少氧化应激,起到抗炎、抗纤维化等作用,对于肺保护,减少肺功能衰竭具有重要影响。
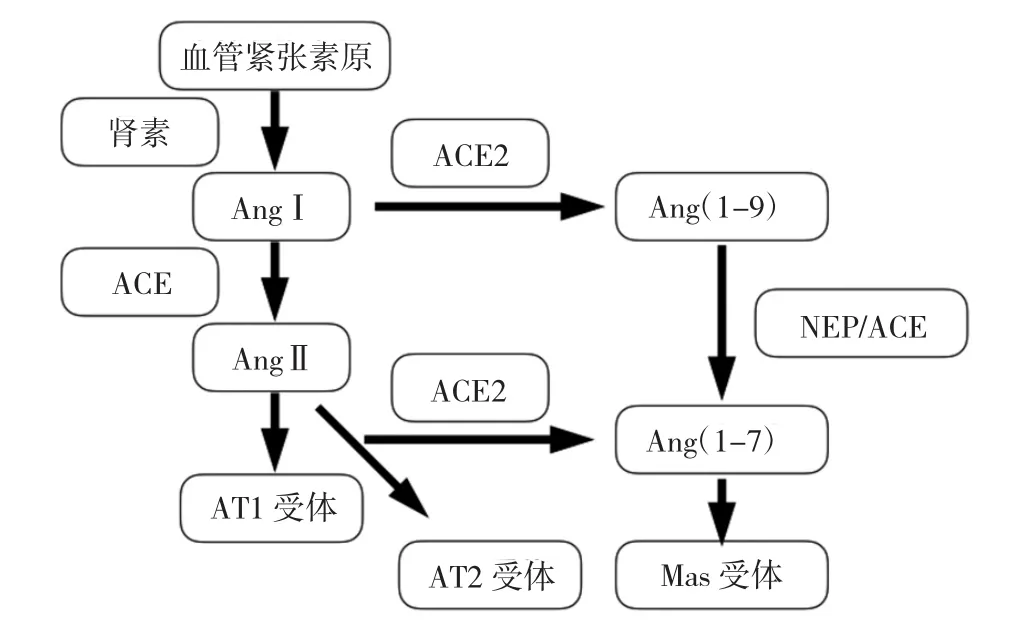
图1 ACE在RAS中的反应过程
3 ACE2和COVID-19
ACE2通常位于肺泡上皮细胞的腔面,SARSCoV病毒表面凸起的Spike蛋白,与呼吸道表面的ACE2相互结合,使SARS-CoV得以进入人体。对疫情早期确诊的5例患者中获得的新型冠状病毒全基因组序列进行分析,其与一种蝙蝠中的冠状病毒的序列一致性高达96%,对比7个保守的非结构蛋白,其Spike蛋白和SARS-CoV的高度相似,两者的差异仅有4个氨基酸[11]。这些蛋白的突变可能决定了它比SARS-CoV具有更高的感染能力和更强的致病性[12]。新型冠状病毒进入细胞的受体与SARSCoV一样,均为ACE2[11]。对新型冠状病毒易感的Ⅱ型肺泡上皮细胞,还高表达其它20多个与病毒复制和传播密切相关的基因,也佐证了它可能是冠状病毒感染的靶细胞[12]。同样,在角膜和结膜组织中也存在ACE2的表达,理论上这些部位都是冠状病毒的潜在感染靶点。但目前尚无动物实验,特别是缺乏ACE2基因敲除动物实验来证实其感染的机制。
既往研究表明,ACE2具有双重身份,对AngⅠ、AngⅡ的水解功能,以及作为SARS-CoV病毒感染受体。冠状病毒感染时Spike蛋白与ACE2结合,导致肺部ACE2蛋白数量和功能的降低,主要后果体现在两方面:AngⅡ水解减少,AngⅡ水平相对或绝对升高,过度刺激AT1[10];血管紧张素(1-7)生成减少,对AngⅡ抑制减低,与Mas受体作用少以致于抗炎因子、NO,前列腺素生成减少[13],使得肺部毛细血管通透性增加,随之出现肺水肿、严重肺损伤和急性肺衰竭。而SARS-CoV感染研究显示,高分化的气道上皮细胞高表达ACE2是SARS-CoV易感性的基础[14]。这让针对ACE2的靶向治疗难以决策。
4 ACE2和心血管疾病
RAS系统是最主要的人体功能调节系统之一,能通过多种双重调节途径来动态调节和保持机体动态平衡,以保持人体各脏器和系统的正常生理功能,几乎在所有心、脑血管循环系统疾病中都具有重要病理作用。
过度激活的RAS系统是高血压形成的原因之一。在高血压患者中,ACE2的表达量降低。正向的ACE-AngⅡ轴是肾素作用于血管紧张素原生成AngⅠ,AngⅠ在ACE的作用下生成AngⅡ作用于AT1而发挥收缩血管、升血压、促凋亡和促增殖等作用。负向的ACE2-血管紧张素(1-7)轴,通过对AngⅠ,AngⅡ的降解,拮抗正向ACE-AngⅡ轴的作用,扩张血管、降低血压、抗增殖和抑制凋亡等,保持机体稳态,维持心血管正常功能[15]。
ACE2还具有抗心室重构作用,动物试验中发现,ACE2过表达可升高血管紧张素(1-7)水平,降低心肌细胞体积并改善心肌胶原蛋白沉积,明显改善心室重构[16]。而ACE2基因敲除大鼠,心脏及血清中AngⅡ水平升高,心肌纤维化、心室重构以及心功能恶化的程度均较为明显[17]。
5 ACE2和RAS抑制剂
RAS抑制剂血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEI) 和血管紧张素Ⅱ受体拮抗剂(angiotensinⅡreceptor blocker,ARB)作为降压药物,还有心脑血管以及肾脏保护、改善左心室肥厚、心力衰竭和预防心房颤动发生等作用。但对于RAS抑制剂在COVID-19中的使用,目前仍存在争议。近日公布的《新型冠状病毒肺炎患者的血压管理建议》中明确指出,考虑COVID-19的发病机制可能是病毒与ACE2结合后导致的一系列瀑布反应,建议停用或ACEI/ARB类降压药物。
感染COVID-19后,ACE2水平下降,RAS系统失衡,正向ACE-AngⅡ轴占据优势,是肺损伤加重的关键之一。而RAS抑制剂ACEI/ARB中,卡托普利、依那普利、赖诺普利、奥美沙坦、坎地沙坦均可增加心脏ACE2 mRNA的表达,赖诺普利、缬沙坦、氯沙坦则可增加肾脏中的ACE2 mRNA的表达[18-20]。且已有研究证实,培哚普利和卡托普利等ACEI能改善ACE-AngⅡ轴过度表达这一情况[21-22]。曾有研究回顾性分析ACEI对病毒性肺炎插管率和病死率的影响,发现入院前给予ACEI不能降低病毒性肺炎患者的病死率和插管率,而院内持续服用可降低病死率和插管率,表明ACEI甚至可能对病毒性肺炎有一定的临床疗效,尽管此研究纳入的病毒性肺炎患者的致病病毒并非冠状病毒[23]。因而,ACEI/ARB可能是这种情况下比较合适的降血压药物。
但ACEI/ARB对肺组织中ACE2水平的影响尚缺乏明确证据,国内仅有动物实验结果提示,ARB的使用可以提高肺组织中ACE2的表达[24-25]。具体对气道上皮细胞ACE2表达的影响尚无研究,仍需要进一步的研究来阐明药物对COVID-19病情的影响。
6 新型冠状病毒感染患者血压管理
病毒感染有多种影响因素,包括病毒暴露量、毒力以及机体免疫情况等,考虑到老年男性、高血压患者普遍存在ACE2表达降低,且此类人群可能存在较多合并症以及靶器官损害,在感染新型冠状病毒之后可能病情更加复杂,引发更为严重的后果甚至肺衰竭,这与目前临床观察的结果相吻合。尚无直接证据证明高血压患者有更高的易感性。
感染患者躯体不适、紧张、焦虑、睡眠障碍等应激状态下,RAS系统激活,儿茶酚胺释放,血管收缩作用会导致血压升高,此时不建议擅自停药,以免会引起更大的血压波动。同时由于可能存在重症感染性休克、容量不足情况,应依据患者血压情况随时增减药物。
7 总结和展望
截至2020年3月初,新型冠状病毒已致7万余人感染,其中死亡患者中大部分为老年或患有高血压、糖尿病等合并症的患者。目前尚无明确证据表明服用ACEI或ARB会增加病毒感染机会或加重感染,对于高血压患者无论是否感染新冠肺炎,不建议擅自停药或更改药物。而此次新型冠状病毒感染流行后,也希望可以针对病原进一步探究其病理生理机制,统计相关数据,总结COVID-19患者血压控制的循证医学证据,指导今后临床工作更好开展。