脑出血的临床试验:过去,现在与将来
2020-04-20叶丰卉万曙华亚
叶丰卉 万曙 华亚
在全球范围内,每年新发的脑出血患者高达两百万例[1]。在中国,脑出血约占所有脑卒中的24%[2],相对西方高收入国家比例更高。过去,脑出血的基础研究和临床研究均相对有限,临床上缺乏有效的干预,导致脑出血患者的预后,包括死亡率和神经功能恢复情况数十年都没有明显的提高[3]。近十多年来陆续开展的一批高质量的全球多中心脑出血治疗临床试验,对于指导临床实践、改善患者预后有重要的指导意义。为了更好地为临床医师提供简明实用的信息,本文主要总结了近年来一些重要的脑出血治疗的临床试验及其结果,对于流行病学以及机制方面的探讨则较为简略。
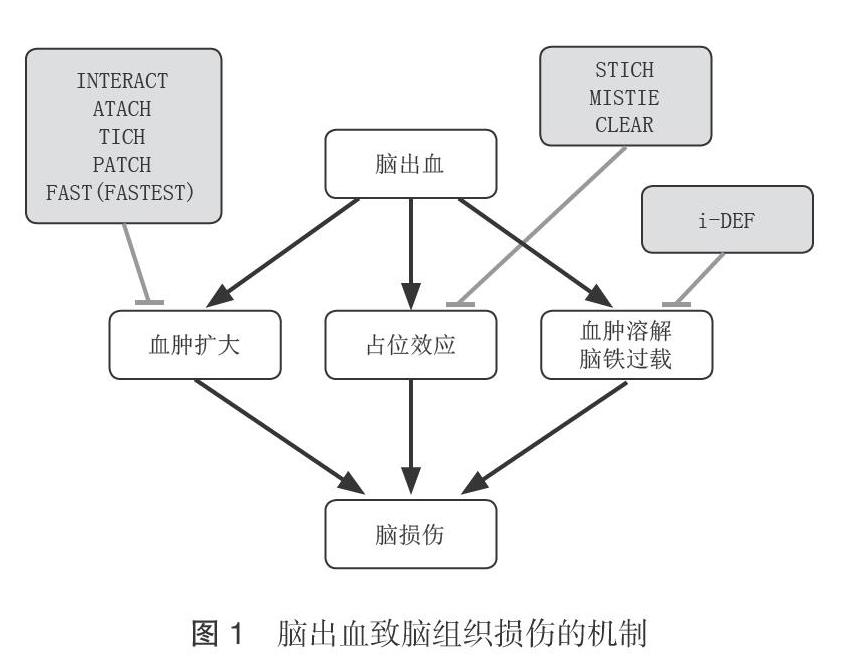
脑出血导致脑组织损伤的机制主要分为以下几个方面[4,5]:(1)血肿的占位效应;(2)血肿进一步扩大导致脑组织的压迫,甚至脑疝形成;(3)血肿内毒性物质导致脑组织损伤。脑出血治疗的临床试验便是针对这些不同的损伤靶点分别进行干预 ,见图1。
1 预防血肿扩大
有相当一部分患者在脑出血后发生血肿的扩大。在一项前瞻性研究中,血肿在24 h内显著性增大(>33%)的患者比例高达38%[6]。早期血肿的扩大可能提示持续出血或者再次出血,是死亡率以及功能预后不良的一个独立危险因素,所以预防血肿扩大在脑出血的干预中显得至关重要[7]。
1.1 早期强化降压治疗 患者在发生脑出血后血压常常明显升高[8],并且预示着相对不良的预后[9]。2005年起,由澳大利亚悉尼大学的Anderson教授发起的跨国多中心的INTERCAT I期及II期临床研究[10-12](ClinicalTrials.gov,NCT00226096,NCT00716079)拉开序幕。此临床试验前后纳入了超过3000名受试者,主要目的是评估早期强化降压对于脑出血治疗的安全性及有效性。试验设计可以概述为:将起病6 h内的血压增高(收缩压150~220 mmHg)的脑出血患者随机分为强化降压治疗组(目标收缩压< 140 mmHg)以及根据当时指南定义的标准血压控制组(目标收缩压< 180 mmHg)进行血压控制治疗。I期临床研究发现早期强化降压治疗明显降低了血肿扩大的患者比例,进而开展的II期研究则提示早期强化降压治疗虽然没有降低死亡率,但是显著降低了90 d Rankin评分,提示早期强化降压治疗对脑出血患者的功能预后有重要意义。2015年的美国脑出血指南据此结果进行了修订,推薦早期强化降压治疗作为标准脑出血治疗[13]。
此后,为了验证进一步降低血压对于脑出血的影响,明尼苏达大学的Qureshi教授发起了ATACH-II研究(NCT01176565),将目标血压进一步降低至收缩压110~139 mmHg,结果显示更低的目标血压与现行的标准血压140~179 mmHg相比,不能改善患者的死亡率和功能预后,反而提高了不良事件的发生率,故而终止了该项研究[14]。综上,我们有理由认为,早期快速将脑出血患者的血压控制并维持在目标血压范围内是安全的,并且可能有利于患者的功能预后[15]。
1.2 重组凝血因子VII治疗 防治血肿的扩大的另一个手段为干预凝血途径或者纤溶途径。2005年,哥伦比亚大学Mayer教授根据其前期临床研究[16],发起了一项研究重组活化因子VII(rFVIIa)治疗急性脑出血的FAST试验(NCT00127283)。该试验纳入841例脑出血患者,在起病4 h内随机给低剂量(20 mg/kg)或者高剂量(80 mg/kg)的rFVIIa或是安慰剂。研究结果显示高剂量的rFVIIa可以显著减少血肿扩大的患者比例但对死亡率和90 d的改良Rankin评分无明显降低,反而还增加了动脉栓塞事件发生的比例[17-18]。于是研究人员猜测,或许只有一部分活动性出血的患者能从rFVIIa治疗中获益。因此他们根据CT图像的点状征(spot sign)而开展了一系列临床试验, 如STOP-IT试验(NCT00810888)以及SPOTLIGHT试验(NCT01359202)。但结果均显示,即便对CT图像存在点状征的脑出血患者,在起病6.5 h内给予rFVIIa治疗仍然不能改善此类患者的影像学以及功能学预后[19]。目前已经注册在案的FASTEST(NCT03496883)试验旨在研究出血2 h之内的超急性期rFVIIa治疗的作用,试验设计为在急救车自带CT确诊患者脑出血后即刻给药。研究者认为在超急性期内给予促凝治疗可能最大程度减少持续出血以及再出血,其结果对于指导院前急救非常有意义,值得关注。
1.3 针对纤溶途径以及血小板的治疗 氨甲环酸(tranexamic acid)是一种临床常用的抗纤溶药物,在创伤性脑出血的治疗中能显著降低死亡率和再出血率[20]。2013年,英国诺丁汉大学Sprigg教授发起了TICH-2试验(ISRCTN registry,ISRCTN93732214),研究氨甲环酸治疗自发性脑出血的安全性和有效性。研究者将2325例脑出血8 h内的受试者随机分为两组,治疗组给予起始剂量氨甲环酸1 g,并在之后的8 h内持续给药,安慰剂组给予安慰剂匹配。结果显示,虽然治疗组的早期死亡率、血肿扩大比例以及严重并发症的发生率有所降低,但是90 d的改良Rankin功能学评估两组比较差异并无统计学意义[21]。
随着抗血小板药物的广泛使用,与之相关的脑出血患者比例呈增高趋势[2,22]。使用抗血小板药物的脑出血患者早期血肿扩大比例更高,预后更差[23-24]。所以人们猜测在脑出血后补充输注血小板可能对这批患者有帮助。这种假设催生了对抗血小板药物相关脑出血患者进行血小板输注治疗的PATCH试验(Netherlands Trial Register,NTR1303)。但此研究因其结果显示血小板输注增高了出血前使用抗血小板药物的患者3个月的死亡率以及住院期间的严重不良事件的发生率而终止[25]。目前尚没有合理的证据支持脑出血后的血小板输注。
2 清除血肿
血肿压迫脑内结构和脑细胞,产生占位效应,升高颅内压,导致相应脑区血流量下降,甚至发生脑疝。为了降低占位效应产生的脑损伤,神经外科医生试图通过外科干预清除血肿从而降低死亡率以及改善功能预后。其中包括几个重要的多中心臨床试验,分别研究开颅血肿清除、微创血肿清除以及脑室内血肿清除对于脑出血的影响[26-28]。
2.1 开颅血肿清除术 在英国Mendelow教授发起的大型全球多中心临床试验STICHI和II(ISRCTN19976990,ISRCTN22153967)中,研究者对比早期开颅清除血肿和保守药物治疗脑出血的安全性和有效性,发现两组6个月的生存率和致残率(格拉斯哥预后评分)无显著差异[26,29]。但在STICHII试验中仍然可以观察到手术对于浅表不伴脑室出血的脑出血患者有一定的生存优势。STICH研究得出相对中性的结果可能的原因是开颅手术本身造成的的创伤一定程度上中和了其益处,于是在STICHI结果发表的第2年,约翰霍普金斯大学的Hanley教授就发起了微创手术联合溶栓药物治疗脑出血的MISTIE试验(NCT00224770)。
2.2 微创血肿清除术 近年来,随着新兴技术在外科手术中的应用,微创手术在脑外科治疗中扮演越来越重要的角色,其创伤小、手术时间短,对于患者的功能恢复有着重要意义。在MISTIE试验中,研究者将脑出血体积超过20 mL的受试患者随机分为手术组和药物治疗组,手术组患者接受影像学辅助的微创手术放置引流导管,并给予阿替普酶0.3 mg或1.0 mg每8 h液化血肿[27]。该研究认为微创手术置管联合阿替普酶治疗是相对安全的。MISTIEIII(NCT01827046)研究使用高剂量阿替普酶治疗血肿体积超过30 mL的患者(目标血肿体积小于15mL),发现手术组患者的生存率得到了明显提高,但随访1年,手术组患者神经功能并未显著改善[30]。
事实上,因为手术治疗的临床试验影响因素众多,实际操作困难,这类临床试验相对罕见。手术相关的临床试验的试验设计、亚组人群筛选、参与人员的规范培训等,对于研究的有效性和可靠性至关重要。在MISTIE研究中,患者手术时机为出血停止后(平均分组时间为起病后47 h),而脑出血的治疗的时机尚无像脑缺血一样公认的标准治疗时间窗。有学者认为或许提早手术干预时间会更有利于患者预后[31]。
2.3 脑室内血肿清除 合并脑室内出血是脑出血预后的一个独立危险因素[32],神经外科医生往往通过脑室内置管引流脑脊液,减低颅内压。CLEARIII研究(NCT00784134)就针对这一问题,提出使用阿替普酶溶解脑室内血肿并进行引流,从而清除脑室内积血,改善脑室梗阻。受试者为脑实质内出血小于30 mL,但伴随严重脑室内出血,常规脑室内置管的重症监护室住院患者。实验组每8 h给予1 mg阿替普酶,对照组给予等量生理盐水。但遗憾的是试验结果显示180 d后,患者的死亡率虽然明显降低,但重残率却明显增高了,故判定患者总体神经功能预后并未得到显著改善[33],未来还需进一步研究是否提高阿替普酶的用药频率可以改善脑室内出血患者的功能预后。
3 减少血肿内毒性物质
血肿在消融过程中会释放出一系列神经毒性物质,包括血红蛋白、铁、凝血酶以及炎症介质等,对神经细胞产生二次损伤[4]。这些神经毒性物质的释放诱发剧烈的炎症反应,并激活脑实质原位小胶质细胞、募集源自外周循环的炎症细胞,导致全脑炎症反应[34-35]。许多动物实验提示,脑出血后的炎症反应不仅在脑损伤中起到重要作用,而且在损伤修复中也有一定作用[35]。至于如何通过干预炎症反应,减轻脑损伤却尚不明确。
从动物实验中我们发现,血红蛋白中释放的铁在脑出血后的二次神经损伤中起到重要的作用,包括促进细胞凋亡、细胞自噬、介导氧化应激反应和炎症反应[36-38]。而铁螯合剂甲磺去铁胺(deferoxamine mesylate)[39-41]或米诺环素(minocycline)[42-44]可以通过影响铁在脑中的代谢从而缓解铁的神经毒性。由于去铁胺在治疗脑出血的I期临床试验中呈现良好的安全性[45],故从2014年起,哈佛大学医学院Selim教授发起了全球多中心i-DEF试验(NCT02175225),此试验旨在研究去铁胺治疗脑出血的安全性,并根据其结果判定是否进行III期临床试验。试验纳入了294例脑出血患者,治疗组从出血后24 h内开始给予去铁胺32 mg/kg每天,持续3 d,而对照组给予相应剂量的生理盐水。结果显示去铁胺治疗呈现良好的安全性,但两组主要疗效指标差异无统计学意义[46]。这个试验观察到在起病3~6个月间,患者的神经功能有进一步恢复的趋势,且治疗组患者在180 d的神经恢复情况优于对照组。由于去铁胺敏价格低廉,用药方式简单,非常值得我们进一步研究探讨其在脑出血中治疗的作用[47],也为我们将来设计和解读脑出血临床试验提供了一些新的角度。米诺环素是一种广谱四环素类抗生素,具有抗金属蛋白酶以及螯合铁的作用,在脑缺血的临床试验中呈现良好的脑保护作用[48]。一个单中心小型临床试验MACH(NCT01805895)显示静脉用米诺环素在脑出血的治疗中是安全的,但尚需进一步的临床研究来证明其有效性[49]。
综上所述,目前自发性脑出血的治疗仍然存在很大的空白,缺乏有力的循证医学证据。不同临床试验对于治疗时间窗以及疗效评价的时间点均存在差异。目前的证据表明,早期强化血压控制以及相应的防止血肿扩大的手段对于患者的功能预后有着至关重要的作用,而微创手术联合溶栓药物进行血肿清除尚未显示出明显的优越性。对于脑内毒性物质的清除方向,铁作为一个重要靶点,仍迫切需要进行进一步的临床试验研究。未来的临床研究或许可以将血肿的手术清除与清除毒性物质的药物联合治疗,使血肿对脑组织的二次损伤尽可能地减少,以取得更有利的临床结局。
參考文献
[1] Adeoye O, Broderick JP. Advances in the management of intracerebral hemorrhage [J]. Nat Rev Neurol, 2010, 6(11):593-601.
[2] Wu S, Wu B, Liu M, et al.Stroke in China: advances and challenges in epidemiology, prevention, and management [J]. Lancet Neurol, 2019, 18(4):394-405.
[3] van Asch CJ, Luitse MJ, Rinkel GJ, et al. Incidence, case fatality, and functional outcome of intracerebral haemorrhage over time, according to age, sex, and ethnic origin: a systematic review and meta-analysis [J]. Lancet Neurol, 2010, 9(2):167-176.
[4] Keep RF, Hua Y, and Xi G. Intracerebral haemorrhage: mechanisms of injury and therapeutic targets [J]. Lancet Neurol, 2012, 11(8):720-731.
[5] Xi G, Keep RF, Hoff JT. Mechanisms of brain injury after intracerebral haemorrhage [J]. Lancet Neurol, 2006, 5(1):53-63.
[6] Brott T1, Broderick J, Kothari R, et al.Early hemorrhage growth in patients with intracerebral hemorrhage [J]. Stroke, 1997, 28(1):1-5.
[7] Davis SM, Broderick J, Hennerici M, et al. Hematoma growth is a determinant of mortality and poor outcome after intracerebral hemorrhage [J]. Neurology, 2006, 66(8):1175-1181.
[8] Qureshi AI, Ezzeddine MA, Nasar A,et al. Prevalence of elevated blood pressure in 563,704 adult patients with stroke presenting to the ED in the United States [J]. Am J Emerg Med, 2007, 25(1):32-38.
[9] Ohwaki K, Yano E, Nagashima H, et al. Blood pressure management in acute intracerebral hemorrhage: relationship between elevated blood pressure and hematoma enlargement [J]. Stroke, 2004, 35(6):1364-1367.
[10] Anderson CS, Huang Y, Arima H, et al. Effects of early intensive blood pressure-lowering treatment on the growth of hematoma and perihematomal edema in acute intracerebral hemorrhage: the Intensive Blood Pressure Reduction in Acute Cerebral Haemorrhage Trial (INTERACT) [J]. Stroke, 2010, 41(2):307-312.
[11] Anderson CS,Huang Y,Wang JG,et al. Intensive blood pressure reduction in acute cerebral haemorrhage trial (INTERACT): a randomised pilot trial [J]. Lancet Neurol, 2008, 7(5):391-399.
[12] Anderson CS, Heeley E,Huang Y, et al. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage [J]. N Engl J Med, 2013, 368(25) 2355-2365.
[13] Hemphill JC 3rd, Greenberg SM, Anderson CS, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association [J]. Stroke, 2015, 46(7): 2032-2060.
[14] Qureshi AI,Palesch YY, Barsan WG, et al. Intensive blood-pressure lowering in patients with acute cerebral hemorrhage [J]. N Engl J Med, 2016, 375(11):1033-1043.
[15] Moullaali TJ,Wang X,Martin RH, et al. Blood pressure control and clinical outcomes in acute intracerebral haemorrhage: a preplanned pooled analysis of individual participant data [J]. Lancet Neurol, 2019, 18(9):857-864.
[16] Sheth KN. Recombinant activated factor VII for acute intracerebral hemorrhage [J]. N Engl J Med, 2005, 352(10):2133-2134.
[17] Mayer SA,Brun NC,Begtrup K,et al.Efficacy and safety of recombinant activated factor VII for acute intracerebral hemorrhage [J]. N Engl J Med, 2008, 358(20):2127-2137.
[18] Diringer MN,Skolnick BE,Mayer SA,et al.Thromboembolic events with recombinant activated factor VII in spontaneous intracerebral hemorrhage: results from the Factor Seven for Acute Hemorrhagic Stroke (FAST) trial [J]. Stroke, 2010, 41(1):48-53.
[19] Gladstone DJ,Aviv RI,Demchuk AM, et al.Effect of recombinant activated coagulation factor VII on hemorrhage expansion among patients with spot sign-positive acute intracerebral hemorrhage: the SPOTLIGHT and STOP-IT randomized clinical trials [J]. JAMA Neurol, 2019, 76(12)1493-1501.
[20] CRASH-2 trial collaborators,Shakur H,Roberts I,et al.Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial [J]. Lancet, 2010, 376(9734):23-32.
[21] Sprigg N,Flaherty K,Appleton JP,et al.Tranexamic acid for hyperacute primary IntraCerebral Haemorrhage (TICH-2): an international randomised, placebo-controlled, phase 3 superiority trial [J]. Lancet, 2018, 391(10135):2107-2115.
[22] Lovelock CE,Molyneux AJ,Rothwell PM,et al.Change in incidence and aetiology of intracerebral haemorrhage in Oxfordshire, UK, between 1981 and 2006: a population-based study [J]. Lancet Neurol, 2007, 6(6):487-493.
[23] Naidech AM,Jovanovic B,Liebling S,et al.Reduced platelet activity is associated with early clot growth and worse 3-month outcome after intracerebral hemorrhage [J]. Stroke, 2009, 40(7): 2398-2401.
[24] Thompson BB,Béjot Y,Caso V,et al. Prior antiplatelet therapy and outcome following intracerebral hemorrhage: a systematic review [J]. Neurology, 2010, 75(15):1333-1342.
[25] Baharoglu MI, Cordonnier C, Salman RA, et al. Platelet transfusion versus standard care after acute stroke due to spontaneous cerebral haemorrhage associated with antiplatelet therapy (PATCH): a randomised, open-label, phase 3 trial [J]. Lancet, 2016, 387(10038):2605-2613.
[26] Mendelow AD, Gregson BA, Fernandes HM, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH): a randomised trial [J]. Lancet, 2005, 365(9457):387-397.
[27] Hanley DF, Thompson RE,Muschelli J, et al.Safety and efficacy of minimally invasive surgery plus alteplase in intracerebral haemorrhage evacuation (MISTIE): a randomised, controlled, open-label, phase 2 trial [J]. Lancet Neurol, 2016, 15(12):1228-1237.
[28] Naff N,Williams MA,Keyl PM, et al. Low-dose recombinant tissue-type plasminogen activator enhances clot resolution in brain hemorrhage: the intraventricular hemorrhage thrombolysis trial [J]. Stroke, 2011, 42(11):3009-3016.
[29] Mendelow AD,Gregson BA,Rowan EN, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH II): a randomised trial [J]. Lancet, 2013, 382(9890):397-408.
[30] Hanley DF, Thompson RE, Rosenblum M, et al. Efficacy and safety of minimally invasive surgery with thrombolysis in intracerebral haemorrhage evacuation (MISTIE III): a randomised, controlled, open-label, blinded endpoint phase 3 trial [J]. Lancet, 2019, 393(10175):1021-1032.
[31] Cordonnier C, Tymianski M. Mistie III [J]. Stroke, 2019, 50(6): 1634-1635.
[32] Hanley DF. Intraventricular hemorrhage: severity factor and treatment target in spontaneous intracerebral hemorrhage [J]. Stroke, 2009, 40(4):1533-1538.
[33] Hanley DF, Lane K, McBee N,et al.Thrombolytic removal of intraventricular haemorrhage in treatment of severe stroke: results of the randomised, multicentre, multiregion, placebo-controlled CLEAR III trial [J]. Lancet, 2017, 389(10069):603-611.
[34] Aronowski J,Zhao X. Molecular pathophysiology of cerebral hemorrhage: secondary brain injury [J]. Stroke, 2011, 42(6):1781-1786.
[35] Shi K,Tian DC, Li ZG, et al. Global brain inflammation in stroke [J]. Lancet Neurol, 2019, 18(11):1058-1066.
[36] Huang FP, Xi G,Keep RF, et al. Brain edema after experimental intracerebral hemorrhage: role of hemoglobin degradation products [J]. J Neurosurg, 2002, 96(2):287-293.
[37] Wagner KR, Sharp FR,Ardizzone TD, et al. Heme and iron metabolism: role in cerebral hemorrhage [J]. J Cereb Blood Flow Metab, 2003, 23(6):629-652.
[38] Hua Y, Keep RF, Hoff JT, et al. Brain injury after intracerebral hemorrhage: the role of thrombin and iron [J]. Stroke, 2007, 38(2 Suppl):759-762.
[39] Gu Y, Hua Y, Keep RF, et al.Deferoxamine reduces intracerebral hematoma-induced iron accumulation and neuronal death in piglets [J]. Stroke, 2009, 40(6):2241-2243.
[40] Okauchi M, Hua Y,Keep RF, et al.Deferoxamine treatment for intracerebral hemorrhage in aged rats: therapeutic time window and optimal duration [J]. Stroke, 2010, 41(2):375-382.
[41] Nakamura T, Keep RF, Hua Y, et al., Deferoxamine-induced attenuation of brain edema and neurological deficits in a rat model of intracerebral hemorrhage [J]. J Neurosurg, 2004, 100(4):672-678.
[42] Zhao F, Hua Y, He Y, et al. Minocycline-induced attenuation of iron overload and brain injury after experimental intracerebral hemorrhage [J]. Stroke, 2011, 42(12): 3587-3593.
[43] Cao S, Hua Y, Keep RF, et al. Minocycline Effects on Intracerebral Hemorrhage-Induced Iron Overload in Aged Rats: Brain Iron Quantification With Magnetic Resonance Imaging [J]. Stroke, 2018, 49(4):995-1002.
[44] Dai S, Hua Y, Keep RF, et al. Minocycline attenuates brain injury and iron overload after intracerebral hemorrhage in aged female rats [J]. Neurobiol Dis, 2019, 126:76-84.
[45] Selim M, Yeatts S, Goldstein JN, et al. Safety and tolerability of deferoxamine mesylate in patients with acute intracerebral hemorrhage [J]. Stroke, 2011, 42(11):3067-3074.
[46] Selim M, Foster LD, Moy CS, et al. Deferoxamine mesylate in patients with intracerebral haemorrhage (i-DEF): a multicentre, randomised, placebo-controlled, double-blind phase 2 trial [J]. Lancet Neurol, 2019, 18(5):428-438.
[47] Anderson CS. Reduction of iron neurotoxicity in intracerebral haemorrhage [J]. Lancet Neurol, 2019, 18(5):416-417.
[48] Lampl Y,Boaz M, Gilad R, et al.Minocycline treatment in acute stroke: an open-label, evaluator-blinded study [J]. Neurology, 2007, 69(14):1404-1410.
[49] Fouda AY, Newsome AS, Spellicy S, et al. Minocycline in Acute Cerebral Hemorrhage: An Early Phase Randomized Trial [J]. Stroke, 2017, 48(10):2885-2887.
(收稿日期:2019-12-06)
(本文編辑:林雪怡)
