miR-454-3p靶向BPTF表达调控肺癌细胞A549增殖、迁移和侵袭
2020-04-20籍佳琦高凌云付泽伟李熙霞杨丽青刘文媛
籍佳琦,高凌云,付泽伟,李熙霞,杨丽青,刘文媛,汪 英
目前,肺癌已经成为中国男性发病率和病死率最高的肿瘤之一[1],尽管肺癌的靶向治疗取得飞速发展,其5年生存率依旧较低,不足16%[2],癌细胞的侵袭转移是造成肺癌病死率居高不下的主要原因[3]。微小RNA(miRNA)是近年发现的一类长度约为22个核苷酸的内源性非编码短链RNA,许多miRNA与肿瘤细胞增殖、迁移侵袭等有关[3]。miRNA通过调控靶基因的表达,在多种肿瘤的发生、发展过程中发挥促癌或抑癌基因的作用。目前已有研究证实,miR-454-3p在膀胱癌、乳腺癌等肿瘤中表达降低,对人类肿瘤的发生、发展中具有重要的负向调控作用[4-5]。但是miR-454-3p在肺癌发生、发展中的功能和机制却知之甚少。本文旨在验证miR-454-3p在肺癌细胞株中低表达,其过表达显著抑制肺癌细胞株的增殖、迁移和侵袭能力及其对BPTF的靶向调控作用,阐明miR-454-3p在肺癌发生、发展中的作用,以期为肺癌的临床靶向治疗提供新的潜在治疗靶点。
1 材料与方法
1.1 临床资料收集2018年6月~2018年11月四川省人民医院(东院)手术切除经液氮保存的新鲜冷冻组织,包括33例肺腺癌组织及相应癌旁正常组织,癌旁选取距离病变部位>2 cm组织。本实验经本院伦理委员会批准,患者均知情并签署同意书,所有标本均经两位病理医师确诊。
1.2 实验材料人肺癌细胞系(H1437、A549、H1299、H1975、H460)、正常肺上皮细胞(HBE)和293T细胞,均购自美国ATCC细胞库。DMEM、RPMI 1640、DMEM-F12培养基和胎牛血清(FBS),均购自Gibco公司。胰酶购自Sigma公司,引物购自南京金斯瑞公司。PrimeScript RT Reagents Kit逆转录试剂盒和SYBR Premix EX Taq,均购自日本Takara公司。miR-454-3p mimic、双荧光素酶报告基因试剂盒,均购自广州锐博公司。Transwell试剂盒购自美国BD公司。CCK-8试剂盒购自东仁化学科技公司。抗体BPTF(1 ∶1 000)、MMP-2(1 ∶1 000)、MMP-9(1 ∶2 000)、E-cadherin(1 ∶2 000)、N-cadherin(1 ∶2 000)、GAPDH(1 ∶5 000),均购自美国CST公司。
1.3 方法
1.3.1细胞培养和传代 H1437、A549、H1299、H1975和H460细胞培养于含有10%FBS的DMEM培养基,HBE培养在含有10% FBS的RPMI 1640培养基中。所有细胞置于37 ℃、5%CO2的培养箱内。细胞融合率达90%时,移去培养液并用FBS缓冲液冲洗2次。加入适量胰酶消化后,加入2 mL培养基中止消化。轻轻吹打至细胞脱落,将悬浮细胞离心(1 000 r/min×5 min),重悬后继续培养。
1.3.2 miR-454-3p mimic转染A549细胞取对数期生长细胞接种到6孔板中,当细胞生长70%~80%融合度时,采用Lipofectamine 3000转染细胞;转染前用Opti-MEM培养基分别稀释Lipofectamine 3000和miR-454-3p,混匀,室温下孵育5 min,加入培养基中转染细胞。转染48 h后收集细胞,采用RT-PCR检测转染效率。
1.3.3 RT-PCR采用Trizol试剂盒提取总RNA,定量,反转录试剂盒反转成cDNA。RT-PCR采用 SYBR Premix EX Taq。采用2-ΔΔCt法定量,U6作为内参。
1.3.4 Western blot法miR-454-3p mimic转染A549细胞48 h 后,收集细胞。使用RIPA裂解液提取总蛋白,BCA试剂盒进行蛋白定量。SDS-PAGE凝胶垂直电泳,转膜,5%脱脂牛奶孵育封闭1 h,用稀释后的一抗过夜孵育,TBST洗膜10 min×3次,HRP标记的二抗孵育1 h,TBST洗膜10 min×3次,ECL化学发光法显影后曝光,相关图像分析软件进行灰度值测定,以GAPDH为内参。
1.3.5 CCK-8实验取对数期生长的A549细胞,分别转染miR-454-3p及其对照24 h后,胰酶消化后制备单细胞悬液,并计数。向96孔板中加入100 μL含细胞数约为2 000个的培养基,培养24、48、72、96 h后,向每孔中加入10 μL的CCK8溶液,继续培养2 h,酶标仪测定450 nm的吸光度值。
1.3.6 迁移和侵袭实验非基质胶覆盖和基质胶覆盖的Transwell小室实验检测细胞的迁移和侵袭能力,将各组细胞胰酶消化后,离心,用不含血清的培养基重悬,计数,制备成单细胞悬液。接种3×104个细胞至上室,下室中加入700 μL的20% FBS的培养基,培养24 h。用棉签擦去上室未穿过孔膜的细胞,4%多聚甲醛固定10 min,15%结晶紫染色15 min,显微镜下观察,随机选6个视野,计数穿膜细胞,平均细胞表示细胞的迁移能力。侵袭实验与迁移实验的区别是在接种细胞前,上室预铺Matrigel基质胶。
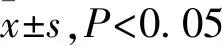
2 结果
2.1 miR-454-3p在肺癌组织以及肺癌细胞株中的表达RT-PCR检测结果显示,miR-454-3p在肺癌组织中表达明显低于癌旁正常组织,与癌旁正常组织中的表达相比,差异有显著性(P<0.01,图1)。与人正常肺上皮细胞(HBE)相比,miR-454-3p在肺癌细胞系(H1437、 A549、 H1299、H1975和H460)中的表达明显下调(P<0.05),其中A549的表达量最低(图2)。
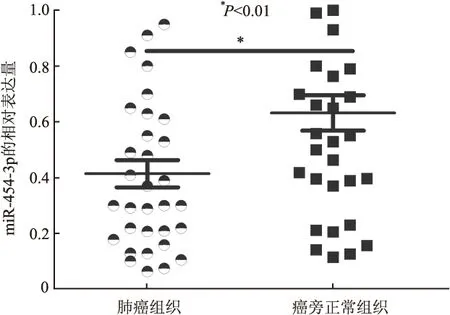
图1 miR-454-3p在肺癌和癌旁肺组织中的表达
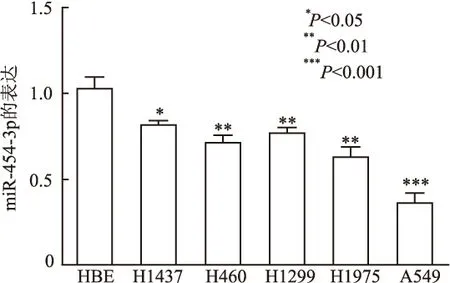
图2 miR-454-3p在不同肺癌细胞系和正常细胞中的表达水平比较
2.2 过表达miR-454-3p对A549肺癌细胞增殖的影响鉴于miR-454-3p在A549的表达含量最低,因此选择A549作为实验对象。miR-454-3p mimic转染A549细胞后,RT-PCR定量结果显示,过表达组(转染miR-454-3p的mimics)A549细胞中miR-454-3p的表达含量明显高于对照组(转染mimics-NC),差异有统计学意义(P<0.001,图3A) CCK8检测结果显示,miR-454-3p mimic处理显著抑制肺癌细胞A549的增殖(P<0.05,图3B)。
图3 A549细胞转染miR-454-3p mimic后miR-454-3p表达水平(A)及对细胞活力的影响(B)
2.3 上调miR-454-3p与A549肺癌细胞迁移和侵袭的关系采用迁移和侵袭实验检测过表达miR-454-3p对细胞迁移和侵袭能力的影响。无基质胶的Transwell小室实验结果表明,与对照组相比,miR-454-3p过表达组细胞侵袭能力明显下降(图4A)。Transwell小室实验检测A549细胞的侵袭能力,结果显示:过表达miR-454-3p也显著抑制细胞的侵袭能力(图4B)。以上实验结果提示过表达miR-454-3p可显著抑制A549肺癌细胞迁移和侵袭能力。
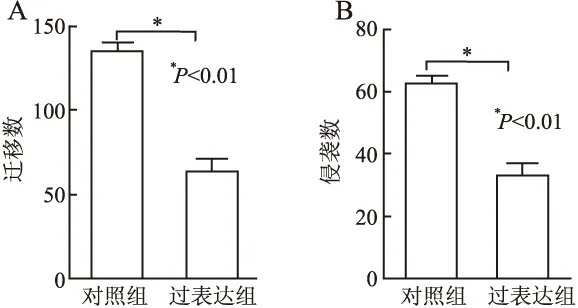
图4 上调miR-454-3p能抑制A549肺癌细胞迁移(A)和侵袭(B)
2.4 miR-454-3p与BPTF 3′UTR的关系miR-454-3p在肺癌细胞系中的低表达,提示其可能是抑癌miRNA。生物信息学软件Targetscan和miRanda分析结果表明,miR-454-3p在BPTF 3′ UTR之间有良好的配对关系(图5A),在此基础上构建野生型和突变型的BPTF真核表达载体。双荧光素酶报告基因结果表明:miR-454-3p能显著降低BPTF 3′ UTR荧光素酶活性(P<0.01,图5B),Western blot检测结果进一步显示,在A549细胞中过表达miR-454-3p可以显著降低BPTF的表达(图5C),差异有统计学意义 (P<0.05)。
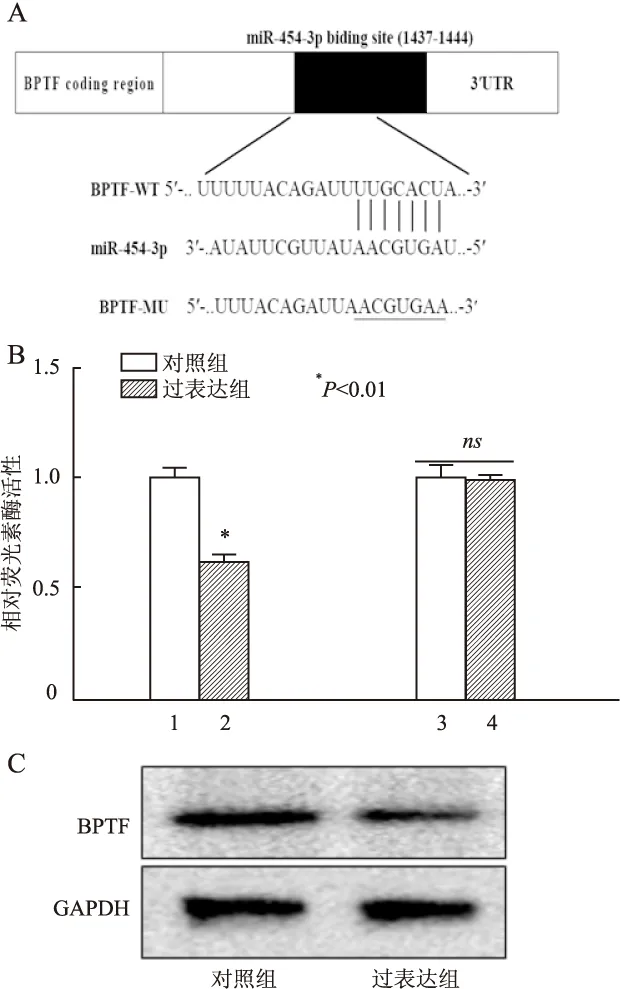
图5 miR-454-3p直接靶向BPTF:A. miR-454-3p与BPTF 3′UTR互补配对序列;B.各组细胞中荧光素酶活性的比较:1.miR-454-3p-NC+BPTF-WT;2.miR-454-3p-mimic+BPTF-WT;3.miR-454-3p-NC+BPTF-MUT;4.miR-454-3p-mimic+BPTF-WT,ns为两组之间差异无统计学意义;C.Western blot法检测A549细胞中BPTF蛋白的表达水平
2.5 miR-454-3p调控A549肺癌细胞迁移和侵袭相关蛋白的表达Western blot法检测结果表明,与对照组相比,miR-454-3p过表达组中迁移相关蛋白MMP-2和MMP-9的表达降低。此外,miR-454-3p过表达显著抑制侵袭相关蛋白N-cadherin,而N-cadherin的负向调控蛋白E-cadherin的表达显著增加(图6)。
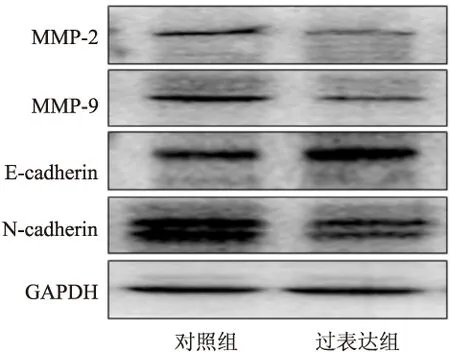
图6 Western blot法检测A549细胞迁移和侵袭相关蛋白的表达
3 讨论
随着肿瘤生物治疗研究的不断加深和进步,从分子生物学角度寻找肺癌进展及转移的靶向治疗已成为目前研究的热点[6]。miRNA是一类高度保守的内源性短链mRNA,通过与靶基因3′UTR相结合,降解靶基因mRNA或者抑制其翻译调控基因的表达[7-8]。越来越多的miRNA如miRNA-421、miRNA-527 被报道参与肺肿瘤细胞的增殖、迁移、侵袭等生物学行为[9-10]。miR-454-3p是近年发现的参与多种肿瘤过程的miRNA,miR-454-3p通过靶向抑癌基因BTG1增强肾癌细胞对放疗的敏感性[11],miR-454-3p在膀胱癌组织和细胞系中表达下调,可通过下调ZEB2基因的表达,抑制癌细胞增殖并抑制细胞侵袭和转移[12]。以上研究提示miR-454-3p的表达失调或功能异常在肺癌的发生、发展中可能扮演重要的角色,但miR-454-3p在肺癌中的功能及机制研究未见报道。
本实验结果显示,miR-454-3p在肺癌组织和肺癌细胞中的表达均低于正常肺组织和肺上皮细胞,提示miR-454-3p可能具有抑制肺癌细胞生长的作用,本实验选取表达含量最低的肺癌细胞A549为实验对象,转染miR-454-3p的mimics上调其表达,结果发现高表达miR-454-3p明显抑制肺癌细胞的增殖,同时降低癌细胞的迁移和侵袭能力。EMT是具有上皮表型的细胞在特定的病理生理情况下转化为具有间质表型细胞的过程,表现为丢失上皮细胞表型E-cadherin,增加vimentin和N-cadherin等间质表型,从而使细胞黏附力下降,迁移和侵袭能力增加[13]。Western blot结果显示,miR-454-3p过表达可以上调细胞中上皮细胞表型E-cadherin蛋白表达,间质表型N-cadherin蛋白表达下调,提示miR-454-3p可能抑制肺癌EMT的进展,进而抑制细胞的迁移和侵袭能力。 此外,本实验利用Targetscan和miRanda数据库预测miR-454-3p的靶基因,最终选定BPTF作为miR-454-3p的候选靶基因。BPTF溴区PHD结构域转录因子,近年研究发现其在人类多种肿瘤中高表达,参与肿瘤细胞增殖、迁移和侵袭等过程,与肿瘤的发生、发展及转移能力密切相关[14-15]。BPTF在肺癌细胞中的研究报道较少。本实验进一步构建含BPTF 3′UTR序列的荧光素酶报告重组质粒,再进行双荧光素酶报告基因分析,共转染后荧光素酶的活性受到抑制,提示miR-454-3p可直接与BPTF基因的3′UTR相结合。A549细胞瞬转入miR-454-3p的mimics后,Western blot检测发现BPTF蛋白表达降低, 以上结果表明miR-454-3p可以负向调控BPTF,抑制其表达。
综上所述,在肺癌细胞中miR-454-3p呈低表达,上调miR-454-3p能抑制BPTF蛋白表达、抑制A549细胞的增殖、迁移和侵袭。以上结果为miR-454-3p在肺癌中的调控机制提供了实验依据,但是miR-454-3p在肺癌中的临床意义仍有待于进一步探讨。
