高纯碳酸锂制备研究进展
2020-04-07戴江洪王宏岩
戴江洪, 王宏岩, 李 平
(中国恩菲工程技术有限公司, 北京 100038)
0 引言
锂作为“21世纪能源新贵”,是自然界最轻的金属,有着电导率高和化学活性强等特点。同时,锂也是能量密度最高的电池材料,被称为“能源金属”和“推动世界前进的重要元素”[1-4]。
碳酸锂作为锂盐中最重要的一种,被广泛用于电池、材料、医药、信息产业和原子产业等高科技和传统工业领域[5-6]。 2011年,超40%的锂资源以碳酸锂的形式用于铝的生产、连铸、陶瓷、玻璃和电池行业[7]。不同行业对碳酸锂有不同的要求,纯度是碳酸锂非常重要的指标, 军工、航天等快速增长的应用领域所需均为高纯碳酸锂,高纯碳酸锂的制备已成为研究的热点。
高纯碳酸锂制备的关键步骤是杂质的去除,而杂质中钙和镁因其性质与锂非常相近,去除非常困难,这是高纯碳酸锂制备的最大难点所在。 目前高纯碳酸锂的制备方法主要分为两类:直接合成法和粗碳酸锂提纯法。
1 直接合成法
直接合成法即直接合成高纯碳酸锂,主要有LiOH溶液NH4HCO3沉淀法、LiOH溶液CO2沉淀法和LiCl溶液CO2沉淀法。
1.1 LiOH溶液NH4HCO3沉淀法
LiOH溶液NH4HCO3沉淀法是将高纯的LiOH溶液与NH4HCO3溶液按一定配比混合,反应生成高纯Li2CO3,通过加热除去Li2CO3上残留的铵,反应机理见式(1)。
2LiOH+NH4HCO3→Li2CO3↓+NH3·H2O+H2O
(1)
LiOH溶液NH4HCO3沉淀法对两种反应物纯度的要求非常高,而且释放出来的氨气需要回收[8]。
1.2 LiOH溶液CO2沉淀法
LiOH溶液CO2沉淀法是采用CO2沉淀、冷冻过滤、LiOH重结晶等工艺提纯LiOH,再将CO2通入到LiOH溶液中,两者反应生成碳酸锂沉淀,反应机理见式(2)。
2LiOH+CO2→Li2CO3↓+H2O
(2)
Sun等[9]利用降膜塔研究LiOH与CO2的反应,并提出反应的最佳pH值在9.0~9.5之间,提高温度和LiOH浓度都会增大粒径,增大CO2流速对粒径无影响,但可以提高CO2的吸收率,增大LiOH溶液流速可以提高Li2CO3的产率,最终制得的Li2CO3纯度高于99.8%;马爱军等[10]在LiOH完成液中加入Bys-201型络合剂,络合剂在LiOH溶液碳化过程中与钙、镁、硼发生络合反应生成稳定化合物,并探究了适宜的工艺条件:氢化温度20 ℃、氢化时间90 min、CO2流速2.5 L/min、络合剂用量3 g/L,在此条件下可以除去98%的钙镁硼。 LiOH溶液CO2沉淀法是目前制备碳酸锂最直接、应用最广泛的方法。 但是该法对LiOH溶液要求高,制备过程需要预除杂工艺提纯LiOH。
1.3 LiCl溶液CO2沉淀法
LiCl溶液CO2沉淀法是将CO2气体通入到LiCl溶液中,采取萃取等方法分离反应产物HCl,促使反应不断发生,Li2CO3不断生成,反应机理见式(3)。
2LiCl+CO2+H2O→Li2CO3↓+2HCl
(3)
用LiCl做原料生产高纯Li2CO3的常用方法是利用高纯度的LiCl溶液与Na2CO3反应得到高纯Li2CO3[11]。 而用LiCl与CO2反应很少见,因为常温下LiCl与CO2反应的ΔrGθ>0,反应难以自发进行。Zhou等[12]利用偶合反应与溶剂萃取的方法使该反应在常温下持续进行,利用N235萃取剂(50%N235与50%异辛醇混合)萃取生成物HCl,促使反应连续发生,得到粒度不同的Li2CO3(图1是其反应示意图),并通过对Li2CO3晶体生长环境的探索,用Water-in-oil结构解释Li2CO3晶体粒度不同的现象,发现增大O/A(有机溶剂/水)以及增加表面活性剂可以提高小颗粒的产量,升温可以得到片状或者大块Li2CO3颗粒。
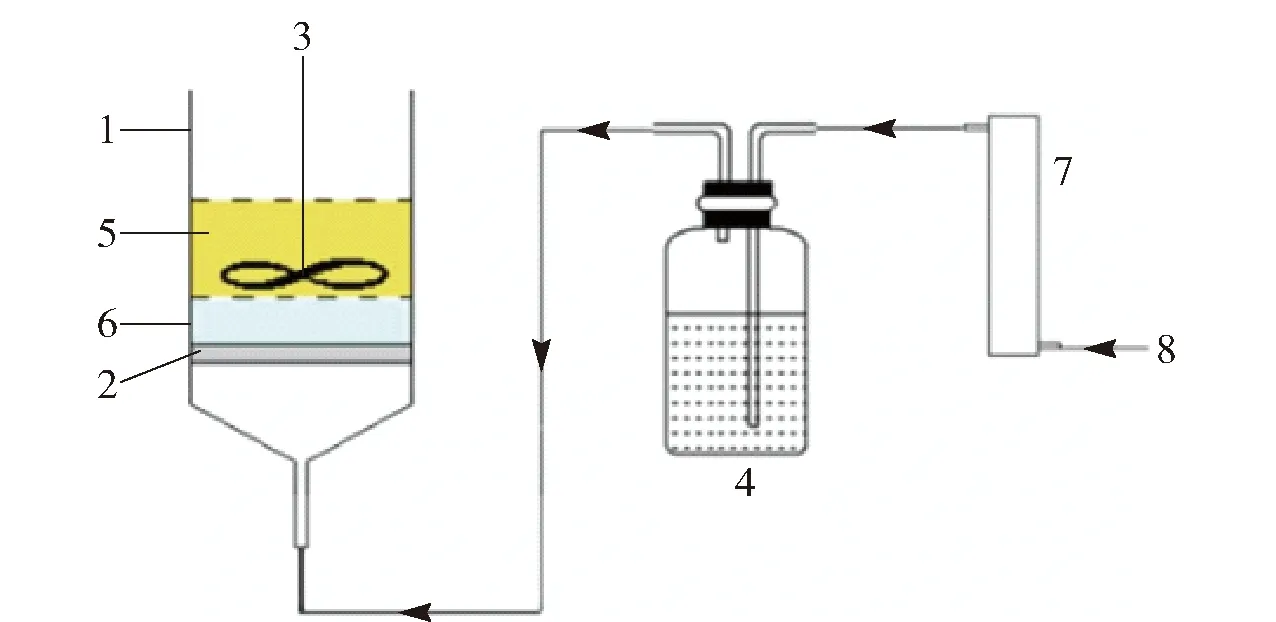
1-反应器; 2-1 μm砂芯; 3-搅拌器; 4-洗气瓶; 5-有机层; 6-溶液层; 7-转子流量计; 8-CO2图1 反应示意图
LiCl溶液CO2沉淀法直接利用LiCl与气体CO2反应,减少杂质的引入,但该方法仅在实验室中实现生产,工艺条件尚未成熟,而且对LiCl溶液纯度要求高。
2 粗碳酸锂提纯方法
粗碳酸锂提纯法是对工业级碳酸锂进行除杂操作,提高碳酸锂的纯度,达到高纯碳酸锂标准。粗碳酸锂提纯法主要有Zinfl-Hard-er-Dauth法、重结晶法、苛化碳化法、电解法、氢化沉淀法、氢化分解法和氢化-离子交换法。
2.1 Zinfl- Harder- Dauth法
Zinfl-Harder-Dauth法[13]是将粗碳酸锂溶于醋酸中,然后用(NH4)2C2O4沉淀Ca2+,用Ba(OH)2沉淀Mg2+,加入H2SO4除去Ba2+。 将混合液过滤、蒸干,灼热除去铵盐,将得到的固体溶于HCl,加入精制(NH4)2CO3即可得到提纯后的碳酸锂,反应机理见式(4)~(6)。
Li2CO3+2CHCOOH→2CH3COOLi+H2O+CO2↑
(4)
CH3COOLi+HCl→LiCl+CHCOOH
(5)
2LiCl+(NH4)HCO3→Li2CO3↓+2(NH4)HCl
(6)
Zinfl-Harder-Dauth法是一种传统提纯碳酸锂的方法,虽然引入试剂较多,但得到的碳酸锂纯度还是难以达到要求,目前其中的除杂工艺仍广泛应用于碳酸锂的生产。
2.2 重结晶法
重结晶法是利用溶解度的差异除去杂质,达到提纯的目的。重结晶法分为两种:碳酸锂重结晶法和甲酸锂重结晶法。
碳酸锂重结晶法是利用碳酸锂溶解度随温度升高而减小,而一般杂质的溶解度随温度升高而增大的差异,通过高温溶解粗碳酸锂,然后冷却析出,达到提纯的目的。 碳酸锂重结晶法操作简便,除杂效果好,但由于碳酸锂的溶解度太小,实际操作周期太长。
甲酸锂重结晶法是利用HCOOLi的溶解度随温度变化大,而一般杂质的溶解度随温度变化小的差异,先将粗Li2CO3与HCOOH反应得到HCOOLi,再高温溶解HCOOLi,然后控制一定的温度析出HCOOLi,而杂质仍存在于溶液中,最后在HCOOLi氨碱性溶液中,通入CO2制得Li2CO3,反应机理见式(7)、式(8)。
2HCOOH+Li2CO3→2HCOOLi+CO2↑+H2O
(7)
2HCOOLi+CO2→Li2CO3↓+H2O
(8)
甲酸锂重结晶法能很好地除去杂质,但在除杂过程中,由于共沉淀现象,溶液中的硅难以除尽。
2.3 苛化碳化法
苛化碳化法是用精制的石灰乳将粗碳酸锂苛化,形成LiOH溶液,而Ca2+、Mg2+则分别以 CaCO3和Mg(OH)2形式沉淀,过滤降温后,溶液会析出少量的LiOH·H2O,再向剩余溶液中通入一定量的CO2沉淀Ca2+,过滤除杂后,将滤液进行碳化即可得到高纯Li2CO3,其中母液可循环到苛化步骤中,反应机理见式(9)~式(11)。
Ca(OH)2+Li2CO3→CaCO3+2LiOH
(9)
Mg2++2OH-→Mg(OH)2↓
(10)
2LiOH +CO2→Li2CO3↓+H2O
(11)
苛化碳化法可以有效除去钙镁杂质,母液循环使用可减少Li的损失,但该方法对石灰乳的要求高,温度等参数控制比较严格。袁小华[14]对工艺参数进行了研究,指出降低苛化温度有利于苛化过程,苛化时间30 min为宜,苛化液浓度一般控制在18~20 g/L。
2.4 电解法
电解法原本是用于卤水生产LiOH的方法,对于粗Li2CO3提纯也可使用[8]。 电解法主要分为隔膜法电解LiCl和隔膜法电解LiHCO3。
隔膜法电解LiCl是将粗Li2CO3溶于HCl溶液中,经沉降和离子交换树脂处理,除去大部分的Ca2+、Mg2+等阳离子杂质,处理后的溶液作为电解槽的阳极液,选取LiOH溶液作为阴极液,两者之间用离子选择渗透膜隔开。
电解过程中,Li+离子向阴极移动,OH-离子向阳极移动,离子选择渗透膜只允许Li+通过,OH-无法进入到阳极中,电解一段时间后,可在阴极区得到高纯度的LiOH溶液。反应机理见式(12)、式(13)。
阴极:4H2O+4e-→4OH-+2H2↑
(12)
阳极:2H2O→4H++O2↑+4e-
(13)
隔膜法电解LiHCO3是将粗Li2CO3氢化处理后得到的LiHCO3溶液作为阳极液,LiOH溶液作为阴极液,两者之间用离子选择渗透膜隔开。
电解过程与之前隔膜法电解LiCl相似,离子选择渗透膜只允许Li+离子通过,HCO3-等阴离子无法通过,电解一段时间即可在阴极区得到高纯度的LiOH溶液,反应机理见式(14)、式(15)。
阴极:4H2O+4e-→4OH-+2H2↑
(14)
阳极:4HCO3-→O2↑+4CO2↑+H2O+4e-
(15)
电解法电解过程可以很完全地进行,在阴极区可以得到高纯度的LiOH溶液,Ca2+、Mg2+等难以除去的离子也可以降到很低的范围。 最终LiOH溶液经CO2碳化后即可得到高纯碳酸锂。 电解法流程短,而且能将Ca2+、Mg2+等离子降到很低的范围,制得的Li2CO3纯度很高,但是对膜的要求高,电解能耗较大,难以进行工业化生产。
2.5 氢化沉淀法
氢化沉淀法是将粗Li2CO3与去离子水配成浆料,在搅拌条件下通入CO2气体,将溶解度低的Li2CO3转化为溶解度高的LiHCO3,经过滤将不溶的杂质除去,然后将滤液置于另一容器中与LiOH溶液反应生成高纯Li2CO3,反应机理见式(16)、式(17)。
Li2CO3+CO2+H2O→2LiHCO3
(16)
LiHCO3+LiOH→Li2CO3↓+H2O
(17)
氢化沉淀法制得的Li2CO3纯度很高,易于控制产品的纯度和粒度[13],但需要高纯LiOH,生产成本较高,而且要强化反应配比,反应条件要求高。
2.6 氢化分解法
氢化分解法是将粗碳酸锂与去离子水配成浆料,在搅拌条件下通入CO2气体,将微溶的Li2CO3转化为可溶的LiHCO3,通过过滤除去不被氢化的杂质,再将纯净的滤液置于另一容器中搅拌、加热,LiHCO3逐渐转化为沉淀Li2CO3,过滤可得到提纯的Li2CO3,其中母液可以循环使用[15]。 反应机理见式(18)、式(19)。
Li2CO3+CO2+H2O→2LiHCO3
(18)
2LiHCO3→Li2CO3↓+CO2↑+H2O
(19)
赵泉锋等[16]对氢化时间、液固比和CO2流速进行了实验研究,得到单因素实验的最佳氢化工艺条件:氢化温度25 ℃、氢化时间30 min、液固比1∶30以及CO2流速4 L/min;李燕茹等[17]在氢化过程中加入NaOH溶液除去Mg2+,并对CO2气体流速、氢化时间、氢化温度、固液比以及LiHCO3的蒸发温度、转速和水蒸发率进行实验研究,得到最佳工艺条件:氢化温度20 ℃、氢化时间150 min、CO2气体流速1 L/min、固液比1∶20、LiHCO3分解温度90 ℃、搅拌转速500 r/min以及水蒸发率<80%。 氢化分解法可以除去大部分杂质,而且有很高的操作性,但得到的Li2CO3仍很难达到高纯度的要求,于是很多人在此基础上增加了离子交换法,进一步除去钙镁硼等杂质[18-22]。
2.7 氢化- 离子交换法
氢化-离子交换法是在氢化分解法的基础上使用螯合树脂等将LiHCO3溶液中的钙镁硼等离子除去,过滤后得到提纯的LiHCO3溶液,经加热、过滤、干燥得到高纯Li2CO3,反应机理见式(20)~(23)。
Li2CO3+CO2+H2O→2LiHCO3
(20)
Ca2++2LiR→CaR2+2Li+
(21)
Mg2++2LiR→MgR2+2Li+
(22)
2LiHCO3→Li2CO3↓+CO2↑+H2O
(23)
Yi等[18]利用处理过的螯合树脂ArliteIRC747除去LiHCO3中的钙和镁,经处理后,溶液中的钙和镁分别从36 mg/L、32 mg/L降到0.15 mg/L、0.18 mg/L,树脂经HCl与LiOH处理后可循环使用,但螯合性能下降10%;Wu等[19]利用D412树脂除去Ca2+和Mg2+,并研究了母液循环使用,以及LiHCO3流速对产品质量的影响,提出最适宜条件:母液循环使用4次、LiHCO3流速10 mL/min;Xu等[20]将EDTA与LiOH溶液在60 ℃下合成EDTA-Li,并以此来络合并除去LiHCO3溶液中的Ca2+、Mg2+和Fe3+,提出了卤水生产高纯碳酸锂工艺:先通过沉淀法将卤水中大部分的Fe3+、Mg2+和Ca2+除去,加入Na2CO3得到粗Li2CO3,然后在液固比为30∶1下制成Li2CO3浆液,以摩尔比1.05∶1加入EDTA-Li,用热水清洗沉淀得到提纯后的碳酸锂,纯度可达到99.6%;周启立等[21]对氢化温度、氢化时间、氢化压力等工艺参数进行实验研究分析,并对比了四种树脂(D110、D113、D152和D418)的除杂效果,得到最佳工艺参数:碳化压力6×105~6.5×105Pa,碳化时间2~3 h,碳化温度为30~40 ℃,树脂牌号D110,母液流出速度120~140 g/h,分解搅拌速度30r/s以上。 氢化-离子交换法具有操作性强、回收率高、产品纯度高的优点,制得的Li2CO3粒径大,可用于钽酸锂(TL)、铌酸锂(NL)等声学、光学单晶的材料的制备[22],是目前高纯碳酸锂制备的研究热点。需要注意的是在使用树脂之前,需要尽量除去Fe3+离子,因为树脂主要捕捉Ca2+、Mg2+等+2价离子,当树脂捕捉到Fe3+后,常规方法很难将Fe3+从树脂中除去,进而影响树脂的使用寿命[23]。
综上所述,LiOH溶液NH4HCO3沉淀法可以直接制备高纯碳酸锂,但对反应物的纯度要求高,并需要氨气的回收设备。LiOH溶液CO2沉淀法是最直接,应用最广泛的方法,但对LiOH纯度要求高,需要提纯LiOH。LiCl溶液CO2沉淀法用CO2取代了Na2CO3,减少了杂质的引入,但该法对LiCl纯度要求高,工艺条件尚未成熟。Zinfl-Harder-Dauth法引入试剂过多,产品纯度难以达到要求,但对碳酸锂除杂有指导意义。重结晶法操作简便,除杂效果好,但实际操作周期长。苛化碳化法能除去钙、镁杂质,但对石灰乳的要求高,过程参数控制严格。电解法流程短,除杂效果好,但电耗高,对膜的要求高。氢化沉淀法易于控制产品的纯度和粒度,但需要高纯LiOH,成本高。氢化分解法可除去大部分杂质,易于操作,但纯度仍达不到高纯要求。氢化-离子交换法操作性强、回收率高、产品纯度高,是高纯碳酸锂制备的研究热点。
3 高纯碳酸锂制备技术展望
高纯碳酸锂的制备技术还存在诸多问题,需要进行完善发展。
1)高纯碳酸锂物性的控制。高纯碳酸锂制备的目的是应用,但应用所需要的不仅仅是纯度,还有物性。高纯碳酸锂因用途不同,会有不同的纯度、粒度、杂质含量指标。 比如应用于锂电池的碳酸锂有纯度要求(≥99.9%)和粒度要求(D0.5<6 μm)[23]。 因此在制备高纯碳酸锂过程中,除了提高纯度外,还应根据用途不同得到不同物性的产品。
2)高纯碳酸锂制备技术的改进。现有的高纯碳酸锂制备技术还有很多不完善的地方。 除了开发新方法外,还可以对现有的技术进行改进,比如氢化-离子交换法就是在氢化分解法的基础上进行了优化。产量更大、操作性更强、纯度更高、效率更高是高纯碳酸锂制备的发展方向。
3)制备超纯(5N)碳酸锂。对于高纯碳酸锂来说,超纯(5N)碳酸锂的制备不仅是高纯碳酸锂技术上的进步,也是对高品质铌酸锂和钽酸锂单晶制备的需要。新疆有色金属研究所已建成小规模生产线,但降低生产成本和形成产业规模等问题仍需解决。
高纯碳酸锂应用广泛,更是其他高纯锂盐的重要源头。随着技术的改进和研究的深入,高纯碳酸锂必会在新世纪能源方面发挥积极作用。
