姜黄素与猪脂肪氧合酶相互作用及对蛋白质结构的影响
2020-04-01,3,*
,3,*
(1.南京农业大学肉品加工与质量控制教育部重点实验室,江苏南京 210095;2.江苏省农业科学院农产品加工研究所,江苏南京 210014;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095)
肉制品在加工过程中容易发生脂质氧化,影响肉制品的风味。脂类物质的氧化分为自动氧化和酶促氧化[1],脂肪氧合酶(lipoxygenase,LOX)是酶促氧化最主要的内源酶[2]。LOX专一性作用于多不饱和脂肪酸(PUFA)的顺,顺-1,4-戊二烯基位置,通过分子内加氧,生成具有共轭双键的氢过氧化物[3]。生成的氢过氧化物极不稳定,可以进一步反应生成多种挥发性化合物,这些物质一方面形成食品的主要风味物质,例如新鲜水果蔬菜的风味物质醛类即由LOX氧化多不饱和脂肪酸途径生成,干腌肉制品的主要风味物质己醛也是脂质氧化降解生成[4-5];另一方面,食品中脂质的过度氧化会产生不愉悦气味物质[6],不仅导致食品风味劣变,还造成食物多不饱和脂肪酸含量下降,导致食物营养品质的下降和增加食品储藏的困难[7-10]。
姜黄素(Curcumin)是从一些姜黄科植物姜黄、莪术、郁金等植物的根茎中提取的[11-12],是一种脂溶性荧光分子,存在β-二酮结构的多酚化合物[13](结构式见图1)。研究发现,姜黄素有一些独特的药理作用,是一种天然的常用中药,具有降血脂、抗肿瘤、抗炎、抗氧化等作用[14-16]。同时姜黄素也是一种稳定的天然色素和天然防腐剂,有一定的营养价值[17]。作为食品添加剂,我国在1981年允许姜黄素用于食品行业,如果蔬饮料、糕点、罐头等。研究姜黄素与猪12-LOX的相互作用不仅对了解姜黄素在畜产品加工领域有重要理论价值,还能为姜黄素作为一种天然的食品添加剂在食品产业的发展提供可靠的理论基础和科学依据。
本研究通过紫外分光光度法、荧光光谱法、圆二色谱法,研究姜黄素与猪12-LOX之间的相互作用,包括姜黄素抑制住12-LOX的IC50,结合常数、结合位点数、结合作用力以及姜黄素对猪12-LOX结构变化的影响,探讨姜黄素与猪12-LOX的结合规律与作用机理,为姜黄素调控肉品品质提供理论依据。
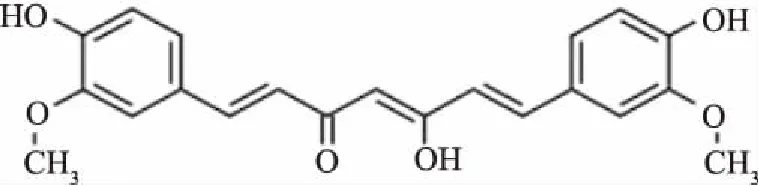
图1 姜黄素结构式Fig.1 Structure of curcumin
1 材料与方法
1.1 材料与仪器
猪12-LOX 前期实验室制备(以亚油酸为底物的比酶活为2826.7 U/mg,蛋白浓度为9.57 mg/mL);亚油酸、姜黄素、二甲基亚砜(DMSO) Sigma公司;吐温-20 南京中东化玻仪器有限公司;柠檬酸、柠檬酸三钠、磷酸氢二钾、磷酸二氢钾等 均为国产分析纯。
BioTekSynergy2多功能酶标仪 美国BioTek公司;M124A分析天平 意大利BEL公司;HH-1数显恒温水浴锅 常州国华电器有限公司;JASCO J-1500圆二色谱仪 日本岛津有限公司;LS-55 Fluorescence Spectrometer 美国PerkinElmer公司;OHAUSST20笔试pH计 上海翼彩检测仪器有限公司。
1.2 实验方法
1.2.1 主要试剂配制 亚油酸底物溶液配制:将0.5 mmol亚油酸溶于5 mL(含180 μL Tween 20)的脱氧重蒸水中,使其充分混匀;逐滴滴加1 mol/L NaOH充分混匀直至体系成为清澈透明的液体,再用1 mol/L HCl调pH至9.0,直至亚油酸完全溶解,最后用脱氧重蒸水定容至50 mL。准备数支4 mL EP管,并将该亚油酸储备液分装保存在EP管中,并于-20 ℃下保存备用[18]。
姜黄素溶液配制:用DMSO和吐温20以1∶1的体积比配置成100 μg/mL的姜黄素溶液,实验时稀释至所需浓度。
1.2.2 姜黄素对猪12-LOX活力的影响
1.2.2.1 猪12-LOX酶活测定 猪12-LOX的酶活测定方法在Kermasha等[19]的基础上进行改进。将20 μL亚油酸底物储备液与160 μL、50 mmol/L的柠檬酸缓冲液(pH5.5)充分混匀,加入20 μL猪12-LOX酶液,迅速混匀,在234 nm处测定其1.0 min内吸光度值的增加量。以不加酶液即20 μL亚油酸底物与180 μL柠檬酸缓冲液混合液为空白。LOX酶活为在一定的温度和pH条件下,反应体系在234 nm波长处吸光度每分钟增加0.001表示为1个酶活力单位(U)[20]。相对酶活:以酶活最高值为100%,计算不同条件下的相对酶活。
1.2.2.2 猪12-LOX酶活抑制率的测定 向酶活反应体系中加入姜黄素使其终浓度分别为0.1、0.5、1、2、4、8、10、20、30、40、50 μg/mL;以不加姜黄素的反应体系作为对照组;以不加酶液和姜黄素的作为空白对照;体系混匀后在234 nm处测定1 min内吸光值的变化,按以下公式计算抑制率(IR),并计算其IC50值。
式(1)
式中:A1为实验组吸光度的变化量;A2为对照组吸光度的变化量;A3为空白组吸光度的变化量。
1.2.3 姜黄素对猪12-LOX荧光光谱的影响
1.2.3.1 荧光光谱测定 向一定浓度的猪12-LOX蛋白溶液中加入不同量的姜黄素溶液,使最终蛋白浓度为20 mg/L,姜黄素的浓度分别为0、10、20、30、40、50、60 μg/mL,准备3组样品,分别于288、298、308 K的恒温水浴锅中水浴5 min后测定。常规内源性荧光光谱测定条件:激发波长为280 nm,发射光谱扫描范围为250~450 nm,激发及发射狭缝宽为5 nm,速率1200 nm/min;
1.2.3.2 同步荧光光谱 向一定浓度的猪12-LOX蛋白溶液中加入不同量的姜黄素溶液,使最终蛋白浓度为20 mg/L,姜黄素的浓度分别为0、10、20、30、40、50、60 μg/mL,室温条件下测定。同步荧光光谱测定条件如下:25 ℃,分别固定Δ λ=15 nm 和Δλ=60 nm,进行同步荧光光谱扫描,扫描范围250~350 nm,激发及发射狭缝宽为5 nm,速率1200 nm/min。
1.2.3.3 荧光猝灭机制的判定 小分子结合蛋白的荧光猝灭机制分为静态猝灭与动态猝灭,静态猝灭由于猝灭剂与荧光基团形成复合物,其猝灭常数随着温度的上升呈下降的趋势。动态猝灭表现为温度的升高增加离子的扩散和碰撞,其猝灭常数随着温度的上升而增大。利用 Stern-Volmer 方程对猝灭类型进行判断[21]:
F0/F=1+Ksv[Q]=1+Kqτ0[Q]
式(2)
式中:F0和F分别是不添加姜黄素与添加不同浓度姜黄素的荧光强度;[Q]是姜黄素的浓度(mol/L),Ksv是动态猝灭常数(L/mol);Kq是生物大分子猝灭速率常数(L/(mol·s)),τ0是不存在猝灭剂时荧光分子的寿命,平均寿命约为10-8s。
1.2.3.4 结合常数和结合位点数的计算 静态猝灭中,荧光猝灭强度和猝灭剂浓度之间遵循公式(3)[22],通过公式(3)计算荧光分子和猝灭剂的结合常数和结合位点数确定其相互作用的强度。
lg[(F0-F)/F]=lgKA+nlg[Q]
式(3)
其中:F0和F分别是不添加姜黄素与添加不同浓度姜黄素的荧光强度;[Q]是姜黄素的浓度(mol/L);KA是结合常数;n为结合位点。
1.2.3.5 热力学参数与相互作用类型 根据Van’t Hoff范特霍夫方程及其推导的公式计算热力学参数[23-24]。
ln(K2/K1)=-(1/T2-1/T1)ΔH/R,ΔG=-RTlnK,ΔG=ΔH-TΔS
式(4)
式中:ΔH、ΔG和ΔS分别表示焓变,自由能变化和熵变;R为气体常数 8.314 J ·mol-1·K-1,T是实验温度;K为相应温度下的结合常数。
1.2.4 圆二色谱(CD)分析 CD光谱能够有效分析蛋白质二级结构的变化,常用于蛋白质二级结构的测定[25]。以磷酸盐缓冲液(50 mmol/L,pH7.6)作为空白对照,实验组为不加姜黄素的LOX酶液和加入姜黄素的LOX酶液。CD光谱的扫描波长范围为200~250 nm,光源为氙灯,液池光径为1 mmol/L,在范围内扫描累加3次。扫描速度为50 nm/min,LOX 酶液浓度为 0. 1 mg·mL-1。用平均椭圆率[θ]来表示CD数据,单位为deg·cm2·dmol-1[26]。
1.3 数据处理
每组实验做3个平行,采用Excel进行数据分析与处理,Origin 8.0和SPSS进行数据处理与作图。
2 结果与分析
2.1 姜黄素对猪12-LOX活力的影响
不同浓度的姜黄素对猪12-LOX酶相对活力和抑制率的影响如图2所示。结果表明,随着姜黄素浓度的增加,猪12-LOX酶相对活力逐渐下降,在姜黄素浓度为4 μg/mL时,猪12-LOX活力下降45.9%,姜黄素浓度为50 μg/mL时,猪12-LOX活力下降至初始酶活的10.3%。根据公式(1)分别计算不同姜黄素浓度下的抑制率,结果如图2所示,当姜黄素浓度为4 μg/mL时,抑制率为54.06%,用SPSS软件分析求得IC50=2.156 μg/mL,姜黄素浓度为50 μg/mL时,抑制率达到90.12%,表明姜黄素对猪12-LOX的抑制作用明显。
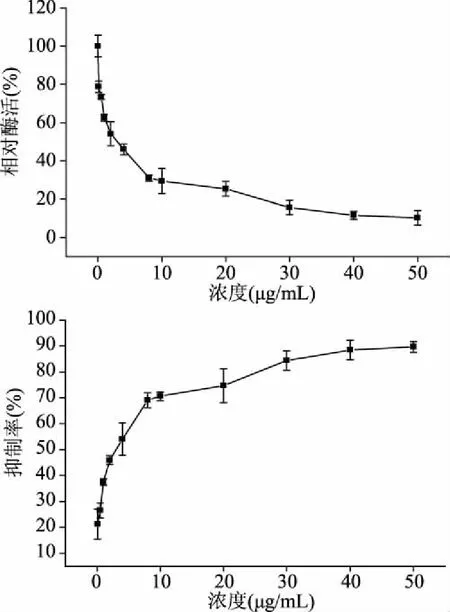
图2 不同姜黄素浓度对猪12-LOX酶活力和抑制率的影响Fig.2 Effects of different curcumin concentrations on the activity and inhibition rate of porcine 12-LOX
2.2 姜黄素对猪12-LOX荧光光谱的影响
2.2.1 荧光强度的影响 如图3所示,姜黄素的加入,使得猪12-LOX的荧光强度减弱,姜黄素浓度越高,荧光强度越低,说明姜黄素对LOX蛋白的荧光有猝灭作用,且猝灭效果随着姜黄素浓度的增加而增大。猪12-LOX的λmax发生了一定的红移,这说明姜黄素能够与猪12-LOX相互作用,使猪12-LOX中色氨酸所处的周围环境极性增加,使其向亲水性环境发生转变,从而使蛋白质的分子结构变得松散[27-28]。
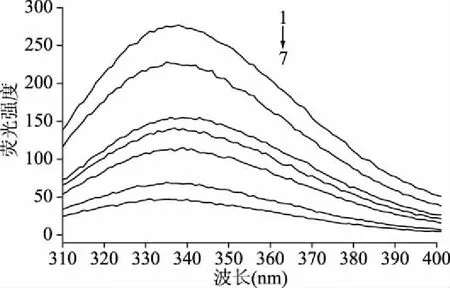
图3 姜黄素对猪12-LOX荧光光谱的影响Fig.3 Effects of curcumin on fluorescence spectrum of porcine 12-LOX注:1~7分别对应姜黄素浓度为0、10、20、30、40、50、60 μg/mL;图6同。
2.2.2 荧光猝灭机理研究
2.2.2.1 荧光猝灭机制的判定 根据Stern-Volmer 方程(2),以F0/F为纵坐标,姜黄素浓度[Q]为横坐标进行线性拟合,经Origin 8.0绘图得到(图4),进一步得出姜黄素与猪12-LOX相互作用的动态猝灭常数(Ksv)和生物大分子猝灭速率常数(Kq)(表1)。对于生物大分子,各类猝灭剂由扩散碰撞产生的最大动态猝灭常数为 2×1010L/(mol·s)[29-30]。由表1可知,在288、298、308K温度下,姜黄素与猪12-LOX相互作用的Kq值远大于 2×1010L/(mol·s),表明姜黄素对猪12-LOX的猝灭机理是姜黄素与蛋白结合形成基态稳定复合物所引起的静态猝灭。

表1 猪12-LOX与姜黄素复合物的荧光猝灭常数及线性相关系数Table 1 Stern-Volmer quenching constants(KSV)and molecular quenching constants(Kq)for porcine 12-LOX and curcumin systems

表2 姜黄素与猪12-LOX复合物的结合位点数、表观结合常数及线性相关系数Table 2 Apparent binding constants,binding sites and linear correlation coefficients of curcumin and porcine 12-LOX systems

表3 姜黄素与猪12-LOX结合的相关热力学参数Table 3 Thermodynamic parameters of curcumin and porcine 12-LOX systems
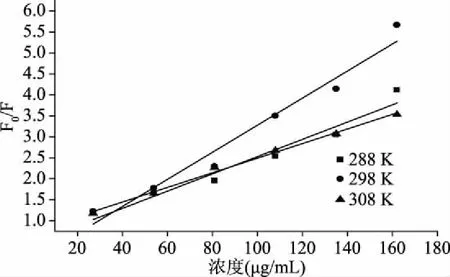
图4 不同温度条件下姜黄素猝灭猪12-LOX的Stern-Volmer图Fig.4 Stern-Volmer plot of F0/F as a function of curcumin concentration at different temperatures for curcumin and porcine 12-LOX systems
2.2.2.2 结合常数和结合位点的计算 根据公式(3),以lg[(F0-F)/F]对lg[Q]作图(图5),计算出不同温度条件下姜黄素与猪12-LOX相互作用的表观结合常数(KA)和结合位点数(n)(表2)。如表2所示,随着温度的升高,结合常数KA值降低,说明姜黄素与猪12-LOX的反应是一个放热过程;结合常数较大,说明两者有较强结合作用;二者的结合位点数在各个温度下也都约为1,说明姜黄素与猪12-LOX蛋白之间形成了摩尔比约1∶1的静态复合物[31]。

图5 不同温度条件下姜黄素猝灭猪12-LOX的双对数图Fig.5 Plot of lg[(F0-F)/F]as a function of log of curcumin concentration at different temperatures for curcumin and porcine 12-LOX systems
2.2.2.3 小分子和蛋白结合的相互作用力主要有四种:ΔH>0、ΔS>0 时,疏水相互作用;ΔH>0、ΔS<0 时,静电和疏水相互作用;ΔH<0、ΔS<0 时,范德华力和氢键相互作用;ΔH<0、ΔS>0 时,静电相互作用[23]。由表3得出ΔH<0、ΔS<0,表明姜黄素与猪12-LOX的主要作用力为范德华力和氢键,ΔH<0表明姜黄素与猪12-LOX之间的反应是放热的,与2.2.2.2结论一致。ΔG<0,表明两者之间的反应是自发的。
2.2.3 同步荧光光谱 同步荧光分析被应用于研究蛋白质的构象,特别是荧光基团微环境的变化,具有选择性高、谱图简化、光散射干扰少等特点[32]。通过设定激发波长与发射波长之间的固定波长差(Δλ),来获得荧光光谱。当 Δ λ=15 nm 时,只显示酪氨酸残基的特征荧光光谱;当 Δ λ=60 nm 时,只显示色氨酸残基的特征荧光光谱[33]。通过氨基酸残基最大吸收波长的变化,判断氨基酸所处微环境的变化,若最大发射波长红移,表明微环境的亲水性增加,蓝移则表明疏水性增加。

图6 姜黄素与猪12-LOX体系的同步荧光光谱Fig.6 Synchronous fluorescence spectra of curcumin and porcine 12-LOX systems注:A:Δλ=15 nm;B:Δλ=60 nm。
由图6可知,随着姜黄素浓度的增加,猪12-LOX的两个不同波长差的同步荧光光谱均明显降低,表明猪12-LOX分子中的酪氨酸和色氨酸残基均由于姜黄素的加入而被不同程度的猝灭,但相比之下,色氨酸被猝灭的程度大于酪氨酸,由此可判断姜黄素主要结合在猪12-LOX的色氨酸残基上;另外,Δλ=60 nm的谱图表现出明显的红移现象,而Δλ=15 nm谱图的出峰位置几乎没有变化,这说明姜黄素与猪12-LOX的结合位点更接近于色氨酸残基[34]。因此,当猪12-LOX与姜黄素结合后,主要作用于猪12-LOX的色氨酸附近,使色氨酸周围微环境的亲水性增强,极性增加[34-36],进而使猪12-LOX的分子结构变得松散,与2.2.1得出的结果相对应。
2.3 圆二色谱
蛋白质二级结构中主要的光活性基团是肽键,其吸收峰分布在蛋白质圆二色谱(Circular dichrosim spectra,CD)的远紫外区段(190~240 nm),一般来说α-螺旋特征吸收峰在208和222 nm左右,β-折叠在215 nm左右有一特征吸收负峰[37-38]。如图7所示,天然状态的LOX的远紫外圆二色谱在208和222 nm处显示负双峰曲线,在215 nm处显示一个负肩峰。在加入姜黄素后,12-LOX在208、222和215 nm处的特征吸收峰强度下降,表明姜黄素的加入使猪12-LOX内的二级结构α-螺旋和β-折叠的含量降低。

图7 姜黄素猝灭猪12-LOX相互作用的圆二色谱图Fig.7 CD spectra of the curcumin and porcine 12-LOX systems
3 结论
本文采用分光光度计,荧光光谱,同步荧光光谱,圆二色谱等方法研究了姜黄素与猪12-LOX的相互作用及对蛋白质结构的影响,结果表明姜黄素对猪12-LOX酶活力起抑制作用,且随姜黄素浓度的增加,抑制作用增强,对实验结果进行线性拟合,计算出了IC50值为2.156 μg/mL。
荧光图谱结果表明姜黄素对猪12-LOX有荧光猝灭作用,猝灭机制属于静态猝灭,两者之间主要通过范德华力和氢键结合。
姜黄素与猪12-LOX的结合位点数n接近1,形成了摩尔比约1∶1的静态复合物。同步荧光光谱表明姜黄素与猪12-LOX的结合位点更接近色氨酸残基。
圆二色谱表明,姜黄素的加入降低了猪12-LOX蛋白质二级结构中α-螺旋和β-折叠的含量。
