颅内静脉窦血栓形成动物模型研究现状及发展方向
2020-04-01肖立坡赵婷玉段建钢吉训明
肖立坡 赵婷玉 段建钢 吉训明
颅内静脉窦血栓形成(CVST)是青年缺血性卒中的重要原因,尤其好发于妊娠期女性,占全部脑卒中的0.5%~3.0%[1⁃2]。一项来自澳大利亚的流行病学调查结果显示,颅内静脉窦血栓形成的年发病率为13.0 ~15.7/100 万,以30 ~40 岁育龄期女性较为常见,男女比例约为1 ∶3.5,好发部位依次为多静脉窦(57.14%,60/105)、上矢状窦(16.19%,17/105)、横窦(11.43%,12/105)和乙状窦(8.57%,9/105)[3]。其危险因素主要包括妊娠期和产褥期女性[4]、口服避孕药、感染、遗传性易栓症、高凝状态、血液系统疾病和系统性疾病等[5⁃10];临床表现复杂多样[11],以头痛最为常见[12],可伴有视觉障碍、脑卒中样发作、癫发作和昏迷等,上述症状均无特异性[13⁃14]。明确诊断主要依靠头部MRI,特别是磁共振黑血血栓成像(MRBTI)有助于临床分期[15⁃16],治疗方法以抗凝药为主,静脉窦内机械碎栓适用于严重的颅内静脉窦血栓形成患者[17⁃18]。但是,关于再通治疗效果的评价,目前尚未达成共识,部分学者认为成功的血管再通可使患者获得良好预后[19],而也有学者认为,血管完全再通和部分再通与临床结局无明显关联性[20]。在Gunes 等[21]开展的回顾 性队列研究 中,对75 例颅内静脉窦血栓形成患者入院时和出院时的改良Rankin 量表(mRS)评分结果进行分析,与入院时相比,经抗凝治疗后患者神经功能明显改善,且这种改善与性别无关联性,表明颅内静脉窦血栓形成患者只要及时治疗可获得较好预后。尽管颅内静脉窦血栓形成病死率随诊疗技术的发展逐渐降低,但迄今病情严重者病死率仍高达34.2%[14]。颅内静脉窦血栓形成的病理生理学机制至今尚未获得明确的动物实验证据[11,22],因此,制备与人类发病条件相似的动物模型,对探讨其发病机制、病理生理学过程和制定治疗策略具有重要价值[23],良好的动物模型可以模拟人类颅内静脉窦血栓形成过程,通过对动物模型的研究,可以对疾病的病因和病理生理学过程进行更为深入的研究和探讨,从而有利于研发新的治疗靶点,促进疾病获得良好转归。然而,现有的大部分动物模型并不能很好地模拟人类颅内静脉窦血栓形成的病理生理学过程,且均为短期实验。鉴于此,笔者拟对国内外具有代表性的颅内静脉窦血栓形成动物模型制作方法进行总结并分析其优缺点[24],希望在此基础上探讨一种新型动物模型制备方法,可以较好地模拟人类颅内静脉窦血栓形成的发病机制和病理生理学过程。
一、颅内静脉窦血栓形成动物模型的制作方法及优缺点
1946 年,Beck 和Russell[25]首 次 尝 试 制 备 静 脉窦和皮质静脉血栓动物模型,采用夹子或丝线堵塞犬、猫、兔的上矢状窦(SSS)并注射凝血酶或油酸乙胺醇,但经多次实验均未达到预期效果,表明单纯结扎上矢状窦并不能导致静脉窦血栓,考虑是由于上矢状窦侧支循环丰富所致。目前的颅内静脉窦血栓形成动物模型有永久性结扎型、临时阻断型、化学诱导型、介入型或插管型、植入自制移植物型、双极电凝型,各种动物模型的优缺点参见表1。
1. 永 久 性 结 扎 型 动 物 模 型 Deckert 等[26]于1990 年以丝线结扎大鼠上矢状窦近窦汇部位,直接向隔离的窦腔内注射高岭土诱导血栓形成,14 只大鼠静脉窦血栓模型制备均获成功,其中8 只还同时诱导皮质静脉血栓形成。随后Frerichs 等[27]、Ungersböck 等[28]相继采用同样方法制备颅内静脉窦血栓形成模型并进行病理生理学研究。2014 年,Li等[29]对Deckert 等[26]的 方法进行改 进,在永久性结扎大鼠上矢状窦头部和尾部后,显微镜下将微导管自上矢状窦头部插入尾部并缝合,以防止向窦腔内注射凝血酶时外渗,1 分钟内注射完毕100 μl 凝血酶(50 U/ml),注射期间暂时阻断颈动脉血流以减少上矢状窦静脉回流,促进血栓形成,该模型不仅可以直接观察到静脉窦血栓和皮质静脉血栓形成过程,并且能够较好地模拟人类颅内静脉窦血栓形成的病理生理学过程,可靠性较高。永久性结扎型动物模型均是通过永久性结扎上矢状窦并同时注射促凝药致血栓形成,故其治疗相关研究受到限制。
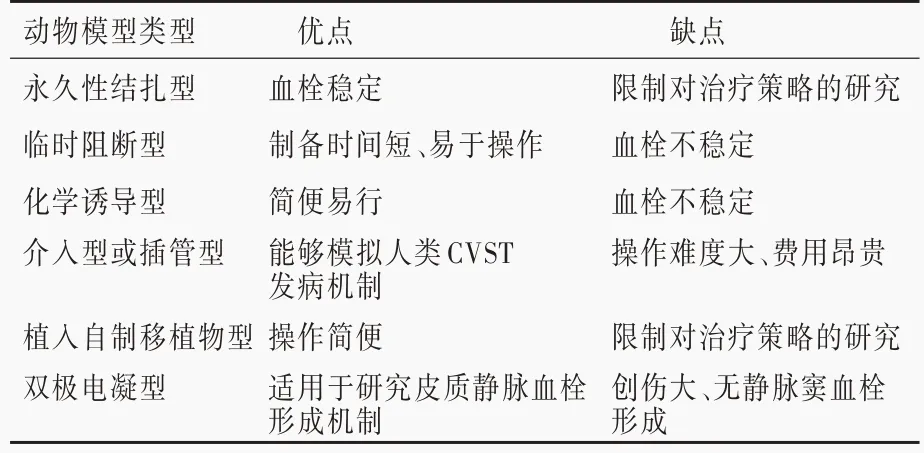
表1 各种颅内静脉窦血栓形成动物模型的优缺点Table 1. Advantages and disadvantages of the CVST animal models
2.临时阻断型动物模型 2009 年,汤恒心等[30]报告其临时阻断型动物模型的研究结果:充分显露新西兰兔上矢状窦,以小血管夹分别夹住上矢状窦的前1/3 和后1/3,采用27 号显微注射器穿刺上矢状窦前2/3 并向窦腔内缓慢注射脑磷脂白陶土悬液100 μl,5 小时后血栓形成,松开血管夹,经颅多普勒超声(TCD)检测上矢状窦血流速度为零,证实血栓形成,模型制备成功。该模型的优点是,手术时间较短,术中解剖、结扎和注射部位固定,可重复性良好,且松开血管夹后血栓有一定程度的自溶、脱落,较为真实地模拟人类颅内静脉窦血栓形成的病理生理学过程;其缺点是,血管夹易造成静脉窦及其邻近脑组织损伤,且所形成的血栓不稳定。由于此种模型很少用于颅内静脉窦血栓的相关研究,故很少使用。
3.化学诱导型动物模型 2005 年,Röttger 等[31]将含40%氯化铁溶液的滤纸条覆盖于大鼠上矢状窦表面硬膜4 分钟,通过氯化铁的氧化还原作用[32]损伤静脉窦内皮细胞,从而诱发血小板活化和聚集,在纤维蛋白的参与下形成血栓,模型制备1 天内血栓即自溶再通并于1 周内完全再通,模型制备成功,但上矢状窦血栓未进展至皮质静脉血栓,亦未出现颅内出血。2016 年,Tiwari 等[33]通过对Röttger等[31]模型的进一步观察发现,氧化应激反应、谷氨酸兴奋毒性作用与颅内静脉窦血栓形成时的细胞凋亡密切相关。化学诱导型动物模型不能诱导皮质静脉血栓,仅可用于制备单纯的静脉窦血栓模型,故不适用于人类皮质静脉血栓形成相关发病机制的研究;由于操作方法简便、再通率高,目前主要用于制定治疗策略、探讨病理生理学机制的研究,在国内外广泛应用,是一种经典的颅内静脉窦血栓形 成 动 物 模型。2015 年,Chen 等[34]采 用 激 光 器分别照射大鼠上矢状窦头部和尾部10 分钟,同时经尾静脉注射玫瑰红染料,直至血栓形成,将微型注射器自上矢状窦头部插入尾部并于窦腔内缓慢注射凝血酶(100 μl)10 分钟,手术显微镜下可观察到上矢状窦血栓、桥静脉和皮质静脉血栓形成,进一步采用荧光血管造影术观察,证实皮质静脉血栓。Chen 等[34]制备的化学诱导型颅内静脉窦血栓形成模型,既可以诱导皮质静脉和桥静脉血栓以及颅内点状出血,又可用于评价治疗方法,如抗凝治疗、局部静脉溶栓治疗等;但操作过程复杂、可重复性差,并且光照射易造成上矢状窦邻近脑组织损害。2018 年,魏莹等[35]在Röttger 等[31]模型的基础上,采用40%氯化铁溶液棉片覆盖于新西兰兔上矢状窦表面硬脑膜5 分钟,然后取下贴片,于窦腔内注射凝血酶100 μl 制备静脉窦血栓模型,该模型可以观察静脉窦血栓形成的病理生理学过程、评价静脉溶栓治疗效果;但是氯化铁在诱导血栓形成的过程中易对周围脑组织产生不良刺激或损伤,且该模型观察期较短,能否用于慢性颅内静脉窦血栓形成的研究尚待进一步证实。
4. 介入型或插管型动物模型 2007 年,Wang等[36]将一端连有注射器的导管置入大鼠窦汇前、上矢状窦后以阻断上矢状窦静脉回流,再向窦腔内缓慢注射部分凝血活酶试剂0.15 ~0.20 ml 制备颅内静脉窦血栓形成大鼠模型,于手术显微镜下观察到血栓形成即可拔除导管。该模型的优点为:(1)微导管可使上矢状窦血流速度明显减慢甚至停滞、血液淤滞,通过血流动力学改变形成血栓。(2)上矢状窦窦腔内注射的活化部分凝血活酶试剂可以使纤维蛋白原转变为纤维蛋白,继而形成交联纤维蛋白、形成血栓;但该模型无法诱发皮质静脉梗死、颅内出血等病理 生理学过程。2010 年,Wang 等[37]采用球囊阻塞猪上矢状窦的中1/3,经微导管向游离部分注射凝血酶100 μl,待形成静脉窦血栓后拔除导管和球囊。该模型的优点是,通过血管内介入方法较好地模拟血流速度减慢和高凝状态这两项血栓形成主要因素,同时球囊回撤易造成静脉窦内皮细胞损害,也有利于形成血栓,因此,该模型是最为接近临床颅内静脉窦血栓形成病理生理学过程的动物模型;其缺点是,对科研工作者的知识储备和技术能力要求较高,需熟练掌握猪的动脉和静脉系统解剖结构和微导管操作技术,耗材费用昂贵。
5.植入自制移植物型动物模型 2012 年,Yang等[38]报告一种植入自制移植物大鼠模型,即在充分显露大鼠上矢状窦的情况下,将自制塑料移植片缓慢插入上矢状窦后部,术中避免穿透、撕裂上矢状窦,移植片后部留置于上矢状窦外并固定,10 分钟后无血液流动,以骨水泥封闭骨窗,缝合切口。该模型的优点是,可操作性和可行性良好,手术成功率高,手术时间短、创伤小;其缺点是,移植片不能较好地模拟病理状态下血栓形成的病理生理学过程,无法为探讨治疗方法搭建所需要的研究平台。2019 年,Wang 等[39]采用自制 的线栓装置 插入大鼠上矢状窦制备上矢状窦阻塞模型,分为假手术组、阻塞组和再通组,再通组大鼠于阻塞上矢状窦静脉回流后6 小时取出线栓装置,证实早期解除阻塞物有利于改善循环、减轻脑水肿,以及促进脑水肿消退。该模型的优点是,能够对缺血部位和缺血持续时间进行标准化,并且较易实现再通;其缺点是,该模型诱导的是上矢状窦闭塞模型,不能诱导窦腔内血栓、皮质静脉血栓以及出血等病理过程,因此不适用于静脉窦血栓形成、血栓演变等病理学过程的研究。
6.双极电凝型动物模型 1995 年,Sakaki 等[40]首次报告双极电凝型动物模型制备方法:将猫俯卧位头部向右旋转45°固定于立体定位架,切除右侧颞肌和右侧颅骨,显露右侧大脑半球和上矢状窦,然后进行分组;A 组(5 只)采用低功率双极电凝器电凝上矢状窦邻近所有桥静脉,12 小时后缝合手术切口;B 组(5 只)将一直径为1 cm、质量45 g 的圆形金属片置于外侧裂中心12 小时,取下金属片、缝合切口;C 组(10 只)既电凝上矢状窦邻近所有桥静脉,又将圆形金属片置于外侧裂中心12 小时,缝合切口。术后发生轻度脑水肿者,A 组3 只、B 组4 只,中度脑水肿者,A 组2 只、B 组1 只、C 组6 只,3 组中仅C 组有4 只猫出现重度脑水肿;结果表明,电凝桥静脉同时放置金属片对皮质静脉内皮细胞的损害最为严重,而皮质静脉内皮细胞损害则可诱发广泛性静脉性 脑 梗 死。 2006 年,Cokluk 等[41]在J Neurosci Methods 报告了其所在团队关于双极电凝型动物模型的制备方法,与Sakaki 等[40]略有不同:大鼠俯卧位头部稍向左旋转固定,行头顶部中线开口,显露颞肌、人字缝和冠状缝,分离显露硬脑膜和后吻合静脉,于冠状缝前、矢状缝右侧永久性电凝前吻合静脉,于颧弓后端永久性电凝后吻合静脉,从而成功诱发皮质静脉血栓形成。上述两种模型的优点是,制备了静脉阻塞致皮质静脉血栓模型,有利于对脑静脉血栓形成的病理生理学机制和治疗策略进行更深入、更细致的研究;其缺点是,手术创伤大,仅诱发皮质静脉血栓形成,不能诱发静脉窦血栓。同年,刘梅丽等[42]采用显微双极电凝仪阻断大鼠上矢状窦中1/3,1 小时内激光多普勒血流监测仪可观察到脑血流量下降至静脉窦闭塞前的50%即为模型制备成功。但该模型仅为上矢状窦闭塞模型,未能诱发静脉窦和皮质静脉血栓形成。
上述颅内静脉窦血栓形成动物模型各有优缺点,其共同的不足之处在于:(1)大多为短期观察(观察周期不超过1 周),无法长时间观察颅内静脉窦血栓形成的病理生理学过程。这是由于实验设计和观察时间较短,形成的血栓不稳定,短期内即发生血栓自溶再通。(2)上述模型诱导形成的血栓与人类颅内产生的病理性血栓存在差异,病理状态的血栓应既有血液淤滞又有血液高凝状态,而动物模型无法复制这些病理状态。(3)某些模型操作难度高、拟合度低,故制备成功率低,无法完全模拟多因素导致的颅内静脉循环障碍[43]。(4)永久性静脉窦闭塞模型无法为治疗相关研究提供所需要的研究平台。其中,Li 等[29]制备的永久性结扎型动物模型更符合人类病理性血栓的形成过程,且血栓可以延伸至皮质静脉,进而引起皮质点状出血,与人类颅内静脉窦血栓形成的病理生理学过程相似,但是操作过程过于复杂且完全结扎上矢状窦,使治疗相关研究受到限制。
二、建立理想颅内静脉窦血栓形成动物模型的要素
理想的颅内静脉窦血栓形成动物模型应具备以下三方面:第一,模型能够模拟人类颅内静脉窦血栓形成的病理生理学过程;第二,模型制备过程中能够观察到静脉窦血栓、皮质静脉血栓、颅内出血等病理生理学变化;第三,模型能够为研发和测试新的治疗方法提供研究平台[1]。探索新的制备方法或整合现有方法的优点,以制备成功率高和拟合度高的动物模型是未来研究方向[43]。目前的动物模型不能模拟多个静脉窦血栓,仅能模拟上矢状窦血栓,尚无横窦或多静脉窦联合血栓模型,但是临床以多静脉窦联合血栓较为常见,如上矢状窦联合横窦血栓、上矢状窦联合横窦和乙状窦等多个静脉窦血栓,因此,未来需要研制能够模拟累及多个静脉窦的动物模型。此外,无论是结扎注射凝血酶、植入自制移植物、化学诱导、介入插管,还是双极电凝等均是雄性动物模型,尚无妊娠期、产褥期等特殊时期的雌性动物模型,这些特殊时期均为颅内静脉窦血栓形成的高发期,因此,研究这些特殊时期颅内静脉窦血栓形成的病理生理学机制和治疗策略的选择至关重要。目前尚无针对多种不同病因的颅内静脉窦血栓形成的动物模型,如感染性、免疫性等,未来也需要进一步探索和研究。
如果能够简化操作过程,将永久性结扎改为半结扎的手术方式,将会为治疗策略的研究提供平台。半结扎上矢状窦,可以模拟血流瘀滞状态,再联合窦腔内注射凝血酶,则可以模拟血液高凝状态,从而促使血栓形成。理论上讲,一旦血栓形成,即逐渐蔓延,由于半结扎可以阻止血栓脱落和自溶,使血栓逐渐扩大,可能延伸至桥静脉或皮质静脉,出现相应的静脉梗死、脑水肿、颅内出血等。这一方法的优点是:(1)能够模拟血流瘀滞状态和血液高凝状态,使血栓逐渐形成,更接近人类病理性血栓的形成过程,从而可用于长期实验观察。(2)操作技术相对简单,可降低手术耗材费用,缩短手术时间。(3)半结扎的手术方式能够为治疗策略的研究提供所需要的平台。
利益冲突无
