胚胎发育不良性神经上皮肿瘤MRI 分型与癫预后关系初探
2020-04-01尹宏伟王宇翔李卓群郭芷含李环廷栗世方丰育功李照建
尹宏伟 王宇翔 李卓群 郭芷含 李环廷 栗世方 丰育功 李照建
胚胎发育不良性神经上皮肿瘤(DNT)是一种较为少见的神经系统肿瘤,该病由Daumas⁃Duport 等[1]于1988 年首次提出并定义。2016 年WHO 中枢神经系统肿瘤分类第四版修订版将其归类为神经元和混合性神经元⁃神经胶质起源肿瘤,属WHOⅠ级良性肿瘤[2]。该病好发于儿童或青少年,男性多发,其最常见的起病形式是难治性癫发作[3]。早期手术治疗一般可获得良好预后[4⁃5]。目前关于该病的研究多集中于疾病的手术方式以及病理分型与癫预后的关系,但尚缺乏关于其影像学分型与癫 预后关系的研究。基于此,青岛大学附属医院收集14 例胚胎发育不良性神经上皮肿瘤患者的临床资料及长期的随访资料,进一步分析其MRI 分型与术后癫预后的关系,以增加对胚胎发育不良性神经上皮肿瘤的认识。
临床资料
一、病例选择
1.诊断标准 1999 年,Daumas⁃Duport 等[6]提出胚胎发育不良性神经上皮肿瘤诊断标准,即除术后病理组织发现“特异性胶质神经元成分”这一典型病理学特点外,还需符合以下条件:(1)临床表现为癫部分性发作,继发或不伴全面性强直⁃阵挛发作,发病年龄<20 岁。(2)无进行性神经功能缺损或先天缺陷。(3)头部MRI 显示大脑皮质清晰。(4)影像学检查无占位效应,伴局部皮质发育不良。
3.一般资料 收集2012 年1 月至2019 年7 月经青岛大学附属医院神经外科手术治疗并经术后病理证实为胚胎发育不良性神经上皮肿瘤患者14 例,其中男性10 例,女性4 例,男∶女比例为2.50 ∶1;发病年龄5 ~33 岁,平均15 岁;病程为17 天至10 年,平均765.86 天。本组14 例患者均以癫发作起病,根据最新国际抗癫联盟(ILAE)标准进行分类[7],其中全面性运动性发作9 例,失神发作2 例,局灶性运动性发作3 例。此外,癫合并头痛1 例,癫合并肢体麻木1 例(表1)。
二、影像学检查
本组14 例患者均进行MRI 平扫检查,主要包括T1WI、T2WI、FLAIR 和DWI 序 列,有10 例 患 者进 行MRI 增 强 检 查。采 用Chassoux 等[8]于2012 年 提 出的MRI 分型标准,Ⅰ型为囊性变,灰白质分界清楚,其中单发为Ⅰa 型,多发为Ⅰb 型;Ⅱ型主要表现为单发或多发结节样异常信号改变(T1WI 为等信号、低信号或高信号,T2WI/FLAIR 成像为高信号),灰白质分界清楚;Ⅲ型主要表现为异常增生样,灰白质界限模糊,Ⅲa 型为FLAIR 成像病灶范围与其他序列一致,Ⅲb 型为FLAIR 成像病灶范围>其他序列。
MRI 平扫分型Ⅰ型8 例,其中Ⅰa 型7 例,Ⅰb 型1 例(图1);Ⅱ型4 例(图2);Ⅲ型2 例(图3)。肿瘤位于额叶5 例,顶叶3 例,额顶叶2 例,颞叶3 例,额颞岛叶1 例。12 例患者DWI 序列肿瘤均表现为低信号。10 例增强扫描患者中有5 例呈强化征象,表现为多点状强化1 例,囊内分隔强化2 例,明显囊壁环形强化1 例,囊壁轻度强化1 例(表1)。
三、治疗与预后
1.术后病理结果 本组14 例患者均进行显微镜下肿瘤切除术,均达肿瘤全切除,术中除肿瘤切除外,均未行扩大切除或癫其他手术治疗。术后所有患者切除组织均行HE 染色,有13 例患者行免疫组化染色。(1)HE 染色:术后病理表现均可见典型特异性胶质神经元成分,即较大的神经元漂浮于多微囊样黏液基质中,并有少突胶质细胞样细胞散在分布其中。部分患者可见少突胶质细胞样细胞核周空晕和病变内毛细血管,可出现少突胶质细胞样细胞围绕血管周围形成“玫瑰花”样改变。肿瘤细胞在实性密集区可呈“蜂窝”状排列,在疏松区呈“条带”样排列(图4)。(2)免疫组化染色:13 例突触素(Syn)、少突胶质细胞转录因子2(Olig⁃2)和神经元核抗原(NeuN)阳性,6 例X 连锁α地中海贫血伴精神发育迟滞综合征蛋白(ATRX)阳性,11 例胶质纤维酸性蛋白(GFAP)阳性,5 例S⁃100 蛋白(S⁃100)阳性,2 例波形蛋白(Vim)阳性,2 例P53 阳性,1 例异柠檬酸脱氢酶1(IDH1)部分阳性。本组患者住院时间9 ~19 天,平均11.71 天;随访6 ~84 个月,平均为35.21 个月。患者头痛、肢体麻木等伴随症状在术后均消失,1 例(例5)术后出现不完全失语,1 例(例13)随访期间肿瘤复发,无死亡病例。
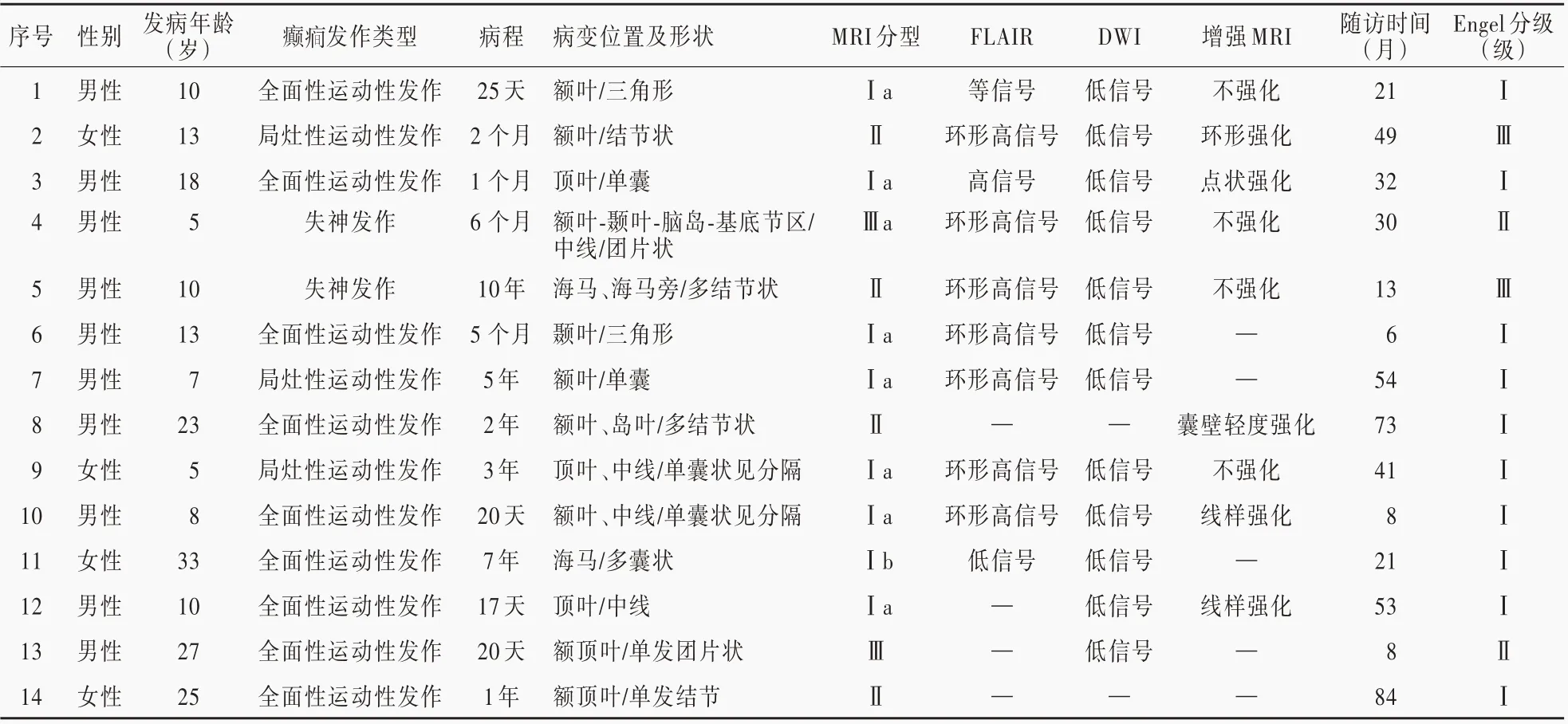
表1 14 例胚胎发育不良性神经上皮肿瘤患者的临床资料Table 1. The clinical data of 14 patients with DNT
讨 论
胚胎发育不良性神经上皮肿瘤好发于男性,发病年龄高峰在10 ~14 岁,其最常见发病位置为颞叶皮质[3,8],也可见少数位于枕叶、小脑或者皮质下结构[10⁃12]。本组患 者发病年 龄5 ~33 岁,平均15 岁,最常见部位为额顶叶,有4 例患者肿瘤与脑中线结构关系密切。胚胎发育不良性神经上皮肿瘤多以药物无效的难治性癫发作起病,也有少数患者可合并头痛、恶心等症状。本组患者中最为常见的癫发作类型为全面性运动性发作,可能与肿瘤多位于额顶叶有关。郑重等[5]研究认为,癫发作类型可能与病灶位置有关,而胚胎发育不良性神经上皮肿瘤难治性癫发作的原因也可能与合并皮质发育不良有关[13⁃14]。
胚胎发育不良性神经上皮肿瘤典型的MRI 征象为肿瘤呈“三角征”,多囊、分叶状或瘤内分隔等。结合本组患者实际,我们选择Chassoux 等[8]总结的胚胎发育不良性神经上皮肿瘤MRI 分型。本组患者Ⅰ型相对于Ⅱ型和Ⅲ型更为常见。MRI 平扫可见部分患者FLAIR 成像呈环形高信号影,但并非水肿而可能是周围神经元成分疏松导致[4]。本组患者DWI 序列肿瘤均呈低信号,并未见明显特异性。MRI 增强扫描部分患者肿瘤呈线样、网格样或环形强化等特点。有研究认为,胚胎发育不良性神经上皮肿瘤瘤内分隔强化是垂直于脑表面的毛细血管所致[15],但本研究影像学检查发现线样强化多位于脑沟处,术中也并未发现病变内有明显血管,所以更像是软脑膜强化。此外,本组患者中1 例(例3)出现病灶内多点状强化,其具体原因尚待进一步研究。虽然该病影像学多表现为囊性信号,但实际上为一种假囊性变,术中均未见明显囊壁和囊液,多为一些灰白色或者灰黄色髓样物质,部分为胶冻样物质。
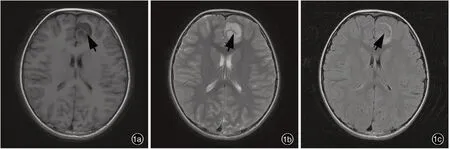
图1 例10 患儿头部MRI 检查所见 1a 横断面T1WI 显示左侧额叶大脑镰旁单发囊性低信号改变,病变内可见等信号分隔(箭头所示) 1b 横断面T2WI 显示病变呈高信号,病变内可见等信号分隔(箭头所示) 1c 横断面FLAIR 成像显示病变周围呈环形高信号(箭头所示),病变内表现为等信号,病变区域灰白质分界尚清楚Figure 1 Head MRI findings of Case 10 Axial T1WI showed single cystic⁃like hypointensity with a isointensity septum inside located in left frontal lobe beside cerebral falx (arrow indicates, Panel 1a). Axial T2WI showed cystic⁃like hyperintensity within a isointensity septum (arrow indicates, Panel 1b). Axial FLAIR showed ring hyperintensity around the isointensity tumor(arrow indicates), and there is a clear gray⁃white boundary within the tumor (Panel 1c).
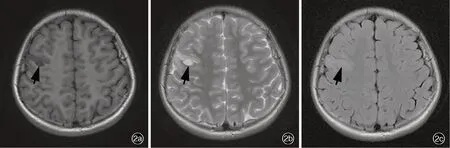
图2 例2 患儿头部MRI 检查所见 2a 横断面T1WI 显示左侧额叶结节样低信号影(箭头所示) 2b 横断面T2WI 显示病变为高信号(箭头所示) 2c 横断面FLAIR 成像显示病变及附近脑组织呈高信号(箭头所示)Figure 2 Head MRI findings of Case 2 Axial T1WI showed hypointensity nodule in right frontal lobe (arrow indicates, Panel 2a). Axial T2WI showed hyperintensity of the nodule (arrow indicates, Panel 2b). Axial FLAIR showed hyperintensity of the nodule and the peripheral brain tissue (arrow indicates, Panel 2c).

图3 例4 患儿头部MRI 检查所见 3a 横断面T1WI 显示右侧额颞岛叶低信号影(箭头所示) 3b 横断面T2WI 显示病变呈高信号(箭头所示),且灰白质分界不清 3c 横断面FLAIR 成像显示病变呈中心低、周围高信号(箭头所示)Figure 3 Head MRI findings of Case 4 Axial T1WI showed abnormal hypointensity hyperplasia lesion covering frontal,temporal and insular lobes (arrow indicates, Panel 3a). Axial T2WI showed hyperintensity of the lesion, and the gray⁃white boundary was unclear (arrow indicates, Panel 3b). Axial FLAIR showed central low and surrounding high signal of the lesion(arrow indicates, Panel 3c).
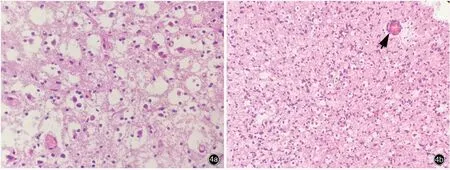
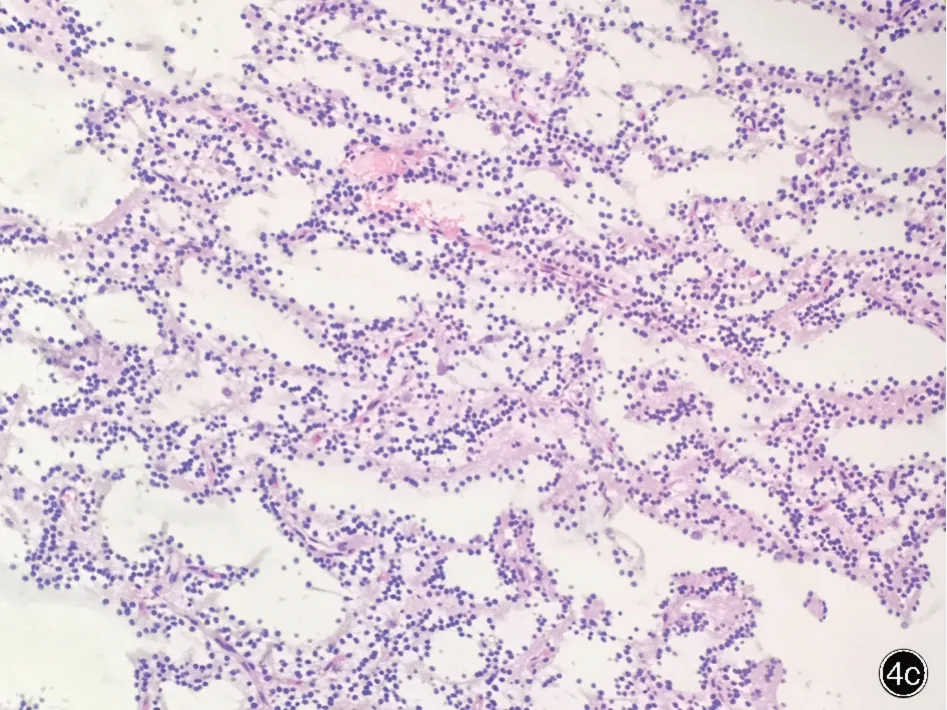
图4 光学显微镜观察所见 HE 染色 4a 可见特异性胶质神经元成分,即大微囊性基质中漂浮着较大的神经元细胞和较小的少突胶质细胞样细胞 ×400 4b 少突胶质细胞样细胞可见核周空晕,环绕于小血管周围,形似“玫瑰花”样改变(箭头所示),此外肿瘤组织密集实性区肿瘤细胞呈“蜂窝”状排列 ×200 4c 肿瘤组织疏松区肿瘤细胞呈“条带”样分布 ×100Figure 4 Optical microscopy findings HE staining"Specific glial neuron components", that were, large neurons floating in the surrounding matrix with small oligodendrocyte⁃like cells could be seen (Panel 4a). × 400 Oligodendrocyte⁃like cells could be seen in perinuclear halo, arounded the small blood vessels of the cells, shaped like "rose" (arrow indicates),tumor cells could be seen in "honeycomb" arrangement in the dense solid areas of tumor (Panel 4b). × 200 Tumor cells were "striped" in loose areas of tumor tissue (Panel 4c). ×100
胚胎发育不良性神经上皮肿瘤的病理可见典型特异性胶质神经元成分,即多微囊样黏液基质中漂浮着较大的神经元成分和少突胶质细胞样细胞成分。少突胶质细胞样细胞是主要的肿瘤细胞成分,胞核呈圆形,缺乏胞质,常常聚集存在于神经元周围,具有较开放的染色质和细腻的核仁,是一种不成熟的神经元表型[16]。Daumas⁃Duport 等[1]将该病病理进行了组织学亚型分型,分为单纯型、复杂型和非特殊型,但非特殊型缺乏特征性胶质神经元成分及胶质结节,与其他胶质瘤难以区分,该亚型尚存争议,有时可能需要结合免疫组化染色进行诊断[15]。Lee 等[17]研 究 发 现,该 病的 原 癌 基因BRAF V600E 突变率可达50%,而Kakkar 等[18]发现,胚胎发育不良性神经上皮肿瘤中BRAF V600E 突变率非常低,约为3.7%。本组患者中有6 例行BRAF V600E 突变检测,均为阴性,虽然样本量相对较小,但更倾向于后者的研究结果。有研究显示,胚胎发育不良性神经上皮肿瘤CD34 阳性率约为61%,可能与该病癫发作有关,且多见于非特殊型,而NeuN 阳性率仅11.4%,GFAP 阳性率约为21%[16,19],这与本研究的病理结果存在差异,9 例行CD34 检查者均为阴性,13 例NeuN、Syn、Olig⁃2 均为阳性,6 例ATRX 亦均为阳性,但因本研究样本量相对较少,需要进一步研究证实。此外,本研究中GFAP、S⁃100阳性率也相对较高,神经元成分NeuN 和Syn 均阳性,提示其符合成熟神经元的免疫表型。胚胎发育不良性神经上皮肿瘤除特异性胶质神经元成分外还可存在少突胶质细胞和星形胶质细胞等多种细胞成分[1,16]。Olig⁃2 在星形 胶 质 细 胞 和 少突胶质 细胞胞核中均有表达,所以在胚胎发育不良性神经上皮肿瘤的免疫组化染色中一般呈弥漫性强阳性。GFAP 一般是在肿瘤中含有星形细胞瘤成分时表现为阳性。胚胎发育不良性神经上皮肿瘤一般不会出现IDH1 和P53 阳性[20],而本组有2 例患者出现了P53 部分阳性,且其中有1 例MRI 分型Ⅲ型患者(例13)术后出现了肿瘤复发,且该例患者IDH1 和P53均呈部分阳性,ATRX 为阳性,Ki⁃67 抗原标记指数为8%,最终根据病理组织中特异性神经元成分的形态学特征并结合临床与影像学特征明确诊断。2011 年,英国一项单中心研究发现,101 例胚胎发育不良性神经上皮肿瘤患者中3 例IDH1 阳性的病例,提示IDH1 阳性是一种少见但是可以存在的现象,所以通过IDH1 阳性不能完全排除胚胎发育不良性神 经 上 皮 肿 瘤[15⁃16]。而IDH1 和P53 突 变 现 象 常 见于弥漫性星形细胞瘤,因此需要与之进行鉴别。病理组织HE 染色中特异性神经元成分的形态学特征一般可明确胚胎发育不良性神经上皮肿瘤的诊断,但非特殊型胚胎发育不良性神经上皮细胞瘤中缺乏特异性神经元成分鉴别极其困难,可能还需结合典型的临床表现、影像学特征及其他免疫学标志物进行鉴别。当青年患者出现难治性癫发作,无肿瘤相关神经功能障碍,且肿瘤发生于大脑皮质时,需考虑胚胎发育不良性神经上皮肿瘤的可能[15]。此外,弥漫性星形细胞瘤一般具有ATRX 表达丢失,因此本研究中ATRX 阳性也具有一定的鉴别诊断意义[21]。既往报道亦有关于该病发生恶变或复发的情况[22⁃23],提示当胚胎发育不良性神经上皮肿瘤IDH1 和P53 阳性时,术后复查至关重要。
胚胎发育不良性神经上皮肿瘤为良性肿瘤,治疗主要以手术切除为主,既往研究报道,约81.8%的患者可以获得良好的癫预后[4]。术后肿瘤残留和肿瘤部位被认为是影响术后癫发作的两个最重要因素[14]。但对于肿瘤全切除后癫预后的研究,结果则存在差异[3,14]。目前尚缺乏肿瘤MRI 分型与术后癫预后的相关研究。本组14 例患者均于显微镜下全切除肿瘤,但未进一步行术中头皮电极的监测和扩大切除,术后癫 发作控制的随访结果显示,8 例MRI 分型Ⅰ型患者术后癫发 作均消失;2 例MRI 分型Ⅱ型患者术后癫发作消失,另2 例Ⅱ型患者癫发作频率明显减少,但仍需口服抗癫药物才能完全控制;2 例MRI 分型Ⅲ型患者术后癫发作频率也有所减轻,均达到EngelⅡ级,仍需口服抗 癫药 物 治 疗。Chassoux 等[8]通 过 对9 例MRI 分型Ⅰ型患者、15 例Ⅱ型患者和9 例Ⅲ型患者进行立体脑电图检查,结果发现,9 例MRI 分型Ⅰ型患者致灶均未超过肿瘤本身,而8 例Ⅱ型患者和8 例Ⅲ型患者的致灶超出肿瘤本身。由此可以解释本研究中单纯肿瘤切除术后MRI 分型Ⅱ型和Ⅲ型患者癫预后差于Ⅰ型患者的现象。Isler 等[4]分别对10 例MRI 分型Ⅰ型、7 例Ⅱ型和4 例Ⅲ型的胚胎发育不良性神经上皮肿瘤患者癫预后进行分析发现,其中有8 例Ⅰ型、5 例Ⅱ型和4 例Ⅲ型可达到EngelⅠ级,与本研究中Ⅲ型患者癫预后最差的结果恰好相反。考虑可能是Isler 等[4]对部分患者行扩大切除或术中应用脑电监测,从而改善MRI 分型Ⅱ型和Ⅲ型患者癫预后所致。此外,Yang 等[24]通过数据分析发现,术后癫持续存在也可能与病灶周围卫星灶未能切除有关,并推荐使用头皮电极指导下进行切除。虽然对于MRI 分型Ⅱ型和Ⅲ型患者肿瘤全切除后癫持续存在的原因仍值得研究,但这也提示我们MRI 分型Ⅱ型和Ⅲ型患者单纯切除肿瘤很可能会残留致灶,可能还需要在头皮电极指导下切除可能的致灶。
结 论
胚胎发育不良性神经上皮肿瘤是一种好发于额顶叶,多见于男性儿童或青少年并常以难治性癫发作起病的良性疾病。典型病理特点为可见特异性胶质神经元成分,其中,Syn、Olig⁃2、NeuN 阳性可对该病的免疫组化诊断有指导意义。MRI 分型Ⅰ型和部分Ⅱ型患者全切除肿瘤后癫预后良好,部分Ⅱ型和Ⅲ型患者即使肿瘤全切除也可能遗留癫发作,提示可能需在术中头皮电极指导下切除肿瘤。
利益冲突无
