利川腌菜细菌菌群多样性及其与风味相关性研究
2020-03-28向凡舒邓长阳王彦杰侯强川
向凡舒,梅 洋,邓长阳,王彦杰,郭 壮,2,侯强川
(1.湖北文理学院 食品科学技术学院,湖北 襄阳 441053;2.恩施市公共检验检测中心,湖北 恩施 445000)
利川腌菜原材料主要是俗称“瓢儿菜”或“疙瘩菜”的大青菜,经晾晒清洗后加入盐、辣椒和大蒜等调味料后,裹扎放入坛中压紧封坛,大约一个月后方可食用,并且随着储存时间延长,味道越浓郁美味。目前我国蔬菜腌制品的发酵大多借助天然附着在蔬菜表面微生物的作用进行[1],腌菜生产过程中,微生物活动不仅影响腌菜发酵时间,对腌菜风味物质及营养成分形成也有重要作用[2]。准确揭示不同腌菜的菌群组成及其与腌菜风味之间的关系,对于腌菜的规模化生产具有重要意义。分子生物学方法的兴起扩大了人们对发酵蔬菜中微生物的认识,PLENGVIDHYA V等[3]在工业蔬菜发酵液中利用脱氧核糖核酸(deoxyribonucleic acid,DNA)指纹图谱鉴定到686株乳酸菌。尚雪娇等[4]以恩施地区腌菜为研究对象,使用变性梯度凝胶电泳结合高通量测序的方法探究了样品中乳酸菌和细菌的多样性。颜娜等[5]采用高通量测序技术解析了恩施地区酸萝卜中的细菌组成。二代高通量测序技术以无需培养和检测速度快的优点广泛应用于发酵食品微生物多样性的研究中,其中16S rRNA是鉴定样品中细菌微生物组成的主要方法,大量细菌微生物多样性的研究以样品宏基因组DNA 16S rRNA单可变区或多可变区进行扩增和测序[6-7],以全面解析样品中菌群的组成。此外,腌菜的风味是影响腌菜质量的重要因素之一[8],微生物通过代谢活动,可以产生糖、酸、醇、酯、氨基酸等产物[9],赋予腌菜各具特色的风味。而通过电子鼻技术可有效揭示样品中不同挥发性物质的浓度,目前该技术已广泛用于不同发酵食品中挥发性物质的检测中[10-12]。
本研究采用Illumina MiSeq高通量测序技术和电子鼻技术相结合的方法,全面解析了利川腌菜中细菌菌群结构和风味组成,同时分析了两者之间的相关关系,以期为全面掌握发酵蔬菜中细菌和风味组成及改进发酵蔬菜的制作工艺提供有益参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
从湖北省恩施土家苗族自治州利川市采集十份腌菜样品,其中样品LCYC1~LCYC3采集自南门菜市场、LCYC4~LCYC6采集自解放东路菜市场、LCYC7~LCYC10采集自大北门农贸市场。所有样品外观无明显差异,制作原料为利川市本地产大青菜,制作地点在利川市本地,所有样品无明显异味和霉斑且制作时间均在1个月左右。
1.1.2 试剂
qiagen69514食品基因组DNA提取试剂盒:德国QIAGEN公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)Mix、聚合酶链式反应(polymerase chain reaction,PCR)缓冲液(10×)、DNA聚合酶(5 U/μL):北京全式金生物技术有限公司;16S rRNA V1~V3区引物由武汉天一辉远生物科技有限公司合成。
1.2 仪器与设备
CT15RE台式冷冻离心机:日本HITACHI公司;2100芯片生物分析仪:美国Agilent公司;ND-2000C微量紫外分光光度计:美国Nano Drop公司;vetiri梯度基因扩增仪:美国AB公司;FluorChem FC3化学发光凝胶成像系统:美国Fluor Chem公司;MiseqPE300高通量测序平台:美国Illumina公司;R920机架式服务器:美国DELL公司。
1.3 方法
1.3.1 样品DNA提取和16S rRNA V1~V3区序列扩增
按照qiagen69514食品基因组DNA提取试剂盒说明书步骤进行10份利川腌菜样品的宏基因组DNA提取,使用V1~V3区域引物27F(5'-AGAGTTTGATCCTGGCTCAG-3)和338R(5'-TGCTGCCTCCCGTAGGAGT-3')对样品V1~V3区进行扩增。PCR扩增体系(20μL):10×PCR缓冲液(含Mg2+)4 μL,dNTPs Mix(2.5 mmol/L)2 μL,正反向引物(5 μmol/L)0.8 μL,DNA聚合酶0.4 μL,DNA模板10 ng,双蒸水(ddH2O)补充至20 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35 个循环;72 ℃末端延伸10 min。
1.3.2 基于电子鼻对样品挥发性风味物质测定
称取10 g腌菜于样品瓶中,60 ℃水浴保温20 min后室温平衡10 min,采用顶空吸气法,进样吸气流量200 mL/min,传感器清洁95 s(如果发现曲线不平或离基线远可再清洗一遍或直接增加清洗时间),样品准备时间5 s,测定时间60 s,选取49 s、50 s和51 s时的响应值求取平均值进行分析,样品间间隔1.5 min。该电子鼻中包含10个金属氧化物传感器阵列,用于分析物质中不同挥发性成分,传感器阵列及性能描述见表1。

表1 传感器阵列及性能描述Table 1 Sensor array and performance description
1.3.3 细菌多样性分析
对测序后的序列进行质控(目的片段长度>300 bp,引物和标签序列完全匹配,整条序列质量>20 的碱基所占比例须>93%),使用QIIME数据分析(V1.7)平台参照CAPORASO J G等[13]的方法对高质量序列进行后续分析,以97%相似度划分操作分类单元(operational taxonomic units,OTUs),选取每一OTU的代表性序列使用Greengenes(V13.8)和核糖体数据库(ribosomal database project,RDP)(V11.5)数据库进行同源性比对,统计样品中细菌在各分类学水平上的菌群组成。
由表2可知,在1h时12T-103菌株对Cry1Ac蛋白降解降较为明显,由15. 95 μg·L-1降低至0. 68 μg·L-1,降低程度达极显著水平(p<0. 01),其降解率达92. 26%,此后12T-103菌株对Cry1Ac蛋白降解较为缓慢且不显著。由此,12T-103菌株对Cry1Ac蛋白的降解能力较强。
1.3.4 数据处理
使用Origin(V8.6)软件和R语言软件(v3.3.2)对数据进行进一步的分析和可视化。使用非参数的Kruskal-Wallis和Mann-Whitney秩和检验分别对多组和两组样品进行差异显著性检验。
2 结果与分析
2.1 利川腌菜样品中细菌丰富度及多样性分析
对10份腌菜样品细菌16S rRNA基因序列V1~V3区进行Miseq高通量测序,通过α多样性曲线评估各样品测序量是否足够及细菌微生物多样性,结果如图1所示。
由图1可知,10份腌菜的稀疏曲线均未达到平台期,表明随着测序量增大仍然会发现新物种,但香农曲线已经到达平台期,说明随着测序量增加细菌多样性基本不发生变化,当前测序量已足以揭示样品中主要菌群的组成。
利川腌菜的测序序列信息和α多样性指数如表2所示。由表2可知,共得到341 560条高质量序列,平均每份样品34 156条序列(15 927~52 610条),对这些代表性序列在97%相似度水平上划分OTU,共获得14 228个典型OTU,平均每份样品3 843个OTU(1 001~6 671)。
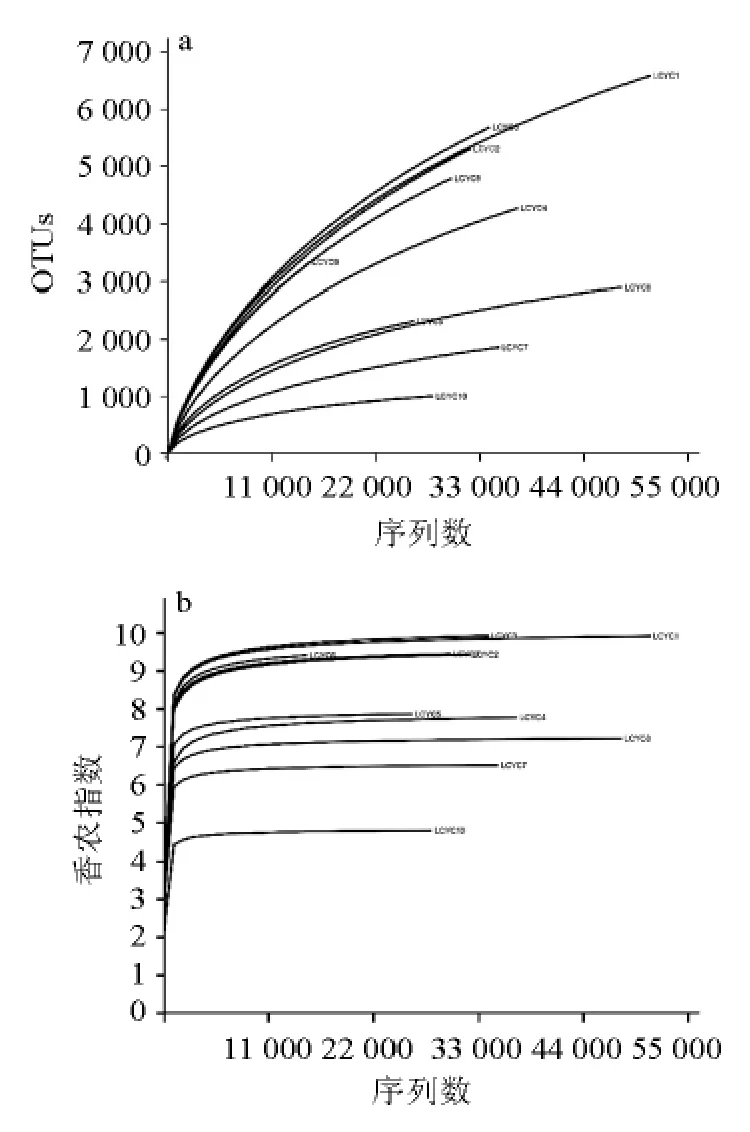
图1 各样品细菌组成的稀疏曲线(a)和香农曲线(b)Fig.1 Rarefaction curve (a) and Shannon curve (b) of bacteria compositions in each sample

表2 利川腌菜样品中细菌群落多样性和丰富度分析Table 2 Analysis of bacterial community diversity and abundance of Lichuan pickles samples
2.2 利川腌菜中细菌种群结构分析
分别在门和属的水平对利川腌菜中的细菌组成进行了注释和分析。在门水平,所有样品共注释到13个细菌门,平均每个样品可检测到9.0±2.5个细菌门,结果如图2a所示。由图2a可知,其中平均相对含量>1%的菌门有4个,分别为厚壁菌门(Firmicutes)(44.4%)、变形菌门(Proteobacteria)(40.4%)、放线菌门(Actinobacteria)(13.5%)和拟杆菌门(Bacteroidetes)(1.5%),虽然各样品门水平组成不尽相同,但各样品优势菌门一致。
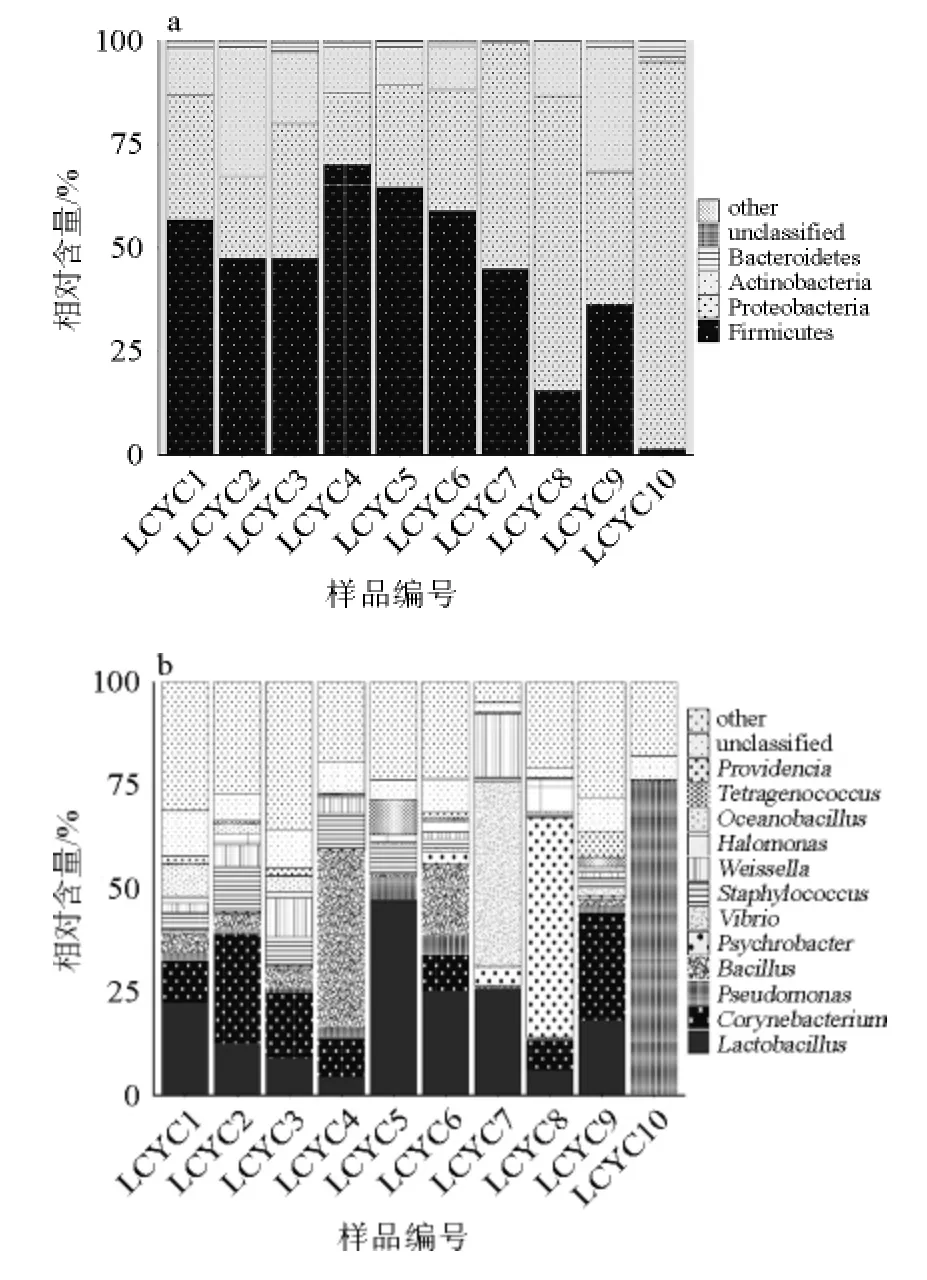
图2 基于门水平(a)和属水平(b)利川腌菜样品中菌群组成Fig.2 Compositions of microbiota at phylum (a) and genus (b) level in different Lichuan pickles samples
由图2b可知,在属水平,所有样品共注释到386个属,平均每个样品可检测到(210±59)个细菌属。其中12个菌属的平均相对含量>1%,主要包括乳杆菌属(Lactobacillus,17.1%),棒状杆菌属(Corynebacterium,10.5%),假单胞菌属(Pseudomonas,9.5%),芽孢杆菌属(Bacillus,7.6%),嗜冷杆菌属(Psychrobacter,6.4%),弧菌属(Vibrio,4.9%),葡萄球菌属(Staphylococcus,4.3%),魏斯氏菌属(Weissella,4.1%),盐单胞菌(Halomonas,1.9%),大洋芽孢杆菌属(Oceanobacillus,1.6%),四联球菌属(Tetragenococcus,1.2%)和普罗维登斯菌属(Providencia,1.2%)。不同样品的优势属亦存在一定的差异,如样品LCYC5、LCYC6和LCYC7中乳杆菌属的相对含量较高,样品LCYC4和样品LCYC6中芽孢杆菌属的相对含量较高,而样品LCYC7、LCYC8和LCYC10分别拥有较高数量的弧菌属、假单胞菌属和嗜冷杆菌属。利川腌菜样品菌群在属水平存在着较大差异,但导致菌群差异的具体原因尚不是十分清楚,推测可能与利川腌菜多由自家生产,非工业化统一生产有关。
2.3 利川腌菜样品中细菌菌群差异性分析
对测序获得的有效数据进行Beta多样性分析,分别基于加权和非加权Unifrac距离对10份腌菜样品进行了主坐标分析,以直观的方式展现不同样品间菌群的差异和相似性,结果见图3。
2.4 利川腌菜中挥发性风味物质分析
电子鼻技术是基于气体传感阵列响应图谱来识别气味的电子系统,广泛应用于风味物质的分析检测中[15-16]。本实验使用该技术对10份利川样品风味物质进行分析,各样品风味物质检测结果见表3。
由表3可知,利川腌菜样品间不同风味的响应值存在较大差异,整体而言,利川腌菜中W5S、W1S、W1W和W2S的响应值最高,平均响应值分别为44.83、79.90、52.04和43.25,表明腌菜风味物质中氮氧化合物、甲烷、萜类化合物和乙醇较丰富。萜类化合物在酸和酶水解作用下易形成游离态挥发性物质,从而赋予产品香气。此外,该物质香气阈值低,在低浓度下可对产品香气产生较大影响[17]。醇类物质主要来源于微生物酒精发酵,使产品具有轻快醇香味[18]。相反,W1C、W3C和W5C的响应值较小,平均响应值仅为0.10、0.17和0.18,表明利川腌菜中芳香类物质含量较低。
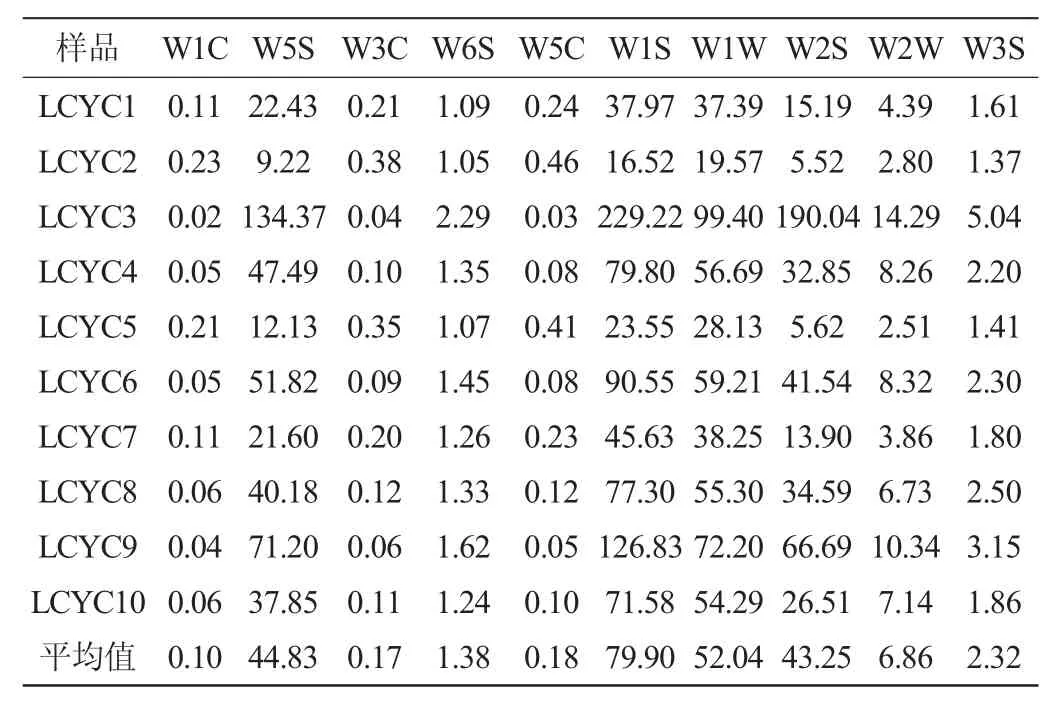
表3 利川腌菜样品中挥发性风味物质电子鼻传感器响应值Table 3 Flavor response value of volatile flavor compounds in Lichuan pickles samples
2.5 利川腌菜中挥发性风味物质差异分析
主成分分析展现了不同样品间的风味差异,结果见图4。由图4可知,10份样品大致分为3簇,其中样品LCYC3单独为一簇(组1),样品LCYC2和LCYC5(组2)为一簇,其余样品为一簇(组3)。对上述3组样品的风味响应值统计分析,结果见图5。
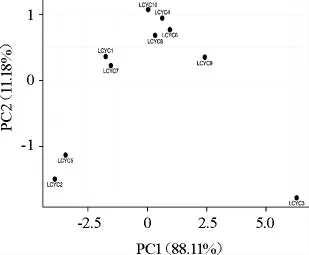
图4 基于主成分分析利川腌菜样品中风味响应值差异分析Fig.4 Difference analysis of flavor response value of Lichuan pickles samples based on principal component analysis

图5 基于主坐标聚类的利川腌菜样品风味响应值差异分析Fig.5 Difference analysis of flavor response value of three groups of Lichuan pickles samples based on principal coordinate clustering
由图5可知,三组样品存在较大差异的风味是W5S、W1S、W1W和W2S,分别代表氮氧化合物、甲烷、萜类化合物和乙醇,上述风味在组1中的响应值分别为134.37、229.22、99.40和190.04;组2中的响应值分别为10.67、20.04、23.85和5.57;组3中的响应值分别为41.79、75.67、53.33和33.04。说明这四种风味物质对利川腌菜整体风味的贡献较大。
2.6 菌群结构与挥发性物质相关性分析
由菌群结构分析和风味物质分析发现,不同样品菌群结构和风味物质之间都存在较大的差异。因此,本研究将相对含量>0.5%的菌属与风味响应值之间进行了Spearman相关性分析,结果见图6。由图6可知,部分菌群与风味响应值之间存在显著相关性:其中变形杆菌与W3S、W2W、W6S、W2S、W5S、W1S和W1W呈显著正相关(P<0.05),与W3C、W5C、W1C等芳香类风味响应值呈显著负相关(P<0.05);嗜冷杆菌属与W3S和W6S呈显著正相关(P<0.05);而肠球菌属与W2W、W2S和W5S呈显著正相关(P<0.05),众多研究者认为肠球菌广泛存在于发酵食品中,不仅影响食品的风味、香气和质地,还可产生乙醇、过氧化氢等物质[19-20],这与本研究结果一致。此外,风味响应值W5S、W1S、W1W和W2S与样品中70.4%相对含量>0.5%的菌属如肠球菌属、弧菌属、芽孢杆菌属等存在正相关关系,与之相反,风味响应值W1C、W3C和W5C则与上述菌群存在负相关关系,尽管上述相关性均不显著。可能在这些菌属的共同作用下,最终发酵蔬菜产品中上述响应值对应的氮氧化合物、甲烷、萜类化合物和醇类物质的含量较高,而芳香类物质含量较低。相关性分析结果表明发酵利川腌菜中风味物质受多种微生物共同作用的影响,而非单一微生物发酵产生。

图6 主要细菌属与风味响应值相关性分析Fig.6 Correlation analysis between major bacterial genera and flavor response value
3 结论
本研究以利川地区腌菜为研究对象,利用Illumina MiSeq高通量测序技术和电子鼻技术全面解析腌菜中细菌多样性及其风味物质,发现其细菌门主要为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),主要细菌属为乳杆菌属(Lactobacillus)、棒状杆菌属(Corynebacterium)和假单胞菌属(Pseudomonas)。利川腌菜中氮氧化合物、甲烷、萜类化合物和乙醇对利川腌菜整体风味的贡献较大。不同样品细菌组成和风味物质存在差异,腌菜中菌群的组成与腌菜风味之间存在密切联系,提示在腌菜的工业化生产过程中需要密切关注发酵罐中腌菜的菌群的组成。
