SIRT1选择性激动剂改善肺气肿大鼠肺损伤及其相关机制的研究
2020-03-25顾超
顾超
在慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者中,长期气流受限的主要原因是肺泡结构的破坏,进而导致气腔的扩大以及肺弹性组织降解[1]。引起肺气肿及COPD最主要的危险因素是吸烟[2]。在哺乳动物中,肺泡上皮细胞是由I型肺泡上皮细胞(type I alveolar epithelial cells,AECI)和Ⅱ型肺泡上皮细胞(type II alveolar epithelial cells,AECII)组成。其中,AECII是AECI的祖细胞,并且在分泌肺泡表面活性物质、维持肺泡内液体平衡等方面发挥重要的作用[3]。Sirtuins是Ⅲ型组蛋白去乙酰化酶,能够对多种非组蛋白去乙酰化,在基因转录、能量代谢和细胞衰老中起到重要作用[4]。前期已有研究表明,SIRT1水平的下降会促进COPD患者的内皮祖细胞衰老和功能异常[5]。本研究通过SIRT1选择性激动剂SRT2104治疗肺气肿大鼠,并检测其对大鼠肺损伤的修复作用及其相关机制。
1 材料与方法
1.1 实验动物及材料 (1)实验动物:清洁级的雄性SD大鼠45只,体重170~200g,购于上海西普尔必凯实验动物有限公司,并饲养在浙江中医药大学动物实验中心,饲养温度为21℃~25℃,相对湿度为40%~60%,12h明暗交替。(2)主要试剂:兔抗大鼠SPA和SPC抗体、羊抗兔IgG二抗(购自美国Santa Cruz公司),TRIzol(购自美国Invitrogen公司),雄狮牌香烟(购自浙江中烟工业有限公司)。SIRT1去乙酰化酶检测试剂盒(购自美国Enzo Life Sciences公司);细胞衰老相关β-半乳糖苷酶染色试剂盒(购自江苏碧云天公司);SRT2104(购自美国MedChem Express公司)。
1.2 方法 (1)肺气肿大鼠模型的建立和SRT2104治疗:将45只清洁级的雄性SD大鼠完全随机平均分为3组,每组各15只,A组(正常对照组)、B组(肺气肿组)、C组(肺气肿+SRT2104治疗组);根据本课题组的前期方法[6]建立肺气肿大鼠的实验模型。C组大鼠于建模第12周后开始按100mg/(kg·d)剂量灌胃SRT2104,共4周;其中,B组大鼠每天给予相同体积的生理盐水灌胃。(2)肺功能检测:采用小动物肺功能仪测定各组大鼠的肺功能,大鼠麻醉消毒并切开颈部皮肤,将气管倒“T型”切开,用食道插管经口插入大鼠食道中部,并连接压力传感器记录食道压(胸腔负压)、“Y型”套管气管插管,采集信号,通过MPA肺功能分析计算气道阻力(airway resistance,AR)、肺动态顺应性(pulmonary dynamic compliance,Cdyn)及呼气峰值流速((peak expiratory flow,PEF)并取平均值。(3)大鼠肺组织病理学分析:大鼠肺功能测定后采用10%水合氯醛行腹腔麻醉处死。取肺组织,固定脱水后石蜡包埋并切片后,行苏木素-伊红(HE)染色,根据本课题组前期方法[6],采用肺组织病理半定量分析其肺泡平均内衬间隔(mlI)和平均肺泡面积(MAA)。(4)Realtime PCR测定SPA和SPC mRNA表达:收集各组大鼠肺组织,按试剂盒的说明书合成cDNA,按照前期方法[6]行Real-time PCR,并以GAPDH作为内参;以2-ΔΔCt分析目的基因的相对表达。其中,引物序列如下:SPA正义链5'-TCGGTGTCCCAGGATTTAG-3',反 义 链 5'-CAGGGTGGCTGCTGTTAGT-3';SPC正 义 链5'-CAGACACCATCGCTACCTT-3', 反 义链 5'-TAGCCAAAGCCTCAAGACT-3';GAPDH 正义链5'-GTTCAACGGCACAGTCAAG-3',反义链5'-GCCAGTAGACTCCACGACAT-3'。(5)Western blot测定SPA及SPC蛋白水平:按照本课题组前期方法[6]进行。(6)衰老相关的β-半乳糖苷酶(SA-β-gal)活性测定:采用染色法测定大鼠肺组织的SA-β-gal活性,按照试剂盒说明书操作。(7)SIRT1去乙酰化酶活性检测:以比色法测定大鼠肺组织SIRT1去乙酰化酶活性,严格按试剂盒说明操作。
1.3 统计学方法 采用SPSS 20.0统计软件包。计量资料以(±s)表示,统计分析采用方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠肺功能AR、Cdyn及PEF比较 见表1。
表1 各组大鼠肺功能AR、Cdyn及PEF比较[n=15,(±s)]
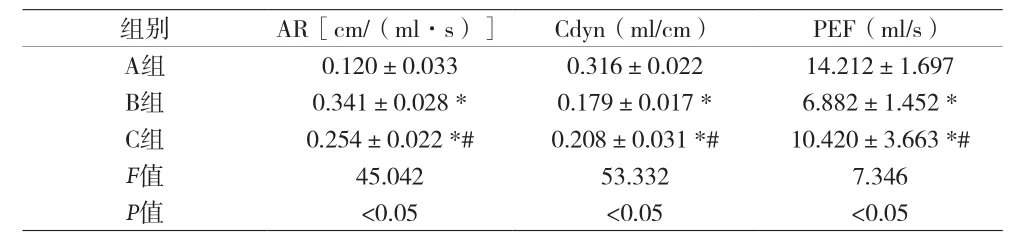
表1 各组大鼠肺功能AR、Cdyn及PEF比较[n=15,(±s)]
注:与A组比较,*P<0.05;与B组比较,#P<0.05
组别 AR[cm/(ml·s)] Cdyn(ml/cm) PEF(ml/s)A组 0.120±0.033 0.316±0.022 14.212±1.697 B组 0.341±0.028 * 0.179±0.017 * 6.882±1.452 *C组 0.254±0.022 *# 0.208±0.031 *# 10.420±3.663 *#F值 45.042 53.332 7.346 P值 <0.05 <0.05 <0.05
2.2 肺组织病理学改变 各组大鼠的肺组织采用常规HE染色,B组及C组大鼠的肺组织出现肺气肿病理特征:部分肺泡出现囊状扩张,部分肺泡腔不规则,并且相同视野内的肺泡数目显著减少,部分肺泡间隔出现断裂,进而肺泡融合;但是,SRT2104治疗后肺组织肺气肿改变程度显著减轻,见图1。肺组织病理的半定量分析证实,B组大鼠肺组织mlI及MAA显著高于A组(P<0.05),而SRT2104治疗后(C组)大鼠肺组织mlI及MAA显著低于B组(P<0.05),见表2。
表2 各组大鼠肺组织的mlI及MAA变化(n=15,±s)

表2 各组大鼠肺组织的mlI及MAA变化(n=15,±s)
注:与A组比较,*P<0.05;与B组比较,#P<0.05
组别 mlI(μm) MAA(μm2)A组 64.34±12.33 4938.39±501.92 B组 121.65±12.22* 12488.89±1146.42*C组 80.98 ±11.30 *# 7983.88±358.12 *#F值 28.782 97.367 P值 <0.05 <0.05

图1 各组大鼠肺组织病理学改变(HE染色,×200)
2.3 SPA和SPC mRNA表达水平 采用Real-time PCR检测大鼠肺组织的SPA和SPC mRNA表达水平,结果表明,与A组比较,B组大鼠肺组织中SPA及SPC mRNA的表达明显降低(P<0.05);而SRT2104治疗后(C组)大鼠肺组织SPA及SPC mRNA的表达显著高于B组(P<0.05),见图2。
2.4 SPA及SPC蛋白表达 Western blot测定大鼠肺组织的SPA和SPC蛋白的表达水平,结果表明,SPA及SPC蛋白在B组大鼠肺组织中表达明显低于A组(P<0.05);但是SRT2104治疗后(C组),SPA及SPC蛋白表达显著高于B组(P<0.05),见图3;其结果与SPA及SPC mRNA在大鼠肺组织中表达一致。
2.5 SA-β-gal活性变化 采用染色法测定大鼠肺组织的SA-β-gal活性,大鼠肺组织中被染色成蓝色的细胞即为SA-β-gal阳性的细胞,即为衰老细胞,其大多数位于肺泡角部。结果显示,与A组比较,B组大鼠肺组织中的SA-β-gal阳性细胞显著增多,但是SRT2104治疗后(C组),大鼠肺组织SA-β-gal阳性的细胞显著减少,见图4。

图2 各组大鼠肺组织的SPA和SPC m R N A水平。注:与A组比较,★P<0.05;与B组比较,# P<0.05
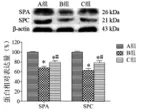
图3 各组大鼠肺组织SPA及SPC蛋白表达。注:与A组比较,★P<0.05;与B组比较,#P<0.05

图4 各组大鼠肺组织的SA-β-gal活性变化(× 400)。
2.6 SIRT1去乙酰化酶的活性改变 比色法检测大鼠肺组织SIRT1去乙酰化酶活性,结果表明,与A组比较,B组大鼠肺组织SIRT1去乙酰化酶活性显著降低(P<0.05),而SRT2104治疗后(C组),大鼠肺组织中的SIRT1去乙酰化酶活性明显升高(P<0.05)。
3 讨论
到2020年,预计COPD将会是全球死亡原因的第三位因素,给社会和家庭带来巨大的负担[2]。COPD的发病机制复杂,其病变可以累及肺实质和肺血管等,并且进行性发展[1]。本研究中,通过被动吸烟及大鼠气道内脂多糖吸入建立肺气肿模型,肺组织出现明显的肺气肿病理表现,包括肺泡出现囊状扩张,部分肺泡间隔出现断裂,进而肺泡融合。并且肺功能检测也表明肺气肿大鼠气道阻力显著增加,而肺动态顺应性及呼气峰值流速明显降低,符合肺气肿的变化。
作为AECI的祖细胞,AECII在分泌肺泡表明活性物质、维持肺泡内稳态及气体交换和提高肺组织修复能力方面具有重要的作用,并且SPA及SPC是由AECII特异性地分泌。与上述研究相同的是,在本研究中,肺气肿大鼠肺组织中的SPA及SPC mRNA及蛋白表达水平明显降低,表明其肺组织中AECII存在受损。但是,SRT2104治疗后,大鼠肺功能中的气道阻力、肺动态顺应性及呼气峰值流速得到改善,并且肺组织肺气肿表现好转。但是,通过SRT2104治疗来改善肺气肿大鼠肺功能的相关机制需要进一步阐明。作为SIRT1的选择性激动剂,SRT2104具有重要的病理生理学功能;如减轻心肌纤维化、改善动脉内皮细胞功能障碍、缓解骨质疏松。相关研究证实,细胞衰老在COPD患者中会加速,并且促进COPD进展[7]。肺气肿患者肺泡细胞衰老的水平与其气流受限的程度呈正相关。因此,作者假设肺气肿大鼠的肺泡上皮细胞异常表达可能与其过早衰老相关。SIRT1是长寿基因,具有显著的逆转衰老的能力,并且具有较高的安全性和抗炎活性[8]。SA-β-gal是细胞衰老重要生物标记物。
本研究中,C组肺气肿大鼠经SRT2104治疗后,肺组织中的SPA及SPC mRNA及蛋白表达水平显著升高,考虑其相关机制可能是SRT2104通过改善或者修复Ⅱ型肺泡上皮细胞的数量或者功能来改善肺气肿大鼠的肺损伤。作者进一步采用染色法和比色法来测定大鼠肺组织中SA-β-gal活性变化及SIRT1去乙酰化酶的活性改变,发现C组肺气肿大鼠肺组织中SA-β-gal阳性细胞显著减少,并且SIRT1去乙酰化酶活性明显升高,结果表明SRT2104治疗后大鼠肺组织中衰老的肺泡细胞明显减少。综上所述,SIRT1选择性激动剂SRT2104可能通过抑制Ⅱ型肺泡上皮细胞衰老或者促进肺泡上皮细胞的进一步修复来改善肺气肿大鼠的肺损伤。但是,SRT2014上述功能的信号调控机制仍需进一步研究。
