不育男性精子DNA碎片与年龄及精液常规参数的关系分析
2020-03-25朱佳余柯达毛佳婷邹立波师帅刘鸿
朱佳 余柯达 毛佳婷 邹立波 师帅 刘鸿
随着我国“全面二孩”政策的开放和初婚年龄的推迟,高龄使不孕不育的问题显著增加。在不孕不育患者中因男性因素导致的不育几乎占了一半,对男性的生育力进行评估需要进行常规精液分析,其中有15%显示精液常规分析指标正常,表明仅靠常规精液分析无法全面评估男性生育力。近年来有大量研究结果表明精子DNA碎片与男性生育力相关,Zini等[1]发现不育男性的精子DNA碎片指数(DFI)显著高于正常男性。有研究者发现当精子DFI>30%时,宫腔内人工授精的妊娠率显著降低[2-3]。精子DFI对IVF/ICSI结局的影响,研究结果表明其和受精率、胚胎发育、着床率与妊娠率等具有显著的负相关性[4-5]。因此检测精子DFI对评估不育男性生育力具有重要意义。本研究测定了316例男性不育症患者的精子DFI、精液体积、液化时间、精子浓度、前向运动率和正常形态率等参数,分析了不育男性精子DFI与年龄及精液常规参数的相关性。
1 资料与方法
1.1 一般资料 收集2018年1月至12月在本院生殖医学中心就诊的不育症男性患者作为研究对象。纳入标准:(1)夫妻正常性生活>1年不育;(2)男方体检未发现明显睾丸、附睾及输精管异常;(3)无遗传性疾病家族史;(4)女方输卵管通畅,无生育能力异常。本研究经医院伦理委员会同意,所有研究对象签署知情同意书。
1.2 方法 所有患者禁欲3~7d后通过手淫法取精,将全部精液置于无菌取精杯中,并置于37℃的水浴箱中进行液化,完全液化后利用CASA分析精子浓度和前向运动率,采用Diff-Quik染色法和精子染色质扩散实验(SCD)分别检测精子形态和精子DFI。SCD结果判断:计数500个精子,观察精子光晕大小,根据光晕与精子头部横径的比例,分为大、中、小和无光晕4个级别。大和中光晕表示精子DNA完整无碎片,小和无光晕表示精子DNA断裂为碎片。精子DFI的值为小和无光晕精子数/精子总数。小光晕≤精子头直径1/4,中光晕>精子头直径1/4却≤精子头直径2/3,大光晕>精子头直径2/3。
1.3 统计学分析 采用SPSS 16.0统计软件对不育男性精子DFI与年龄、精液体积、液化时间、精子浓度、前向运动率和正常形态率的相关性进行分析,计数资料比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
符合纳入条件的有316例不育症男性患者,对其精液进行精子DFI 检测,按结果分成3组:精子核 DNA完整性正常组(DFI<10%,图1A,201例,占63.61%)、精子核DNA完整性轻度异常组(10%≤DFI<20%,图1B,79例,占25.00%)和精子核DNA完整性重度异常组(DFI≥20%,图1C,36例,占11.39%)。
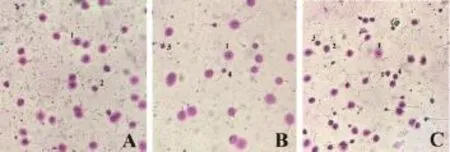
图1 光学显微镜下SCD实验结果(A:DFI<10%;B:10%≤DFI<20%;C:DFI ≥20%。1、2、3和4分别为大、中、小和无光晕精子)
2.1 不育男性精子DFI与年龄的相关性 根据不育男性的年龄分成≤30岁、31~40岁和≥41岁三组,根据表1可知,在DFI<10%中,年龄≤30岁组的比例高达80.37%,显著高于31~40岁组和≥41岁组的 60.36% 和 32.50%(P<0.05),同时 31~40岁组显著高于≥41岁组(P<0.05)。在10%≤DFI<20%中,年龄≤30岁组的比例显著低于31~40岁组和≥41岁组(P<0.05),且 31~40岁组显著低于≥ 41岁组(P<0.05)。在DFI≥20%中,其比例随年龄变化趋势与10%≤DFI<20%一致。
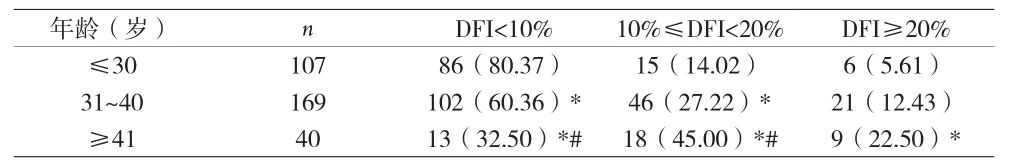
表1 不育男性年龄与精子DFI的相关性[n(%)]
2.2 不育男性精子DFI与精液常规参数的相关性 根据精液体积将患者分成<1.5ml和≥1.5ml 两组,两组之间 DFI<10%、10% ≤ DFI<20% 和 DFI≥ 20% 的患者比例无显著差异性(P>0.05)。液化时间<30min和≥30min之间三组DFI的患者比例变化与精液体积一致,无统计学差异(P>0.05)。根据精子浓度将患者分成 <50×106/ml和≥ 50×106/ml两组,<50×106/ml中DFI<10% 的患者比例显著低于≥ 50×106/ml(P<0.05),10%≤DFI<20%和DFI≥20%的比例则显著高于≥50×106/ml(P<0.05)。根据前向运动率(正常形态率)将患者分成<32%和≥32%(<4%和≥4%)两组,两组之间DFI的患者比例变化与精子浓度一致,具有统计学差异(P<0.05)。见表2。
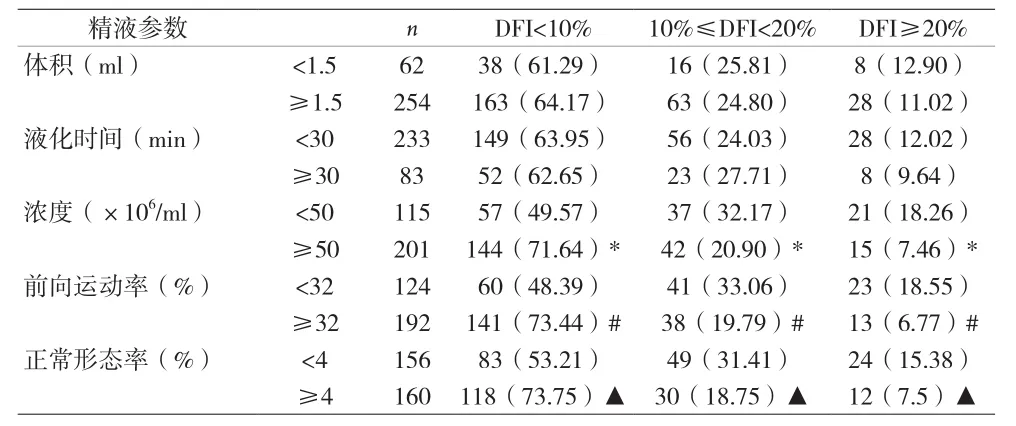
表2 不育男性精液参数与精子DFI的相关性[n(%)]
3 讨论
精子DNA的完整性是父代遗传信息得以准确传递的必要条件。关于精子DNA碎片化的具体发生机制尚不完全清楚,目前学者们认为氧化应激、凋亡异常和染色质组装异常是DNA发生碎片化的主要机制[6]。氧化应激:正常情况下,体内活性氧(ROS)的产生和清除处于平衡状态,若受到有害刺激因素或其他条件的限制时,则会使平衡受到破坏,机体进入氧化应激状态,过量的ROS会导致精子DNA损伤。凋亡异常:凋亡调控着精子在数量、形态和功能上的平衡,若凋亡发生异常,不能清除DNA受损的精子,使其比例大幅度上升。染色质组装异常:精子核染色质的组装过程容易受到有害因素干扰而出现异常,导致精子DNA双链碎片的产生和染色质结构的破坏。目前用于精子DFI检测的方法较多,相较于精子染色质结构分析试验、彗星实验和荧光原位杂交等,SCD是一种简便易行、费用低、敏感的检测精子DNA损伤的检测方法。
关于不育男性精子DFI与年龄之间的相关性,多数研究者认为随着不育男性年龄的增加,其精子DFI显著升高[7-8]。本研究的结果与上述结论相一致。正常情况下人体内的氧化体系和抗氧化体系之间保持着相对平衡状态,但随着年龄增加,男性的生殖系统逐渐老化,ROS产生和清除之间的平衡就被破坏,导致ROS增多,造成精子DNA链断裂,从而使精液中的精子 DFI升高[6]。
精液体积、液化时间、精子浓度、前向运动率和正常形态率是精液质量常规分析中的重要指标,本研究结果表明精子DFI 与精液体积、液化时间之间无显著相关性(P>0.05),与精子浓度、前向运动率和正常形态率之间呈显著负相关(P<0.05)。过多的ROS会导致精子DNA损伤,并诱导含脂质的精子质膜过氧化,从而导致精子的结构和功能损伤,还会通过破坏精子轴丝结构和减少三磷酸腺苷含量来损害精子的运动能力[9],因此导致精子DFI与前向运动率呈显著负相关。同时染色质被ROS重度损伤的精子会提早进入细胞凋亡阶段[10],因此导致精子DFI也与精子浓度呈负相关。精子形态中的头部是染色质凝聚程度的外在表现,是根据细胞核中染色质凝聚过程中DNA-蛋白质复合体特殊的组装方式决定的[11],因此精子DFI和正常形态率负相关的原因可能是精子DNA损伤导致精子染色体结构受损。综上所述,精子DFI在反映精子 DNA 损伤程度的同时也反映了精子浓度、活力及其形态,因此可作为评价男性精液质量和生育力的重要指标之一。
