人牙髓干细胞、牙周膜干细胞表型及生长特性分析
2020-03-13庞真贞李硕刘钦赞李晔王良
庞真贞 李硕 刘钦赞 李晔 王良
牙周膜干细胞是从牙周膜组织中分离出的干细胞,是牙周组织功能首选中西细胞,具有自我更新能力,可分化为牙骨质、牙周膜以及牙槽骨[1,2]。传统的牙周病治疗主要是消除病因,难以修复已丧失的牙周组织。牙髓干细胞具有多向分化的潜能,它除了能形成矿化结节能力的细胞外,经过不同细胞因子的诱导,还能够分化为脂肪、骨、软骨、肌肉、血管内皮、肝、神经等细胞系类型[3,4]。牙髓组织位于牙齿内部的牙髓腔内,是牙体组织中唯一的软组织[5]。通过对人牙髓细胞的研究,发现了一种与骨髓间充质干细胞有着极其相似的免疫表型及形成矿化结节能力的细胞,细胞中形态呈梭形,可自我更新和多向分化,有较强的克隆能力[3]。这些由牙髓组织中分离出的成纤维状细胞称为牙髓干细胞(dental pulp stem cells)。目前认为牙周膜干细胞与牙髓干细胞是口腔乃至全身多种组织再生极有应用前景的两种间充质干细胞,本文分析2种干细胞的表型及生长特性。
1 材料与方法
1.1 材料 2018年7至12月选择18~25岁因正畸拔除完整第三磨牙10颗。
1.2 纳入与排除标准 (1)纳入标准:牙齿健康,双尖牙或第三磨牙,患者对治疗知情同意,对本研究也知情同意。(2)排除标准:合并根尖病,龋齿,牙周病。
1.3 试剂与仪器 20%胎牛血清,DMEM,细胞筛网。
1.4 干细胞纯化扩增方法[6]
1.4.1 牙周膜干细胞:拔除后置入含3倍抗体的PBS液中,在超净台,用PBS液从牙根到牙冠方向冲洗5次,清除血污,灭菌手术刀片刮根中下1/3牙周膜组织,置入离心管,加消化液,37℃下消化30 min,每5分钟摇晃离心管1次。加2 ml含20%胎牛血清,1 000 r/min离心,5 min,去上清,转入35 mm培养皿,37℃,5%CO2,培养,组织块贴壁过夜,第2天补加1.5 ml 原代细胞培养液。待细胞汇合至80%,进行传代。
1.4.2 牙髓干细胞:取上述刮牙周膜组织牙齿,切开牙冠,暴露牙髓,取出牙髓,浸入3倍双抗PBS中,后续操作同上,待细胞汇合至80%,传代。
1.4.3 细胞纯化、扩增:分别收集培养的处于对数生长期的牙周膜细胞与牙髓细胞上清液,作为适应性培养基;对培养细胞消化、离心、去上清,加适应性培养基,吹打,过细胞筛,制成单个细胞超过悬液90%,调增细胞密度为每毫升10~15个,接种与96孔培养板,每孔100 μl,培养24 h、48 h,标记单个细胞孔,补至每孔200 μl,第6天,半量换液,随后每2天换1次。7~14 d,细胞数≥50为出现细胞克隆,待克隆细胞至孔底1/2~2/3后,用0.25%胰酶消化,离心,去上清,移至48孔培养板,继续培养,至24孔、12孔、6孔,转入6 cm、10 cm培养皿、T25培养瓶,继续培养,至细胞覆盖瓶底80%,胰酶消化,离心,去上清,转入T75瓶培养,得到第8代干细胞,制备为单细胞悬液,细胞密度超过1×107/ml,备用。
1.5 分析方法
1.5.1 细胞生长测定:将细胞悬液调为密度1×104/ml,接种至96孔板,分为12组,每组6个复孔,分别培养1~12 d,每天取1组,弃培养液,每孔加基础培养基,5%CO2,37℃培养4 h,酶标仪492 nm处测A值,重复3次,取平均值,比较同一时间两种细胞OD值。
1.5.2 流式细胞仪:制备细胞混悬液,密度为1×106/ml,分别装入EP管中,标记,每组6个管,加入浓度为0.2 mg/ml的STRO-1、CD29、CD34、CD44、CD45、CD73、CD90、CD105、CD146、CD166对应的同型抗体浓度。4℃避光孵育50 min,PBS重悬,离心,弃上清,加PBS重悬,过滤,流式细胞仪测定分析。
1.5.3 细胞集落检测:参考文献[7]。对数生长期的细胞,常规消化传代,制作为细胞悬液,分散细胞使单给细胞超过95%,按照每皿5 μl含50、100、200细胞的浓度,接种至培养皿中,37℃,5%CO2培养,根据pH值变化更换新鲜培养液,培养3周,弃原液,PBS液洗涤,多聚甲醛固定,PBS洗涤,加甲苯胺蓝染色15 min,PBS洗涤,干燥,计数细胞克隆集落,集落为细胞数≥50个,计算集落形成率(集落数/接种细胞数)×100%。

2 结果
2.1 细胞生长增殖情况比较 牙髓干细胞培养3 d出现快速生长,第9天后进入平台期;牙周膜干细胞在培养4 d后开始快速生长,第8天就进入平台期。在3~12 d时,牙髓干细胞细胞增殖A值显著高于牙周膜干细胞,差异有统计学意义(P<0.05)。见表1。
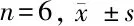
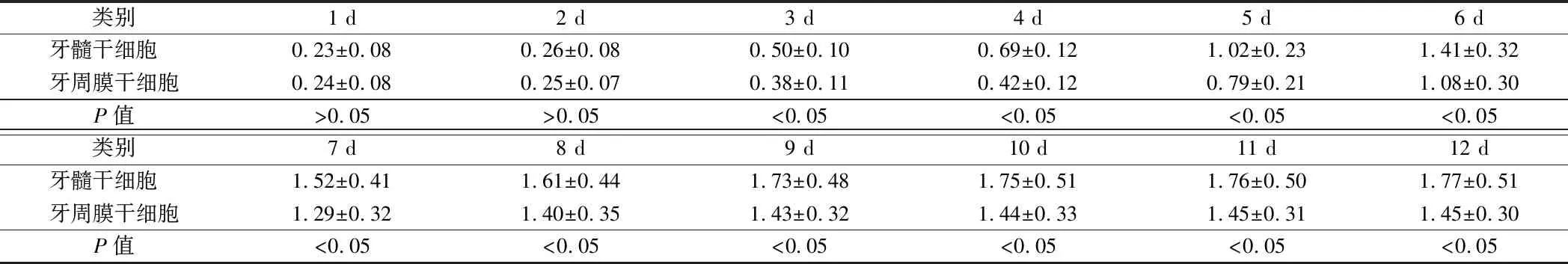
类别1 d2 d3 d4 d5 d6 d牙髓干细胞 0.23±0.080.26±0.080.50±0.100.69±0.121.02±0.231.41±0.32牙周膜干细胞0.24±0.080.25±0.070.38±0.110.42±0.120.79±0.211.08±0.30P值>0.05>0.05<0.05<0.05<0.05<0.05类别7 d8 d9 d10 d11 d12 d牙髓干细胞 1.52±0.411.61±0.441.73±0.481.75±0.511.76±0.501.77±0.51牙周膜干细胞1.29±0.321.40±0.351.43±0.321.44±0.331.45±0.311.45±0.30P值<0.05<0.05<0.05<0.05<0.05<0.05
2.2 2种细胞中STRO-1、CD29、CD44、CD73、CD90、CD146、CD105、CD34、CD45表达率比较 牙周膜干细胞和牙髓干细胞中STRO-1、CD29、CD44、CD73、CD90、CD146、CD105均呈高表达。牙周膜干细胞和牙髓干细胞中STRO-1、CD29、CD44、CD73、CD90、CD146、CD105、CD34、CD45表达率比较差异无统计学意义(P>0.05)。见表2。
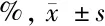

类别STRO-1CD44CD29CD90CD34CD45CD73CD146CD105牙周膜干细胞92.13±13.8190.32±15.5293.0±15.5795.94±16.632.03±0.712.31±0.6897.43±17.4395.53±15.9497.99±14.48牙髓干细胞 92.05±14.5090.41±14.9692.7±14.9396.10±17.212.25±0.732.20±0.6598.02±18.1596.12±16.2897.62±15.53
2.3 2种细胞中集落形成率比较 牙髓干细胞的集落形成率为(4.56±0.88)%显著高于牙周膜干细胞的(2.21±0.63)%,差异有统计学意义(P<0.05)。见表3。
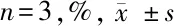

类别集落形成率牙周膜干细胞2.21±0.63牙髓干细胞 4.56±0.88∗
注:与牙周膜干细胞比较,*P<0.05
3 讨论
3.1 牙髓干细胞与牙周膜干细胞 干细胞(stem cells)是一类具有自我更新、自我复制能力的多潜能细胞[8]。在一定条件下,它可以分化成多种APSC多能细胞,是一类具有自我复制和多向分化潜能的原始细胞。多能干细胞(Ps)具有分化出多种细胞组织的潜能,但失去了发育成完整个体的能力,发育潜能受到一定的限制[9]。
人牙周膜干细胞是来源牙周膜的成体干细胞,有较强的更新能力,可进一步分化为不同功能特性的细胞[10,11]。人牙周膜干细胞可分化为牙槽骨、牙骨质、牙周膜,对维持牙周膜稳定、修复牙组织[12,13]。人牙周膜干细胞有高度的增殖能力以及自我更新的能力,除了可分化为牙骨质、牙槽骨、牙周膜外,研究显示,其还可以分化为成骨细胞、软骨细胞、胶原细胞、脂肪细胞、牙骨质细胞[14,15]。人牙周膜干细胞来源与牙周膜细胞群,原代培养成本低,操作简单,一般分离人牙周膜干细胞有3种方法,包括组织块法,酶解组织块法、酶联合消化法,本研究应用酶解组织块法。组织块法培养原代时间长,酶联合消化法酶消化时间不容易确定,并且与酶解组织块法比较,原代培养成功率,但是克隆率要高。
牙髓干细胞无论从数量上,还是分离培养方法上,要优于牙周膜干细胞,并且其在神经方面的分化潜能,使其有成为干细胞库的潜能。牙髓属于结缔组织,有一定的修复再生能力,牙髓干细胞体外培养发现其具有高度增生能力与自我更新能力。牙髓干细胞具有与骨髓基质干细胞相似的免疫表型,并且前者具有更高的增生率。牙髓干细胞具有形成矿化结节能力,形态为梭形,除了自我更新,还具有多向分化的功能,可分化为成牙本质细胞、骨细胞、神经细胞、脂肪细胞等。牙髓干细胞用于牙周组织在上、牙髓组织再生、颌面部骨组织缺损修复等具有较好的安全性。并且动物模型研究显示,牙髓干细胞还可用于软骨、神经、角膜等再生[15]。目前对牙髓干细胞的研究还处于早期阶段,对其应用也较为局限,但其在再生医学工程、组织工程方面具有较好的应用潜能[16]。
3.2 牙髓干细胞与牙周膜干细胞的生长特性 在临床应用中,因牙周膜干细胞数量少,培养相对困难,并且来源有限,极大限制其转化的进程,而与之相比,牙髓干细胞无论从数量上,还是分离培养方法上,都明显优于牙周膜干细胞,因此具有成为该细胞库的潜能[17,18]。牙髓属于结缔组织,有一定的修复再生能力,因成牙本质细胞属于终末细胞,一旦分化,就不再分裂,因此,一般认为牙本质细胞受损后,牙髓内未分化前提细胞能分化为成牙本质细胞[19-22]。目前认为牙髓干细胞可能来自血管周围微环境[23-25]。本研究结果也显示,牙髓干细胞培养3 d出现快速生长,在第9天后进入平台期;牙周膜干细胞在培养4 d后开始快速生长,在第8天就进入平台期。2组在3~12 d时,牙髓干细胞细胞增殖A值显著高于牙周膜干细胞。提示牙髓干细胞的增殖速度要快于牙周膜细胞,并且增殖时间更长。通常认为消化酶法获得的牙髓干细胞具有更高的细胞增值率,成骨分化能力,成牙本质分化能力,但组织块法获得的牙髓干细胞具有形态更均匀的优势。氧浓度对维持干细胞可塑性、以及增殖能力发挥重要作用。环境氧浓度可损伤间充质干细胞的DNA,导致遗传不稳定型,而低氧浓度有利于维持干细胞的微环境,增加其安全性。一般认为在5%的氧浓度时,牙髓干细胞具有较强的增殖潜能。
3.3 牙髓干细胞与牙周膜干细胞表型 CD34、CD45是造血干细胞表面标志物,本研究显示,在牙髓干细胞与牙周膜干细胞中,两者均呈低表达。CD29属于黏附因子表型,在干细胞高表达。STRO-1是一种IgM单克隆抗体,主要存在于骨髓,是骨髓间充质干细胞的特异性表面标志。本研究中,人牙周膜干细胞与人牙髓干细胞均呈高表达。CD44、CD73、CD90、CD105、CD146、CD166是干细胞具有典型性的标志物,其中CD44是间充质细胞未分化细胞标志。CD73表达于间充质干细胞,可促进干细胞增殖,抑制干细胞衰老,CD90可促进干细胞快速增殖。表达与滑膜间充质干细胞的CD105可促使其分化为成软骨的能力。本研究中,人牙周膜干细胞与人牙髓干细胞均呈高表达,提示两种细胞均具有干细胞特征。牙髓干细胞表达多种干细胞标志物,也证实其多相分化的可能性。延髓干细胞在体外培养,可矿化为矿化结节,其还可以分化为脂肪细胞。有研究显示,牙髓干细胞在mRNA水平与蛋白水平表达神经前提细胞标志以及胶原细胞标志,其还能产生多种神经营养因子,提示其具有分化为神经细胞的潜能[23]。
综上所述,牙髓干细胞增殖速度较牙周膜细胞增殖更快,在牙髓组织修复、牙齿组织工程中具有广阔的应用前景。
