IVIM定量分析在不同分子分型乳腺癌鉴别诊断中的效果分析
2020-03-11陈向荣许淑惠林钱森余梅英
汪 林,陈向荣,许淑惠,连 涛,林钱森,余梅英
(福建医科大学附属泉州第一医院 影像科,福建 泉州 362000)
乳腺癌是一种高度异质性的恶性肿瘤,临床上多根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体-2(human epidermal growthfactor receptor 2,HER-2)及细胞增殖抗原标记物Ki-67 (antigen identified by monoclonal antibody Ki-67,Ki-67)4种免疫组化指标的表达情况来制定内分泌治疗方案和判断预后[1]。上述免疫组化指标均需要取患者肿块组织活检,调查显示[2],进行乳腺肿块的活检操作在一定程度上会导致患者焦虑和痛苦,有必要采用一种非侵入性方式来区分各种肿瘤亚型。磁共振因其具有软组织分辨率高、多序列及多参数成像,且无辐射的优点,已成为一种有效的评估乳腺癌的非侵入性手段。既往研究证明,扩散加权成像(DWI)能够有效反映肿瘤细胞和组织中的血流灌注情况[3],在侵袭性肿瘤中,肿瘤细胞数量的增加导致细胞外空间减少,水分子运动受限,体现为表观扩散系数(ADC)降低[4]。临床实践表明[5,6],传统的单指数DWI模型获得的标准ADC值受到组织内水分子扩散和微循环灌注两种成分的影响,无法很好地反映肿瘤组织中的水分子运动情况。国外有学者针对这一难题提出了体素内不相干运动(intravoxel incoherent motion,IVIM)模型,该模型最初应用于脑成像方面,近年来在肝癌的鉴别诊断中也有较好的应用[7,8]。体素内不相干运动扩散加权成像(intravoxel incoherent motion diffusion-weighted imaging,IVIM-DWI)将弥散效应和灌注效应区分开,可更为准确地评价肿瘤组织的扩散运动及微循环灌注情况。目前,国内外关于IVIM-DWI与乳腺癌的研究多局限在区分恶性和良性病变中[9],很少有研究报道IVIM参数在乳腺癌不同亚型的肿瘤中的差异,为弥补这一空白,帮助临床医生通过非侵入性方式确定临床有用的标志物,进行本研究。
1 资料与方法
1.1 一般资料
收集2016年7月~2019年3月在我院住院治疗的乳腺肿块153例患者临床资料,所有患者均经穿刺活检或术后取病理确诊,其中,乳腺癌121例、良性乳腺肿块32例(乳腺纤维瘤18例、乳腺腺肌病9例、乳头状瘤5例)。所有患者均行乳腺MRI检查,获得完整的MRI资料;患者在MRI检查前3个月内,未行乳腺穿刺活检或手术等乳腺有创治疗;乳腺癌患者MRI检测前3个月未行任何形式的放化疗措施;所有患者均为女性,乳腺肿块位于单侧乳房,肿瘤单发,临床资料完整。乳腺癌患者经检查检验符合《中国抗癌协会乳腺癌诊治指南与规范(2015版)》[10]中乳腺癌的诊断,并经免疫组化检查确定分子分型。排除转移性肿瘤、乳腺弥漫性病变患者、乳腺肿块伴液化坏死或粗大钙化者。
收集患者年龄、体质量指数(BMI)、绝经情况、孕次等资料,根据免疫组化的不同结果将患者分为Luminal-A组(22例)、Luminal-B组(51例)、HER2组(23例)、三阴性组(25例)、良性肿块组(32例),5组患者的一般资料不存在统计学差异(P>0.05),见表1。
1.2 方法
1.2.1乳腺癌分子分型检测
根据《原发性乳腺癌规范化诊疗指南(试行)》的相关要求和规范[11],将肿瘤组织行免疫组化检查进行分子分型。
(1) ER及PR的判读。采用免疫组化法检测:病理切片染色后统计细胞核被染成棕黄色的癌细胞,评估整张切片中阳性染色的肿瘤细胞占肿瘤细胞的比例,当视野内被染色的肿瘤细胞核≥1%,即为ER/PR的阳性[12]。估算阳性肿瘤细胞的百分比:对整张切片进行观察,分析阳性染色细胞占所有肿瘤细胞的百分比,根据阳性染色强度来分弱、中、强。
(2) HER-2的IHC的判读。参照《乳腺癌HER-2检测指南(2014版)》[13],0+:无染色或≤10%的浸润癌细胞膜呈现不完整的、微弱的染色;1+:>10%的浸润癌细胞呈现细胞膜不完整的、微弱的染色;2+:>10%的浸润癌细胞膜呈现弱至中等强度和/或不完整的染色,或≤10%的浸润癌细胞膜呈现强而完整的染色,对于这种不确定再经荧光原位杂交技术(fluorescence in situ hybridization,FISH)进一步检测;3+:>10%的浸润癌细胞膜呈现强、完整、均匀的染色。其中3+、部分FISH检测2+有扩增的为阳性,0+、1+视为阴性。
(3) Ki-67的判读。Ki-67定位在细胞核上,随机选取3个或3个以上浸润性癌高倍视野计数,阳性率判读参照马海明等[14]的标准:阳性细胞数<5%为(-),5%~25%为(+),26%~50%为(++),>50%为(+++),以(-)和(+)为低表达组,(++)和(+++)为高表达组进行分析。
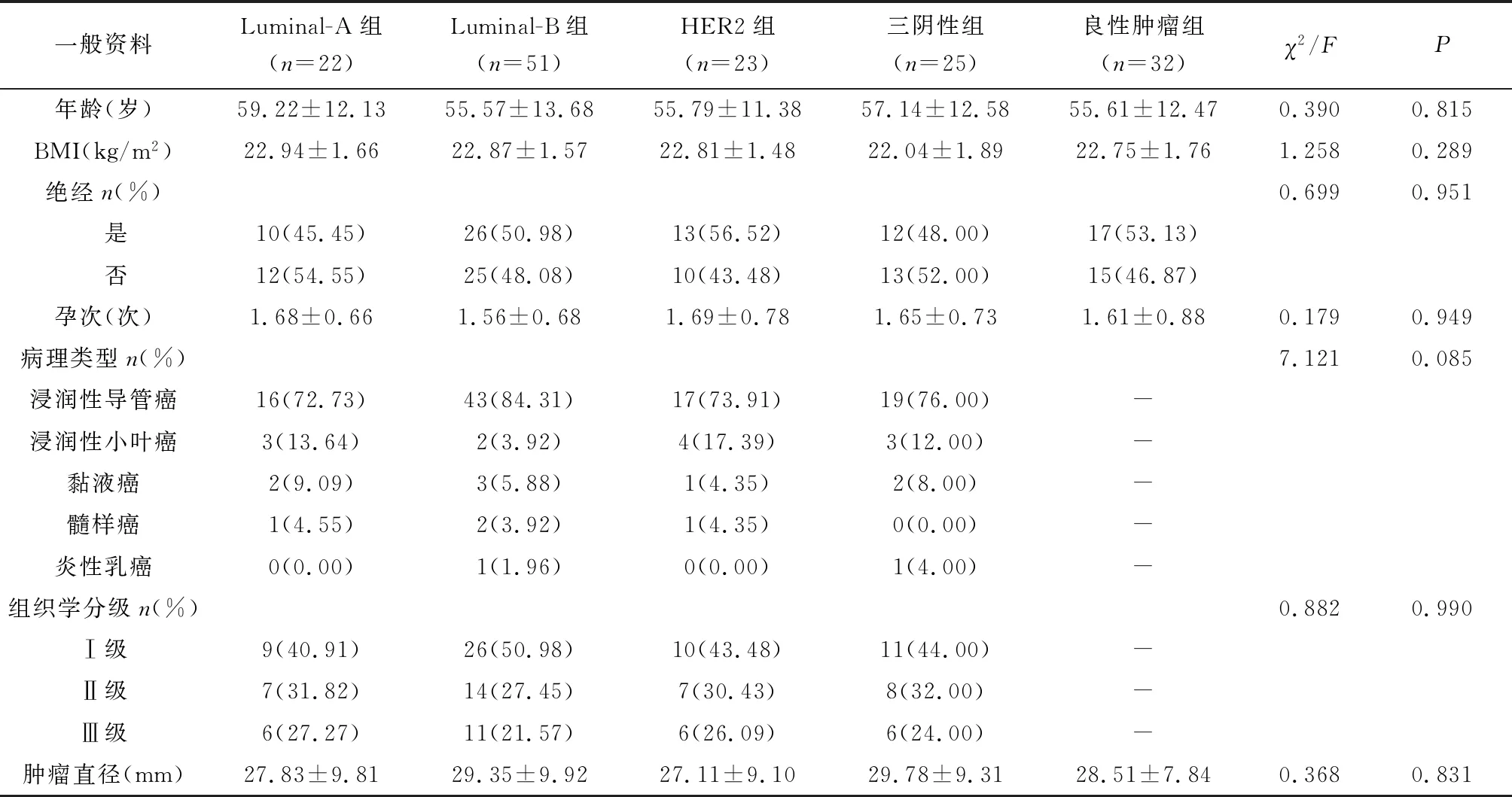
表1 5组患者一般资料比较
(4) 分组。Luminal-A组:多为高分化肿瘤,占所有乳腺癌的40%~50%,ER和/或PR阳性,HER-2阴性,Ki-67<14%。Luminal-B组:多为低分化肿瘤,根据是否表达HER-2分成两类,Luminal B-HER2(+)亚型:ER和/或PR阳性,HER-2阳性,Ki-67≥14%;Luminal B-HER2(-)亚型:ER和/或PR阳性,HER-2阴性,Ki-67≥14%。HER2过表达组:多为低分化肿瘤,HER-2阳性。三阴性组:多为低分化肿瘤,ER、PR及HER-2均为阴性。
1.2.2MRI检查
(1) 采用GE 3.0 T超导型磁共振扫描仪和乳腺专用相控线圈。患者取俯卧位,双乳腺自然下垂于相控线圈内,扫描序列:常规三维定位及校正扫描,轴面T2WI-SPAIR序列扫描:TR 4600 ms,TE 98 ms,层厚5.5 mm,间隔1 mm,矩阵320×256,FOV 32 cm×32 cm,激励次数3,层数24。IVIM序列扫描:b值取0、10、20、50、100、200、500和800 s/mm2,TR 4000 ms,TE67 ms,层厚5.5 mm,间隔1 mm,矩阵96×130,FOV 32 cm×32 cm,激励次数3,层数24。动态增强扫描:采用LAVA成像技术,首先进行预扫描,满意后注射对比剂(GD-DTPA),剂量0.1~0.2 mmol/kg,速率2 mL/s,完毕后以同样速率注射生理盐水20 mL冲管,注药同时进行动态增强扫描,横轴面扫描,TR4.1 ms,TE 2.1 ms,层厚1 mm,间隔0 mm,矩阵320 ×320,FOV 32 cm×32 cm,激励次数1,层数150,高压注射器开始注药后立即进行扫描,连续扫描5期。
(2) MRI图像分析处理。由2名主治医师职称以上的放射科医生对图像进行独立评估,采用单指数DWI值模型测量ADC值,利用双指数IVIM模型对多b值进行后期处理,采用GE后处理工作站相关软件(DWI-tool)获得IVIM各参数值:单纯扩散系数(D)、灌注相关扩散系数(D*)、微血管内容量分数(f)。将原始图像导入DWI-tool软件,选取病灶最大层面,手动绘制感兴趣区(region of interest,ROI),要求包括病变实变部分,为了避免容积效应,面积略小于病灶,避开囊变、坏死区及病变周围正常组织。连续测量3次取其平均值。
1.3 统计学处理
所有数据均采用SPSS 20.0软件进行数据分析,首先对样本量进行正态分布检验(S-W检验),符合正态分布的计量资料采用(均数±标准差)表示,组间两样本比较采用t检验,多组间比较采用单因素方差分析;计数资料采用(例/百分比)表示,组间比较采用卡方检验;绘制受试者工作曲线(ROC)评价不同MRI参数在预测乳腺肿瘤良恶性中的诊断效能,并计算AUC及其95%置信区间,利用约登指数寻找最佳截点。P<0.05认为差异有统计学意义。
2 结果
2.1 良恶性乳腺肿瘤中的MRI参数比较
乳腺癌中的ADC、D、D*值低于乳腺良性肿块,f值高于乳腺良性肿块,差异具有统计学意义(P<0.05),见表2。

表2 良恶性乳腺肿瘤中的MRI参数比较
2.2 MRI各参数鉴别良恶性乳腺肿瘤的ROC曲线分析
ROC曲线显示,在鉴别良恶性乳腺肿块方面,D值(AUC=0.951,95%CI=0.913~0.990)曲线下面积大于ADC(AUC=0.913,95%CI=0.857~0.969)、D*(AUC=0.855,95%CI=0.768~0.941)和f(AUC=0.934,95%CI=0.896~0.972);4项指标联合预测的曲线下面积(AUC=0.997, 95%CI=0.970~1.000)显著高于4项指标单独预测,其中ADC最佳截点值为1.165×10-3mm2/s, D最佳截点值为1.210×10-3mm2/s,D*最佳截点值为49.880×10-3mm2/s,f最佳截点值为25.96%,此时联合预测在评估乳腺肿块良恶性方面的敏感性为99.17%,特异性为96.87%,见图1,表3.

图1 MRI各参数鉴别良恶性乳腺肿瘤的ROC曲线

表3 MRI鉴别良恶性乳腺肿块的AUC及诊断效能
2.3 乳腺癌不同分子分型的MRI各参数比较
雌激素受体(ER)和孕激素受体(PR)阴性组肿瘤组织中的D值低于阳性组,D*值高于阳性组,差异具有统计学意义(P<0.05);Ki67<14%组,肿瘤组织中的ADC值、D值高于Ki67≥14%组,D*值低于Ki67≥14%组,差异具有统计学意义(P<0.05);HER-2阳性组肿瘤组织中的f值高于HER-2阴性组(P<0.05),见表4。

表4 不同分子分型乳腺肿块的MRI各参数比较(n=121)
2.4 乳腺癌不同分型的MRI各参数比较
不同分型乳腺癌之间ADC值、D值、D*值、f值均存在差异,其中三阴性乳腺癌组呈现较低的ADC值、D值、D*和较高的f值(P<0.05),见表5。

表5 乳腺癌不同分型的MRI各参数比较
a. 与三阴性组比较,P<0.05; b. 与HER-2组比较,P<0.05; c. 与Luminal-B组比较,P<0.05
3 讨论
乳腺癌作为女性常见的恶性肿瘤之一,其发生发
展与多种细胞分子相关,其中,最为重要的是ER、PR、Ki-67、HER-2指标,早期鉴别不同分子亚型对于内分泌治疗和评估预后具有重要意义。Jordan等的研究表明[15],ER、PR阳性患者对激素治疗反应性好,通过内分泌治疗能够显著改善患者预后。孙瑞红等[16]的研究显示,ER、PR阳性的乳腺癌一般分化较好,进展缓慢,术后复发率低,5年生存率高。HER-2高表达的乳腺癌由于细胞整合素和黏合素功能异常,侵袭力强,早期易发生转移,预后较差。而与细胞增殖周期相关的细胞增殖抗原标志物Ki-67能够参与DNA合成的蛋白质,临床上常用Ki-67阳性指数来预测肿瘤细胞增殖活性,评估乳腺癌预后。磁共振成像作为一项软组织分辨率高、多序列成像和无辐射的非创伤性操作手段,能够有效评价乳腺肿瘤组织中的血流灌注信息,在鉴别乳腺良恶性病变中具有重要价值。然而,临床实践表明[17],表观扩散系数(ADC)无法很好地消除微循环灌注效应的影响,在辅助辨别不同分子亚型乳腺癌方面受到较大限制。IVIM扩散加权成像技术能够定量评价单纯扩散和微循环灌注两种信息,可以更准确地反映体内水分子扩散特征,其各参数值对应同一肿瘤病变的诊断阈值和诊断效能也不尽相同,因而给医生提供了一种无创鉴别不同分子亚型乳腺癌的新思路。目前,IVIM参数在腹部器官特别是鉴别肝脏肿瘤良恶性中应用较多,也有在动物乳腺肿瘤中的报道[18],但较少研究人体乳腺癌不同分子亚型之间IVIM参数的差异。通过IVIM参数反映肿瘤细胞中血管生成的空间异质性,对于区分乳腺肿瘤良恶性和区分乳腺癌分子亚型具有重要意义。
本研究结果显示,乳腺癌组的ADC、D、D*值低于良性肿块组,f值高于良性肿块组,说明乳腺癌表现出了高细胞性(低扩散性)和高血管生成性(高灌注),IVIM参数中的纯扩散系数(D)避免了微循环血流的影响,进而精确量化肿瘤细胞特性,而ADC值和D值之间存在的差异也反映出微循环确实能够在一定程度上影响ADC值,干扰临床诊断。良性肿块组的ADC值更好,与先前的研究结果相一致[19]。乳腺癌的D*值降低可能是与细胞增殖加快导致血流减少有关。f值被认为与平均血流速度和毛细血管数量有关,乳腺癌中f值增高说明在肿瘤组织中具有较高的血管密度,血流灌注较高。ROC曲线分析显示,ADC、D、f值在鉴别乳腺癌和良性乳腺病变中具有较高的应用价值,特别是D值,其评估乳腺良恶性肿块的敏感性和特异性最高,虽然与ADC、f值之间无明显差异,但是也给临床提供了一种更好的手段。
国外关于ER、PR表达与ADC值之间相关性的报道较多,但目前仍无统一定论。Krontiras等[20]研究发现,ER阳性患者乳腺癌ADC值更低;ER、PR阳性的ADC值低于ER、PR阴性的乳腺癌患者,但也有研究得出两者ADC值无差异的结论[21]。笔者分析认为,传统的单指数模型ADC值一定程度上能够从分子层面评价乳腺癌的病理生理状态,但是生物活体内除了组织水分子扩散之外,微循环内的血液也像水分子一样在做无规律运动,扩散加权成像同时受到水分子扩散和微循环血液灌注的影响。Kitajima等[22]报道,乳腺癌的肿瘤血管生成会有不同程度的增加,灌注效应会导致恶性病灶ADC值显著升高,即微循环灌注和组织细胞构成从完全相反的方向影响ADC值,所以这种灌注效应是不能被忽视的。在81%的乳腺癌IVIM模型中,微循环灌注效应比例大于4%,纯扩散系数D剔除了微循环灌注因素的影响,更为真实地反映出水分子的扩散情况,直接反映了组织的细胞密度,提高了诊断敏感性。PR通过调节细胞的血管内皮生长因子来促进肿瘤组织内的血管生成,ER、PR与ADC值的相关性可能是通过影响血管生成而实现的。HER2是乳腺癌的预后因子,是乳腺癌生长和转移的重要指标,通过抑制细胞凋亡,促进增殖,增加肿瘤的侵袭性,促进肿瘤血管生成和淋巴管生成[23]。本研究表明,与HER2阴性肿瘤相比,HER2阳性肿瘤显示出D*值的增加部分,这表明HER2阳性肿瘤比HER2阴性肿瘤经历更多的血管生成。Indolfi等[24]研究表明D值与Ki-67表达呈负相关,与本研究结果相一致,表明D值和Ki-67值可用作评估肿瘤细胞的密度和增殖状态。高Ki-67表达水平表明细胞增殖增加可能导致细胞密度增加,ADC值降低,D值和D*可用于评估Ki-67的表达状态。
本研究中,IVIM参数在不同肿瘤亚型之间也存在显著差异,与其他亚型比较,Luminal A组表现出ADC值增加和D*降低。在ER阳性或PR阳性肿瘤的情况下,D和D*值可用于区分Luminal B和Luminal A癌症。三阴性乳腺癌多预后不良,对常规内分泌治疗无反应,生存期较短[25]。与其他亚型相比,三阴性组显示出D*和f值增加,ADC、D值降低,表明这种类型的癌症经历增加的肿瘤血管生成。值得注意的是,与其他乳腺癌亚型相比,三阴性乳腺肿瘤周围组织的D*值增加,表明三阴性乳腺癌是一种高度侵袭性癌症,肿瘤肿瘤周围区域的这些变化可能为临床评估肿瘤侵袭程度提供一些帮助,但需要更大范围的肿瘤周围组织来研究IVIM参数的变化。
综上,我们认为IVIM是一种有价值的磁共振技术,可用于鉴别良恶性乳腺肿块,区分乳腺癌分子亚型。通过IVIM参数了解乳腺癌特征,为临床提供了一种准确评估乳腺癌的新方法。但本研究存在许多局限性,首先由于ROI选择未覆盖肿瘤、肿瘤边缘和肿瘤周围区域的整个体积,对结果可能产生一定偏倚,此外,受样本量的限制,本文结论尚需大样本进一步证实。
