磁共振扩散加权成像(DWI)评估进展期乳腺癌患者新辅助化疗近期疗效及病理变化的价值研究
2020-03-11邢千超杨岳云王胜林
佟 颖,米 楠,张 荣,邢千超,杨岳云, 王胜林*
(1. 承德医学院附属医院,河北 承德 067000;2. 承德医学院,河北 承德 067000)
乳腺是人体重要器官,但对正常生命活动的影响较小。乳腺原位恶性肿瘤并不致命,但乳腺细胞癌变后失去了正常细胞特性,细胞间松散连接,易脱落,而一旦癌细胞脱落,可随血液或淋巴液游离至全身各个组织,累及其他器官而危及生命[1]。早中期乳腺癌采用根治手术能够有效控制癌症转移,局部进展期乳腺癌则需要通过新辅助化疗控制肿瘤进展后再进行保乳根治手术。但局部进展期乳腺癌肿瘤体积较大,需要及时调整治疗方案,准确、有效评估化疗疗效,才能获得更佳的预后效果,延长患者的生存期[2]。磁共振扩散加权成像(diffusion weighted imaging,DWI)是当前能在活体组织中进行水分子扩散运动检测的唯一方法,对化疗后残留病灶检出的准确率较高。Shen等[3]研究结果显示不同病理分期乳腺癌患者DWI的ADC值差异具有统计学意义,这为DWI评估化疗疗效提供了理论依据。本研究拟探讨DWI检查结果与局部进展期乳腺癌新辅助化疗疗效的相关性,为局部进展期乳腺癌预后判断提供影像学依据。结果报道如下。
1 资料与方法
1.1 一般资料
本组研究对象选择2016年2月~2017年2月于我院进行新辅助化疗治疗的72例进展期乳腺癌患者,根据临床影像学评估化疗疗效,分为有效组与无效组;根据不同病理反应性分级,分为组织学非显著反应(NMHR)组与组织学显著反应(MHR)组。最低年龄42岁,最高65岁,平均(53.44±4.76)岁。纳入标准:所有患者均经行穿刺活检确诊为浸润性导管癌;化疗前经 CT、MRI 等影像学检查无远处转移;均同意接受新辅助化疗4个周期后进行手术治疗;按既定方案完成4个疗程治疗;化疗前后MRI影像学资料完整;单侧乳房患病;单个病灶。排除标准:化疗4个疗程内死亡者;化疗2周期后评估肿瘤明显进展需更换化疗方案者;影像学资料缺失。
1.2 方法
化疗方案:所有患者均采用TEC(表柔比星+环磷酰胺+多西他赛)化疗方案: 表柔比星、环磷酰胺、多西他赛剂量分别为600、60、75 mg/m2,均进行静脉滴注治疗,每个周期用药1 d,同一天给药,每三周为一个周期,连续用药4个周期后进行疗效评价。
磁共振扩散加权成像(DWI):采用Signa Twinspeed 1.5 T MR扫描仪(美国,GE)以及8通道相控阵双侧乳腺线圈。嘱咐患者行俯卧位,乳房自然下垂于乳腺线圈内。扫描序列:(1)平扫:T1WI的TR、TE分别为180.0 ms与2.5 ms; T2WI的TR、TE分别为2000.0 ms与85.0 ms;层厚、层间距分别为4.0、1.0 mm。(2)横轴面DWI:平面回波成像序列,TR、TE分别为5000.0、59.0 ms,b值为0、1000 s/mm2,层厚、层间距分别为4.0、1.0 mm。(3)增强扫描:采用动态增强横轴面脂肪抑制三维T1WI容积成像,TR、TE分别为 6.0、2.6 ms,FOV:320 mm×320 mm,层厚、层间距分别为2.4、1.2 mm。对比剂为二乙烯五胺乙酸钆(Gd-DTPA),以3 mL/s速率经高压注射器静脉团注,剂量:0.1 mmol/kg,注射后再注入生理盐水20 mL。采集注射前1个时相和注射后8个时相,采集时相两两间隔58 s,每时相扫描层数124层。图像上传至AW 4.2工作站(美国,GE),用Function Tool软件进行MR图像分析获取ADC值,根据动态增强图进行肿瘤体积测量。
1.3 疗效判断标准
参照世界卫生组织(WHO)乳腺癌疗效判断标准[4]和影像学检查结果对疗效进行评价。肿瘤缓解程度:完全缓解(CR):原有病灶完全消失4周以上;部分缓解(PR):肿瘤体积缩小>50%,维持4周以上;稳定(SD):肿块病灶的两个最大垂直径乘积之和减少<50%,或增大<25%,无新病灶出现维持4周以上;进展(PD):肿块病灶两最大直径乘积增大>25%,或有新病灶。总缓解率=(CR+PR)÷总数。病理反应性分级:进行穿刺活检,参照Miller-Payne 标准[5],1级:肿瘤细胞密度无明显变化;2级:密度降低<30%;3级:密度降低30%~90%;4级密度降低>90%;5级:肿瘤细胞消失。以1~3级为组织学非显著反应(NMHR),4~5级为组织学显著反应(MHR)。
1.4 统计学分析

2 结果
2.1 化疗疗效及肿瘤体积变化
72例进展期乳腺癌患者经新辅助化疗治疗,有效45例,有效率62.50%,无效27例,无效率37.50%。治疗后有43例MHR,29例NMHR。有效组治疗后肿瘤体积显著小于无效组,MHR组治疗后肿瘤体积显著小于NMHR,差异具有统计学意义(P<0.05),详见表1和表2。进展期乳腺癌患者经新辅助化疗治疗前后的典型DWI图像见图1。
2.2 治疗前后ADC值比较
有效组与无效组、NMHR组与MHR组治疗前ADC值差异无统计学意义(P>0.05),治疗后均显著升高,但有效组显著高于无效组,MHR组显著高于NMHR组,差异具有统计学意义(P<0.05),组间ADC值增加值比较差异具有统计学意义(P<0.05),详见表3和表4。
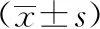
表1 有效组与无效组治疗前后肿瘤体积比较
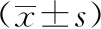
表2 MHR组与NMHR组治疗前后肿瘤体积比较
2.3 肿瘤体积与ADC值的相关性分析
肿瘤体积与ADC值呈负相关(r=-0.325,P=0.032),瘤体积减少值与ADC增加值呈正相关(r=0.357,P=0.028)。
3 讨论
目前乳腺癌已成为危害女性生命健康的主要恶性肿瘤之一。2015年全国女性恶性肿瘤登记患者乳腺癌发病率位居第1位,全国发病率为42.55/10万,城市高于农村[6]。早、中期乳腺癌采用根治手术能有效控制癌症症状,而对于局部进展期患者,术前采用化疗治疗能控制原发病灶,又对微小转移灶的生长具有抑制作用[7]。20世纪70年代,美国研究者就首先对局部进展期乳腺癌进行手术前化疗,并获得良好效果,其目的在于降低肿瘤分期,尽可能保证保乳手术疗效[8]。而新辅助化疗的疗效评价对肿瘤对药物敏感性的判断以及手术计划的制定具有重要意义,但触诊、超声、钼靶等对微小残存病变与纤维化的检出有一定局限,进行病理学评价则存在时间的滞后性。有研究证实磁共振成像操作简便、无创,在新辅助化疗疗效的评估上更具优势[9]。

图1 进展期乳腺癌患者经新辅助化疗治疗前后的典型DWI图像a、b: 某患者治疗前肿瘤体积约23 cm2,ADC值约0.98×103 mm2/s;c、d:同一患者治疗后肿瘤体积约12 cm2,ADC值约1.25×103 mm2/s
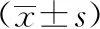
表3 有效组与无效组治疗前后ADC值比较
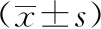
表4 MHR组与NMHR组治疗前后ADC值比较
随着影像学技术的进步,MRI诊断乳腺癌的特异性与敏感性均不断提高,逐渐运用于新辅助化疗的疗效评价[10]。DWI是MRI的功能成像,能够观察活体内水分子微观运动影像,ADC值能够对微环境水分子的扩散值进行准确量化[11]。有研究显示肿瘤病灶内癌细胞密度与水分子扩散受限程度呈正相关,化疗药物对肿瘤细胞膜具有破坏作用,促进肿瘤组织受损后水分子扩散[12,13]。研究表明DWI对肿瘤细胞活性改变的监测是最敏感的影像学工具,薛彩霞等[14]认为化疗后病灶早期ADC值便发生明显变化,甚至早于肿瘤形态学的变化。本研究结果显示72例进展期乳腺癌患者经新辅助化疗治疗有效率62.50%,与Debled等[15]报道进展期乳腺癌表柔比星+环磷酰胺的有效率34.43%~72.23%结果基本一致,治疗后43例MHR,表明肿瘤细胞密度逐渐降低,直接反映出化疗药物对肿瘤细胞的毒性作用。治疗后有效组ADC值显著高于无效组,MHR组也显著高于NMHR组,差异具有统计学意义(P<0.05),同时肿瘤体积与ADC值呈负相关(r=-0.325,P=0.032),瘤体积减少值与ADC增加值呈正相关(r=0.357,P=0.028),表明瘤体体积增加时ADC值降低,而经辅助化疗后瘤体体积显著下降,此时ADC值明显升高,提示DWI 的ADC值变化可用于局部进展期乳腺癌新辅助化疗疗效的评价。
综上所述,ADC值变化与进展期乳腺癌患者肿瘤体积变化具有显著相关性,可用于新辅助化疗近期疗效评估。
