记录神经细胞信号的集成微电极阵列系统设计①
2020-02-14王志功
袁 丰 王志功 徐 跃
(*东南大学信息科学与工程学院射频与光电集成电路研究所 南京 210096) (**南京邮电大学电子与光学工程学院、微电子学院 南京 210023) (***南京邮电大学射频集成与微组装技术国家地方联合工程实验室 南京 210023)
0 引 言
为了深入了解大脑的意识活动,科学家和工程师们多年来一直在努力寻找这些活动的起源和生物学机制。根据解剖学知识,神经细胞的连接和相互间的通讯模式被认为是一个关键因素[1]。在这种研究中,传统光学仪器作用甚微,而电子显微镜功能也有所受限。为更好地了解神经信号的本质,人们探索了如膜片钳和细胞染色等技术。然而,当需要对大量神经细胞进行长期、多目标和无创的检测时,上述技术都力所不及。近些年来,由于互补金属氧化物半导体(complementary metal oxide semiconductor,CMOS)技术的发展,将微电极阵列(micro-electrode array, MEA)与CMOS信号处理集成电路集成在一起的方法,可以实现记录神经细胞之间的信号传输。一些优秀的文献已经介绍了一些具有一定信号时空保真度的神经信号记录系统方案。文献[2]报道了一种植入式神经信号记录前端系统。该系统的MEA为硅基材料,信号处理电路采用了商用微处理器芯片,虽然有不错的电路性能,但也影响了整个模块的集成度,消耗了较多的功耗,且不利于多通道集成。文献[3]则提出了一种CMOS工艺的神经信号放大集成电路模块,该放大电路模块采用流行的斩波技术,有良好的噪声性能。然而由于模块没有集成传感电极,其实用性能不可获知。随着集成MEA和信号处理电路的发展,文献[4]报道了一个完整的体外神经信号记录系统。但是该论文未展示如信号处理电路的增益、共模抑制比(common mode rejection ratio, CMRR)和电源抑制比(power supply rejection ratio, PSRR)等重要电路性能指标。2017年,Abbott等人[5]在《Nature》期刊上报道了其对神经信号记录系统的研究成果。该研究在0.35 μm工艺的芯片上集成了从MEA到信号处理电路的完整系统。但是该系统只适合记录细胞内动作电位,无法记录细胞外动作电位序列,无法用于理解细胞通讯的机制。文献[6]报道了一种集成了MEA的多通道神经信号记录系统,系统具有良好的噪声性能和高密度的电极阵列。但是该系统的功耗较高,且未能展示重要的CMRR和PSRR指标。文献[7]所实现的系统整合了CMOS、MEA和信号处理电路,具有相当好的噪声性能,也有较好的CMRR和PSRR性能。但该系统同时付出了增益较低、功耗较高的代价,整体性能指标不均衡。
本文提出了一种记录神经信号的微电极阵列系统,可用于对活体组织切片或者体外培养的神经细胞进行细胞电信号记录。在该系统中,具有生物相容性的微电极阵列和多通道模拟前端电路集成在同一芯片上。这种全集成的设计有助于提高模拟-数字转换器等后续信号处理模块的信噪比,有利于提高系统的可移植性,使在细胞级尺度上的神经信号记录更具可操作性。本文利用有源低频抑制放大技术,提出了一种系统结构。该系统在较低的电源电压、功率和噪声下,提供了适当的增益、较高的PSRR和CMRR,各项性能有较好的平衡性。本文的组织结构如下:首先对集成微电极阵列设计进行了建模和讨论,为电极的神经信号传感理论提供了重要的结论;然后介绍了多通道神经信号记录系统的系统结构,给出了模拟记录通道的详细电路设计;最后,展示了集成微电极阵列和信号记录通道电路系统的芯片和测试结果,并对论文进行了总结。
1 神经信号记录微电极阵列系统设计
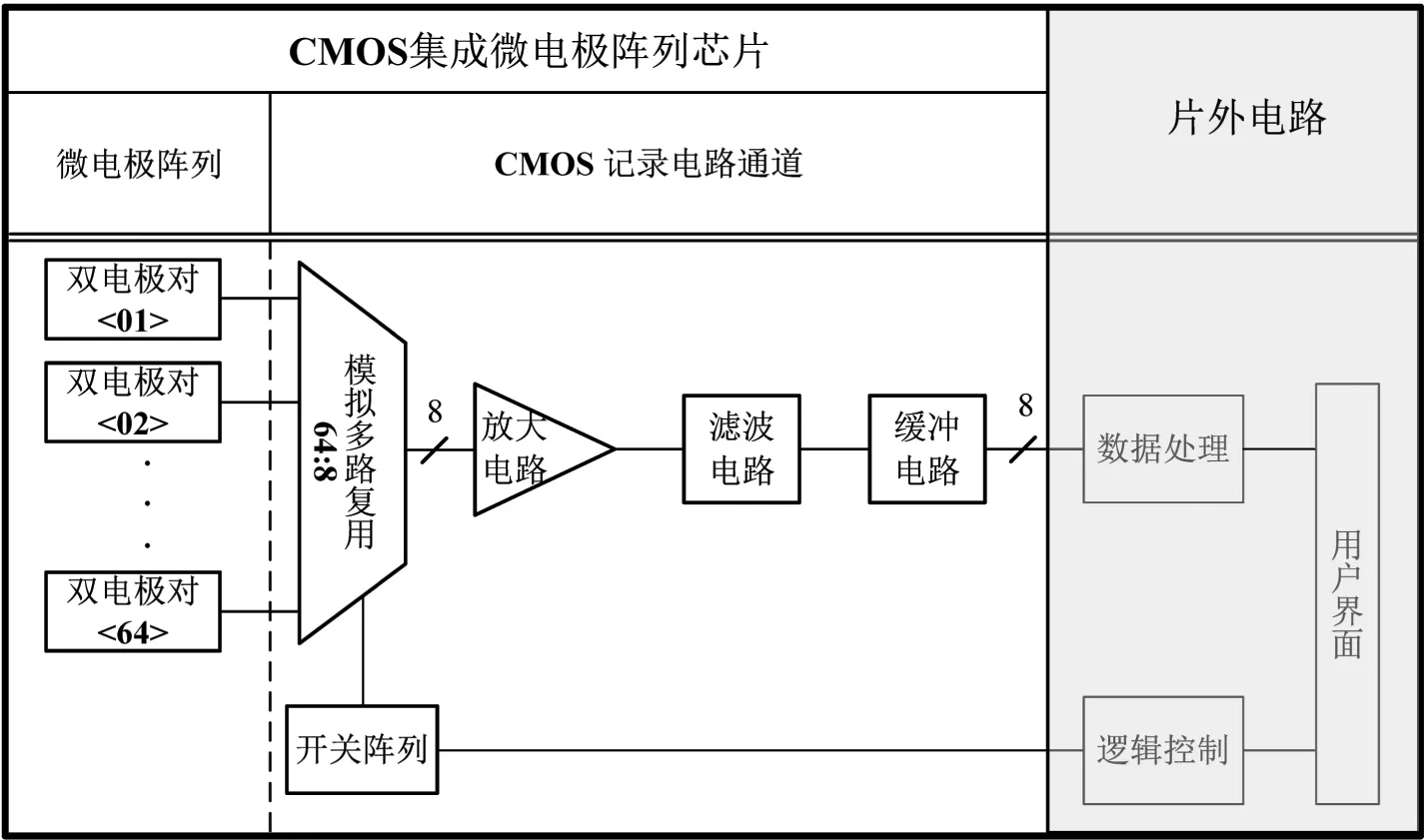
图1 集成微电极阵列系统结构框图
1.1 神经细胞-电极界面模型
传感阵列系统采用双电极结构,包括参考电极和记录电极。在测量过程中,如果神经细胞距离记录电极足够近,当动作电位序列被激发并在轴突上传播时,记录电可感应信号。所记录的信号幅度与记录电极的电特性有关,如:记录电极的形状、尺寸以及神经细胞与记录电极附着的紧密程度等。显然,只有建立了细胞-电极界面模型,才能分析电极特性及其作用,定量评价不同电极的功能。图2所示为神经细胞-电极界面的电学模型[8]。模型中ENa、EK、ECl、gNa、gK、gCl、INa、IK、ICl、INa,pump、IK,pump和Cm分别表示细胞膜上离子通道的等效电动势、等效电导、等效电流和等效电容。此外,Celec和gelec分别表示电极的电容和电导,Rseal和Rs分别表示电极与所附着的细胞之间间隙的中心到周围电解质溶液的电阻,以及记录电极到参考电极的电阻。神经细胞与记录电极间隙的电压用Vclft表示,电极上的电压为Velec(即为放大电路所需要的输入信号),Vref为参考电压。Relec、gelec、Celec分别为记录电极的电阻、电导和电容。参数cov是指记录电极与其上神经细胞的覆盖面积的归一化值。如果记录电极完全被神经细胞所覆盖,则参数cov为1。当神经细胞完全不与电极相关联时,cov为0。此外,记录通道电路的输入电容用Cpar表示,该电容中也包括从输入节点到衬底的寄生电容。
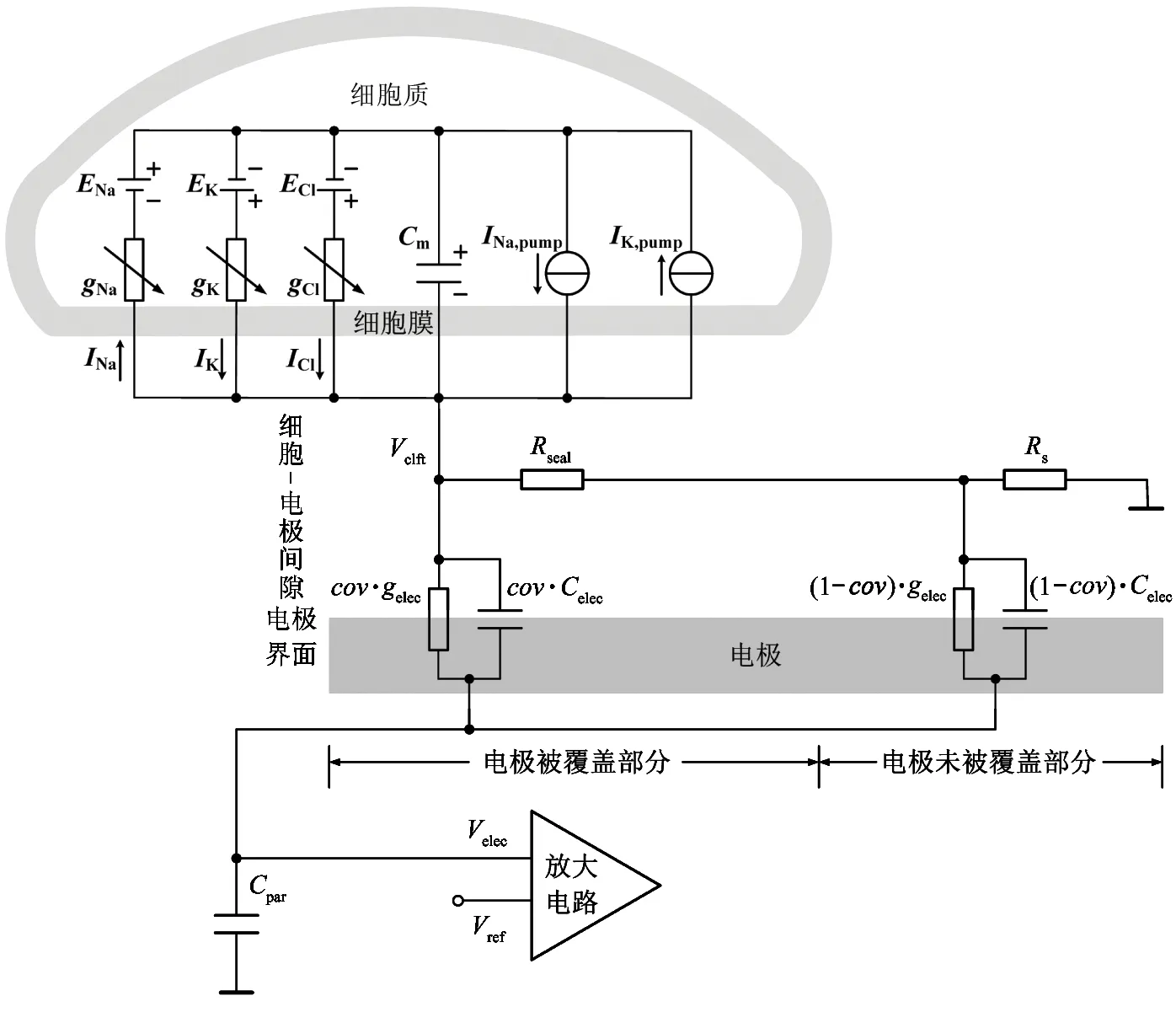
图2 细胞-电极界面等效电路模型
1.2 电极传感特性分析
为了合理设计电极,有必要详细讨论各参数对神经信号记录的影响。根据图2的模型,计算可得电极电压Velec的s域表达式为
(1)
式中,分子、分母多项式的系数为
(2)
其中,Im是细胞膜中钠、钾和钙离子通道的总电流。如果电容Cpar小到可以忽略不计,则式(1)变为
(3)
式中,
(4)
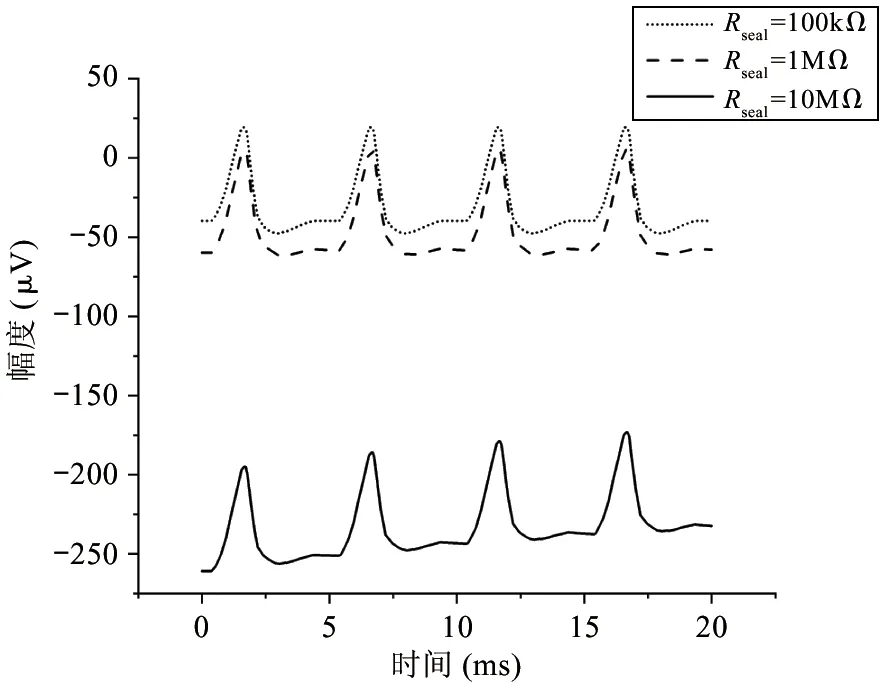
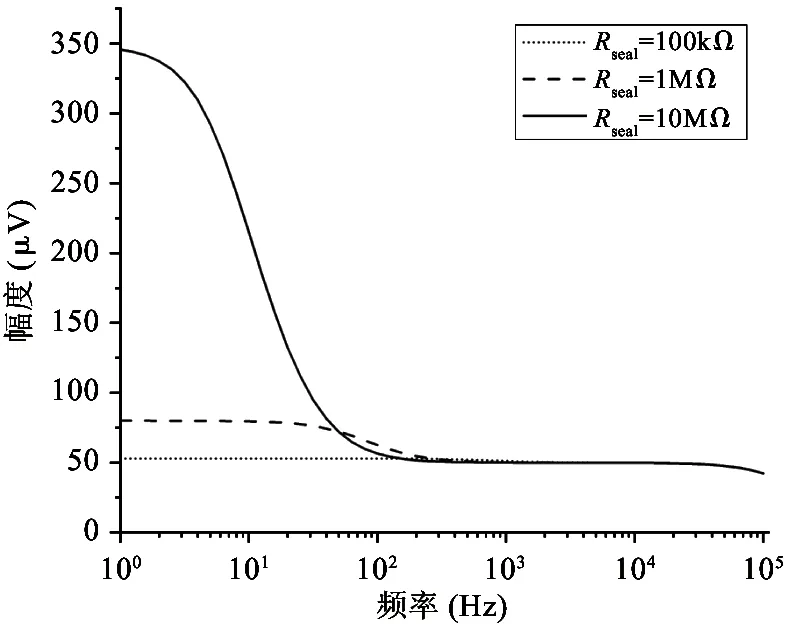
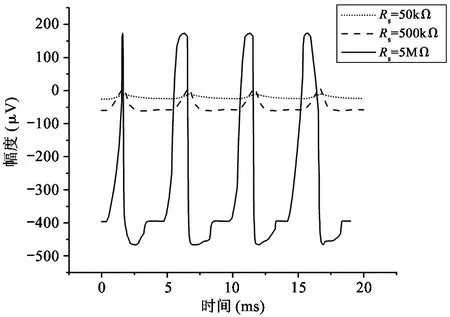
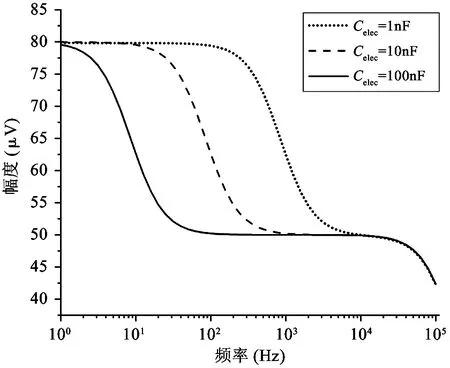
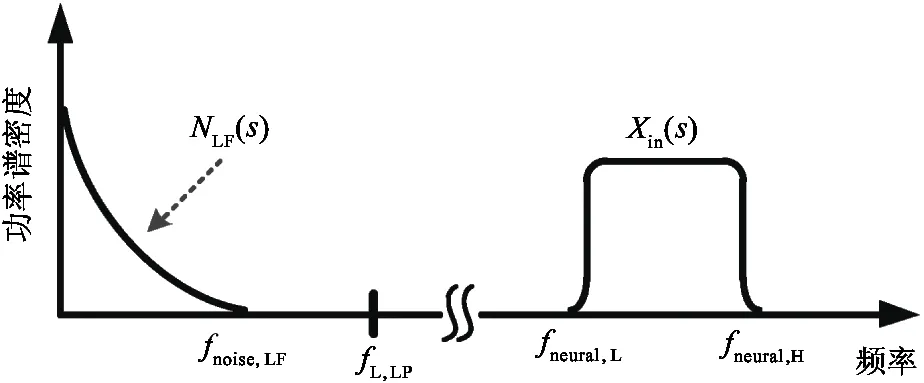
其中,RLF是电极的低频等效电阻,z和p分别为Velec表达式的零点和极点。图3所示为计算所得的模型中记录电极上电压信号的时域和频域曲线(相关参数的默认值设置为Rs=500 kΩ,Rseal=1 MΩ,gelec=2×10-9S,Celec=10 nF,Im=100 pA,cov=0.3,输入信号频率为1 kHz)。由图3可见,当参数发生波动时,图2中模型的特性会发生变化,每个参数在模型的时域和频域分析中都有其自身特有的影响作用。一般来说,记录电极的电压Velec在低频区为Im·RLF,在高频区则稳定保持为Im·Rs。如图3(a)所示,在时域内,Rseal的变化对波形的幅度几乎没有影响。从物理的角度看,Rseal代表了一对神经细胞与记录电极之间贴合的紧密程度,因此与细胞爬片的状况有明显的关系。直流偏移电压随Rseal的变化而产生较大的变化,但如果Rseal可以设定为较低的值,则可以降低上述直流偏移电压。在图3(b)中,输入到记录电路的神经信号按比例放大,与Rseal呈正相关。电极电压Velec的极点随着Rseal的增大移向低频区,而零点则保持不变。事实上,由于高频时大部分离子电流通过记录电极,而在低频时,这些电流则流过Rseal,因此在低频区Rseal具有相当大的影响力,在高频区几乎没有影响。可见,就动作电位而言,其频率在100 Hz~10 kHz的带宽范围内,Rseal值对电极电压Velec几乎没有影响。如图3(c)、(d)所示,记录电极和参考电极之间的电阻,即Rs,在记录系统中起着重要作用。较高的Rs电阻值会使检测电极上产生较高的电压。另一个关键参数是Celec,如图3(e)、(f)所示,在Celec较大的情况下,大部分电流通过记录电极,电压Velec随Celec的减小而增大。反之,Velec随着Celec的增加而减小,因为记录电极的阻抗也同样减小。参数cov对Velec的函数表达式同样有重要的影响。如图3(h)所示,当cov接近1时,Velec函数表达式的零点和极点移到高频区,当cov等于1时,Velec得到最大值,这意味着记录电极被细胞完全覆盖。如图3(g)所示,在不完全覆盖(即cov<1)的情况下,由于2个并联电容(这2个并联电容分别对应于记录电极的未覆盖部分和覆盖部分)的分压,电极电压Velec有所衰减。此外,如图3(h)所示,在低于极点的频域,Velec与参数cov成正比例;而在高于零点的频域,Velec与参数cov无关。
1.3 记录通道电路
1.3.1 低频有源抑制仪表放大结构
◎一旦发生高热惊厥,要冰水敷额、使用退热药物、侧卧位防止呕吐堵塞呼吸道、保持呼吸道畅通,同时立即就医。
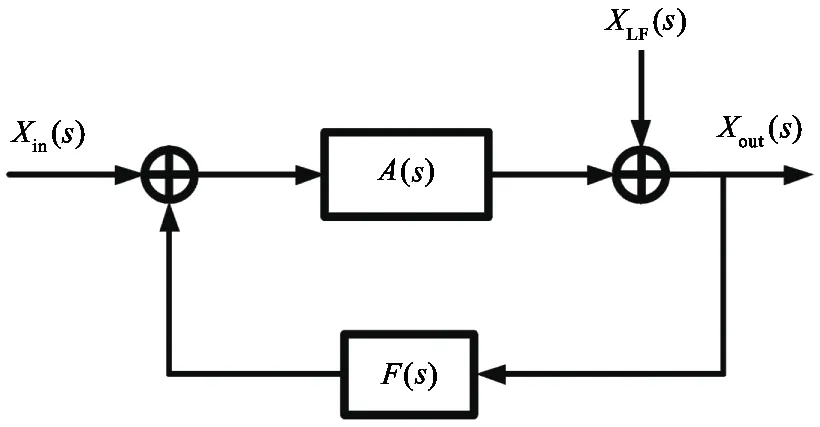
如图2所示,每个记录通道都包含多级结构,其放大器模块如图4所示。A2为常见的轨到轨放大器,被用于作为输入/输出缓冲器,A1为低功耗低噪声跨导运算放大器(operational transconductance amplifier,OTA),其原理图如图5所示。输入缓冲器后面的RC网络是高通滤波电路,用于消除直流偏移。输出缓冲器前的4个OTA中的3个构成仪表放大结构,另外的1个构成反馈回路,提供有源低频抑制(active low-frequency suppression, ALFS)[9,10]。如图6所示,ALFS将仪表放大电路输出的低频分量馈送到输入端,以抵消低频成分,多数情况下为100 Hz以下的噪声或环境干扰信号。利用拉普拉斯变换,由图6分析可得输出:
(a) 参数Rseal的时域分析
(b) 参数Rseal的频域分析
(c) 参数RS的时域分析

(d)参数RS的频域分析

(e) 参数Celec的时域分析
(f) 参数Celec的频域分析
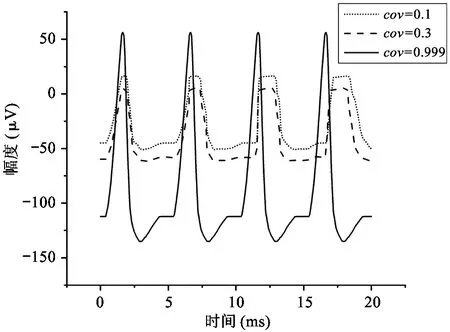
(g) 参数cov的时域分析

(h) 参数cov的频域分析
图3 模型参数时域和频域分析
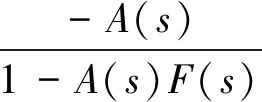
(5)
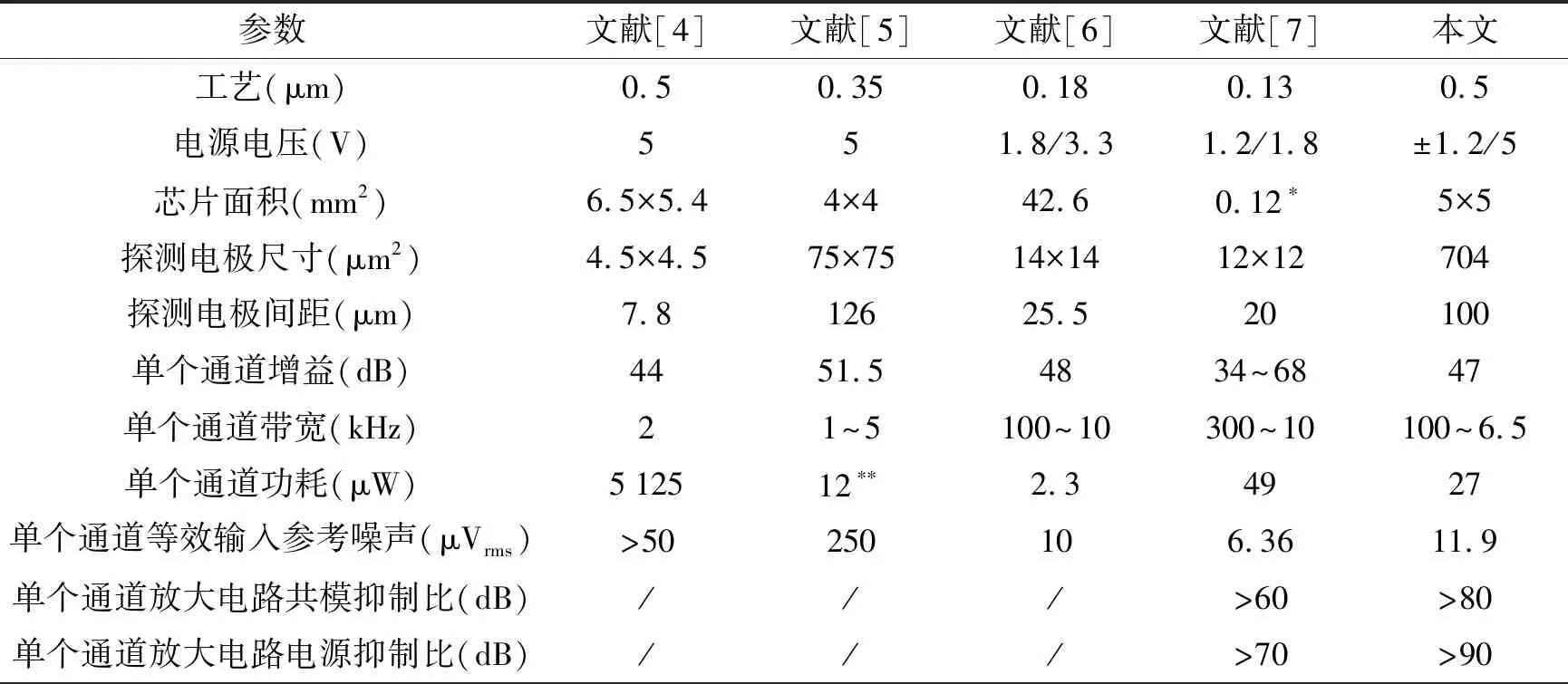
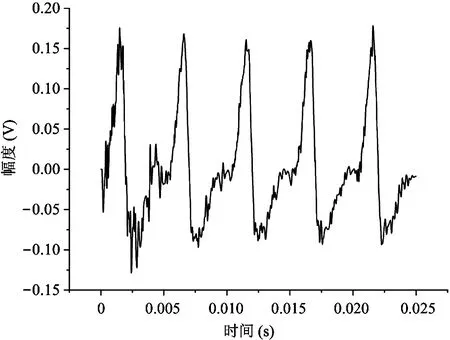
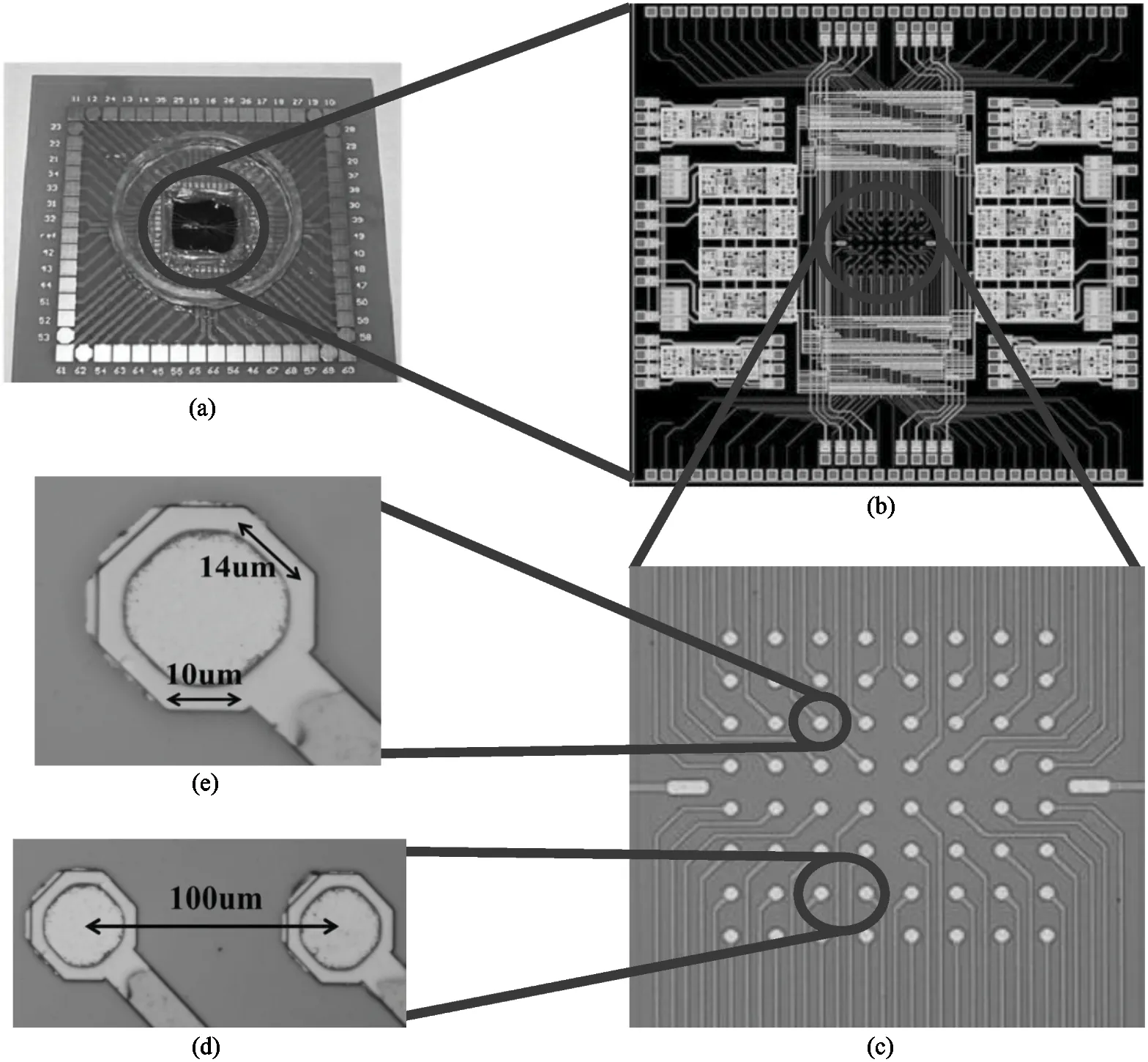
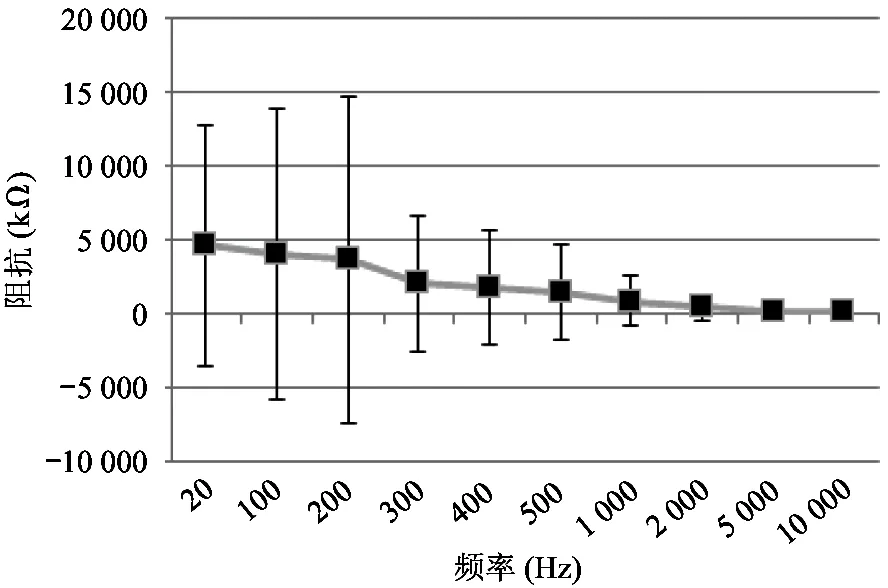
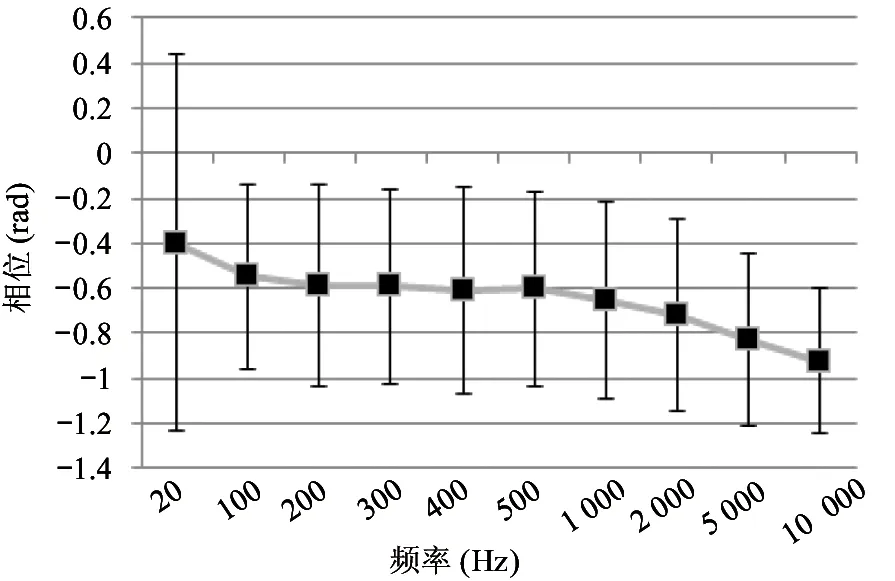
式中,Xin(s)和Xout(s)分别为输入信号和输出信号,NLF(s)为加性噪声。A(s)为仪表放大电路的增益,F(s)为被设计为低通滤波的反馈电路的传输函数,其截止频率设为fL,LP(≈100 Hz),NLF(s)代表低频噪声,其中最重要的成分是闪烁噪声。如图7所示,与输入信号Xin(s)相比,NLF(s)的信号频谱位于低频区。在f (6) 式(6)右边的第1项可以省略,因为记录的神经信号(即动作电位)在低于fL,LP的频域中几乎没有信息。此外,噪声NLF(s)衰减1/A(s)F(s)。在频带fneural, L 图4 放大电路模块结构图 图5 低功耗低噪声OTA Xout(s)≅-A(s)Xin(s)+NLF(s) (7) 式(7)右边的第2项可以省略,因为NLF(s)是频率低于fL,LP的低频噪声,不影响输出信号。此外,输入信号神经信号Xin(s)按预期放大。可见,ALFS对低频噪声有抑制作用,而对神经细胞信号有放大作用。 图6 有源低频抑制信号流图 图7 神经信号和干扰噪声的功率谱密度示意图 1.3.2 低电压低功耗OTA 图5显示了神经放大器中使用的OTA的电路原理图。电路由2级组成:第1级为低功耗负电阻增益增强结构组成的AB类输入级[11],第2级是常见的带电流镜负载的共源增益级。该OTA的直流总增益为 (8) 式中,匹配的输入管M1和M2跨导为gm1=gm2=gm1,2;此外,gm3=gm4= …=gm8,gm9=gm10。源漏沟道电导gds1=gds2=gds1,2;此外,gds3=gds4= …=gds8,gds9=gds10。实际上,晶体管M1、M2、M5和M6会构成一个正反馈环路,其闭环增益Acl为 (9) 为确保电路的稳定性,该表达式必须保证小于1。显然,该条件只要gm4=gm6即可保证。该OTA的输入等效热噪声为 (10) 式中,k为玻尔兹曼常量,T为温度(单位为K),B为图4中电流镜的比例系数。由上式可见,为了降低噪声,有必要提高输入管的跨导,并且减小电流镜电路中MOS管的跨导。为输入管选择一个较大的宽长比(W/L)1,2,驱动M1,2进入深度弱反型状态,以获得较高的跨导gm1,2。为了使gm3,4和gm9,10远低于gm1,2,可增加M3-8的长度,并减小其宽度,使栅极面积保持相对较大的值。通过调节M3-8使其工作在强反型区,可实现低跨导。在讨论低频信号时,比如神经细胞信号记录,闪烁噪声是一个更加难以处理的问题。由于PMOS晶体管的闪烁噪声通常比同条件下NMOS晶体管低1到2个数量级,因此选择NMOS晶体管作为输入器件比较合适。在工艺确定的情况下,通常选择晶体管的宽度、长度和偏压来控制其工作状态。鉴于偏压与传递函数、信号摆幅、线性度和电流效率等其他重要电路性能之间存在复杂的权衡关系,在恒定偏压下增大栅极面积显得更为实用。通过最大化M1,2和M3-8的栅极面积,可减少闪烁噪声。当然,通过最大化晶体管栅极面积来降低闪烁噪声,存在的主要缺点是栅极电容的增加以及由此产生的稳定性问题。通过增加米勒电容,可以补偿相位裕度,使其保持在45°左右。输入晶体管对M1,2的闪烁噪声可通过从噪声模型[12]推导噪声功率谱密度来估计。 (11) 式中,SId为漏电流的闪烁噪声谱密度,KF为闪烁噪声系数,AF为闪烁噪声指数,EF为闪烁噪声频率指数,Leff为晶体管栅极的有效长度。等效输入栅极电压噪声可由漏电流噪声计算得出: (12) 在弱反型区,漏电流公式可用公式表示为Id≈I0eqVg/n2kT,其中n2是氧化层电容和耗尽区电容之比,考虑到反型层电容Cinv远小于耗尽层电容Cd和Cox之和,则n2可表示为n2=Cox+Cd/Cox。因此: gm≅qIdCox/kT(Cox+Cd) (13) 联立式(11)、(12)和(13),可解得栅极等效输入闪烁噪声为 (14) 系统芯片采用0.5 μm CMOS工艺制作。如图8(a)所示,整个芯片与PCB板粘合,电路区用二甲基硅氧烷(dimethylsiloxane, PDMS)封装,只留MEA区域暴露在外,位于芯片中心。然后,在芯片周围贴附上培养皿,提供一个封闭的容器来容纳神经细胞和培养基。如前所述,微电极阵列经过修饰后,所有电极都镀上金,因而具有良好的生物相容性。记录电极形状为八边形,电极间距为100 μm,如图8(d)、(e)所示。 在设计和实现中,电极尺寸和间隔的选择基于如下考虑:一是考虑到细胞体的直径一般在5~150 μm范围内;二是根据前文对电极的建模分析,电极电压Velec的值随Celec的减小而增大。实验采用Agilent4284A Pricise LCR Meter测量仪测试电极的电气特性,数据如图8所示。很明显,被测电极呈容性阻抗,且具有兆欧级阻抗值。芯片上集成有8个信号记录通道。图9显示了以预设的动作电位序列作为输入源,所记录的瞬态输出信号。图10为输出动作电位序列。表1总结了系统的相关性能,并进行了比较。 图8 集成CMOS信号记录电路的微电极阵列芯片系统 (a) 电极阻抗的平均模值 (b) 电极阻抗的平均相位 图9 阻抗测试曲线 本文提出了一种集成了CMOS微电极阵列和信号处理电路芯片的神经细胞信号记录系统。在所建立的电极-神经细胞界面模型基础上,对其进行了分析,为设计优化电极、提高记录系统的信噪比提供了依据。同时,设计实现了低功耗、低噪声、高PSRR和CMRR的跨导运算放大电路,并构成低频有源抑制仪表放大结构。该结构不仅消除了直流偏移和其他低频噪声,还避免了耦合电容器的面积消耗过大的问题。在模型理论分析指导下设计的微电极阵列和所提出的信号处理电路所构成的系统,具有较好的综合性能,各项指标平衡,具备在体外环境下捕捉神经细胞生理活动信号的能力。 表1 系统性能总结及对比 注:*单通道面积0.12 mm2;**单个单元功耗 12 μW 图10 输出动作电位序列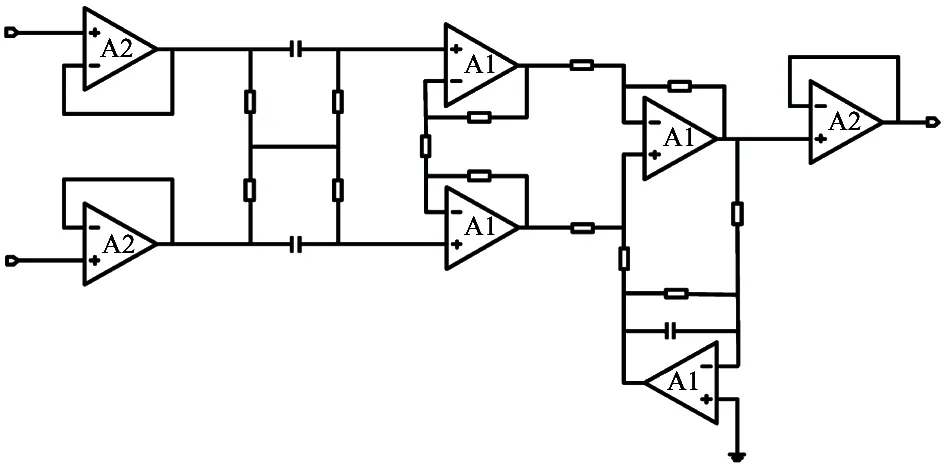

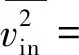
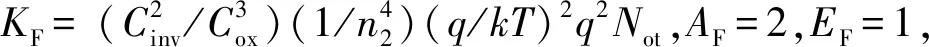
2 实验结果及分析
2.1 集成CMOS信号记录电路的微电极阵列芯片
2.2 数据及分析
3 结 论