免疫印迹法检测TPN15,TPN17,TPN45和TPN47抗体表达在梅毒诊断中的应用评估
2020-01-17王欣俞赵晋文丁晓娜王鑫琪魏殿军张延海高德禄郭奕阳
王欣俞,崔 凯,赵晋文,丁晓娜,王鑫琪,魏殿军,张延海,高德禄,刘 朋,郭奕阳
(1. 河北燕达医院检验科,河北廊坊 066251;2. 河北燕达医学研究院,河北廊坊 066251;3. 河北医科大学第四医院检验科,石家庄 050000)
梅毒是由梅毒螺旋体(treponemia pallidum,TP)感染引起的,累及全身多器官的一种疾病,其传播途径主要是性传播[1]。近年来梅毒的阳性检出率随着人口流动性增加及社会生活方式的改变而呈现不断上升的趋势[2],特别是因为早期梅毒的病变组织,又增加了获得性传播人类免疫缺陷病毒(HIV)感染的风险[3]。其诊断主要根据病史,临床表现和实验室血清学检测。血清学检测梅毒特异性抗体是目前国内外诊断梅毒的主要方法[4],在梅毒诊断方面起到重要作用[5]。血清学检测主要分为两类:第1类为非TP抗原血清试验,常用方法包括快速血浆反应素环状卡片试验(RPR)、性病研究实验室试验(VDRL)、甲苯胺红不加热血清试验(TRUST)等;第2类为TP抗原血清试验,主要有梅毒螺旋体血凝试验(TPHA)、梅毒螺旋体明胶凝集试验(TPPA)、荧光密螺旋体抗体吸附试验、酶联免疫吸附试验(ELISA)、免疫层析法、化学发光法及免疫印迹法等(WB)[6]。在梅毒血清学检测方法中,不同检测方法学反应性结果存在不一致性。梅毒螺旋体抗体免疫印迹试验(treponema pallidum-western blot,TP- WB)采用大量高度纯化的梅毒螺旋体抗原,是目前较为公认的梅毒特异性抗体确证方法[7]。本研究将梅毒血清学检测初筛有反应性的临床患者入组,拟评估免疫印迹法检测TPN15,TPN17,TPN45和TPN47抗体表达在梅毒诊断中的应用,研究结果为提高梅毒血清学诊断准确性提供依据。
1 材料与方法
1.1 研究对象 回顾性纳入河北燕达医院2018年6月~2019年6月28 417例使用化学发光微粒子免疫分析法(CMIA)筛查的梅毒血清样本,选取检测结果cutoff值S/CO比值>15以及S/CO比值1~9患者样本178例为研究对象,其中男性86例,女性92例,平均年龄56.22±19.15岁。分组:A组34例标本,CMIA检测有反应性,TPPA阳性且RPR检测阳性并伴有滴度;B组38例标本,CMIA检测有反应性,cutoff值S/CO比值>15,TPPA阳性,RPR检测阴性;C组106例标本CMIA检测有反应性,cutoff值S/CO比值1~9,TPPA均阳性,RPR检测均阴性。梅毒感染诊断符合《中华人民共和国卫生行业标准-梅毒诊断(WS273-2018)》[8]。
1.2 试剂和仪器 CMIA检测法使用的厂家配套试剂盒及ARCHITECT i2000仪器,购自美国雅培公司; TPPA检测法使用原厂配套试剂,购自日本富士公司的瑞必欧株式会社;TP- WB检测法使用原厂配套试剂盒,购自德国欧蒙公司。
1.3 方法 抽取梅毒筛查对象空腹静脉血5ml,3 000r/min离心10min,血清样本加样,2~8℃保存。CMIA法检测梅毒特异性抗体,仪器测得样本发光值并计算反应物浓度,结果判读标准:S/CO≥1为梅毒螺旋体抗体反应性,S/CO<1为非反应性。RPR法检测非特异性抗体;TPPA法检测梅毒特异性抗体;TP-WB法检测梅毒特异性抗体,该方法将含有TPN47,TmpA, TPN45,TPN17和TPN15抗原的硝酸纤维素膜测试条与30μl血清样品一起温育,然后与辣根过氧化物酶标记的对人IgG特异的二抗孵育。在添加TMB后,免疫复合物在条带上可视化为暗带。通过与截止对照条带的强度比较来评估每个抗原条带的强度。检测膜条置于全自动免疫印迹仪EUROBlotMasterll上检测,通过EUROLineScan软件判读结果,当五个诊断带中至少两条特异性抗原带明确显色,测试被判读为阳性;一条特异性抗原带明确显色,测试被判读为可疑。EUROLineScan软件判读结果标准为着色强度≥24判定为有反应性,仪器判读检测线性为24~255。
1.4 统计学分析 采用MetaboAnalyst 4.0 的Statistical Analysis 模块进行数据的统计分析,具体步骤如下:样本TPN47, TPN45,TPN17和TPN15及S/CO指标值以列的方式分别录入,以逗号间隔的CSV格式文件上传,然后进行数据完整性检查,样本经标准化数据转换及数据正态化后进行相关分析及主成分聚类分析。其中,相关分析采用Pearson r 距离法;数据分类可视化采用主成分分析法(principal component analysis, PCA)。采用Medcalc软件对CMIA 法S/CO做特征曲线(ROC曲线)统计分析,计算曲线下面积,确定 CMIA 法对梅毒诊断效能最大时的 S/CO最佳截断点。不同诊断方法计数资料的比较采用卡方检验,P<0.05 为差异有统计学意义。
2 结果
2.1 TP-WB法、CMIA法及TPPA法试验检测梅毒抗体结果 178例受检者中,TPPA法检测结果梅毒阳性共168 例,阳性检出率为94.4%;TP-WB法检测结果梅毒阳性 78例,阳性率为43.8%,两种检测方法阳性率差异有统计学意义(χ2=104.2,P<0.01),TP-WB法的灵敏度为 68.29%,特异度为90.91%。以TP-WB结果为参照,绘制ROC曲线,见图1。统计结果表明,当 CMIA 法测得的 S/CO 截断值为 6.79时,敏感度为 79.41%,特异度为 96.05%,此时曲线下面积最大为 0.911,即6.79 为 CMIA 法的最佳诊断截断值。

图1 S/CO 比值ROC曲线分析
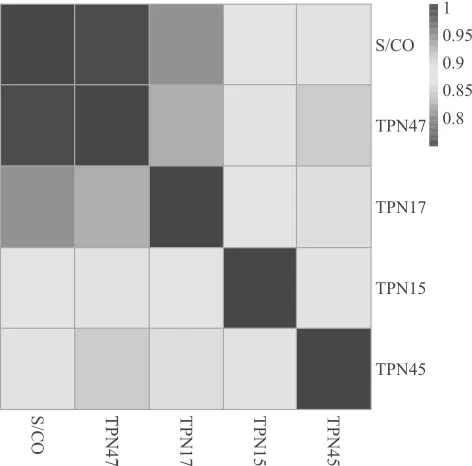
图2 TP-WB法四种抗体着色强度和S/CO比值相关性
2.2 TP-WB检测TPN15,TPN17,TPN45及TPN47抗体表达与CMIA法相关性分析 TP-WB法检测TPN15,TPN17,TPN45及TPN47抗体表达着色强度和CMIA法S/CO比值相关性分析结果见图2。同一样本TPN15,TPN17,TPN45及TPN47抗体表达水平与S/CO比值均呈正相关(P <0.05),四种抗体表达水平与S/CO比值相关系数r分别为0.87,0.81,0.87及0.76。
2.3 TP-WB法着色强度分组的结果分析 按照TP-WB法读取着色强度值将178例样本进行分析, A组34例着色强度50~170,B组38例着色强度24~90,C组106例着色强度24~50,组别及主成分分析聚类结果见表1及图3。当第一主成分为90.6%,第二主成分为3.9%时,将三组分别聚类分开。分组因子贡献分析见图4所示,5个分组因子夹角为锐角,贡献率从高到低依次为TPN15,TPN45,TPN17,TPN47和S/CO比 值。A组,TPN15,TPN17,TPN45和TPN47抗体均反应性且着色强度高数值,显示评价方法和比对方法阳性符合率、总符合率为100%,具有高度一致性。B组,TPN15,TPN17,TPN45和TPN47抗体阳性率均减少,分别为92.1%,65.8%,86.8%和36.8%。TPN17和TPN47抗体阳性率显著降低(P<0.05)。C组,TPN15和TPN17抗体表达为主。TP-WB法检测30例结果反应性(检测出6例结果阳性,24例结果可疑阳性),76例结果阴性。TPPA法复验,检测出96例结果1:80阳性,10例结果阴性(TP-WB确证时,2例结果判定可疑);TPPA与TP-WB法相比,显示阳性符合率29.2%。
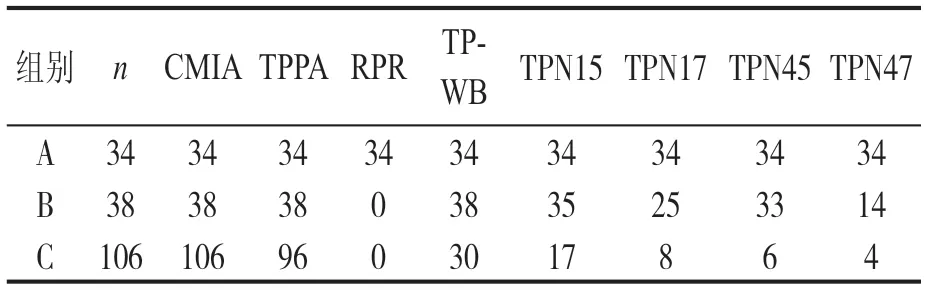
表1 CMIA,TPPA,RPR,TP-WB及其抗体表达检测结果

图3 TP-WB免疫印迹法样本着色强度分组主成分聚类结果
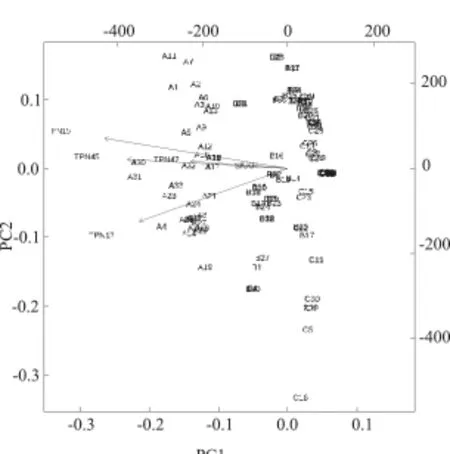
图4 TP-WB免疫印迹法样本着色强度分组因子贡献分析
3 讨论
近年来,梅毒作为严重威胁公共健康的传染性疾病之一[9-10],具有极强的侵袭性,它通过黏附、定植、穿过组织屏障、累及全身各器官[11]。据报道,无症状梅毒的发生率高达64.6%以上[12],尽管梅毒的发现和诊治已有数十年的历史,但是初期梅毒确诊和晚期梅毒治疗仍具有挑战性[13]。TP侵入机体后可诱导产生针对其不同抗原成分的抗体,主要包括抗心磷脂抗体和抗TP特异性抗体,是临床血清学检验诊断是否携带梅毒的基础。TP蛋白是梅毒感染的重要因素,在感染梅毒时,检测患者血清中的TP蛋白对梅毒的诊断具有重要价值[14].TP外膜蛋白是免疫的主要靶点,相关研究已发现9种具有免疫活性的蛋白,即TPN15,TPN17,TPN33,TPN37,TPN39,TPN43,TPN45,TPN47和TPN97,而其中的TPN15,TPN17,TPN45和TPN47抗体表达水平被认为在梅毒的致病与诊断中起重要作用[15]。
TP是迄今为止无法在体外培养的病原微生物,感染后其表面的膜蛋白对宿主的固有免疫系统具有很强的调控作用,因此被认为是 TP重要的毒力因子[16-17]。随着医学分子生物学技术的发展,TP膜蛋白的相关研究报道及应用不断涌现[18]。在蛋白质印迹诊断测试中TPN45脂蛋白(TmpA; tp0768基因产物)和嵌合大肠埃希菌表达TPN15,TPN17,TP44.5和TPN47抗原(Meridian Life Science,Inc.,Memphis,Tennessee USA)作为免疫原性抗原的组合,被证实对获得性梅毒具有高度敏感度和特异度[19]。其中TPN47,TPN17,TPN15以及TmpA脂蛋白具有强大的前炎症活性,与TP引起的梅毒免疫反应密切相关[20]。KUBANOV等[19]报道TPN15和TPN17免疫原性抗原是关键成员,在梅毒感染期间诱导高抗体反应并且不与来自患有其他螺旋体病的患者的血清交叉反应。CHAN等[21]提出TPN17在菌体外膜表面的分布具有随意性的特点。它可能通过激活细胞间黏附分子1(ICAM-1),E-选择素和单核细胞趋化蛋白-1的表达,在蛋白质配体结合,密螺旋体膜结构维持[22]或梅毒发病机制中起作用。另一种强免疫原TPN47,具有较强的免疫原性和反应性,通过刺激微血管内皮细胞合成细胞间黏附分子并诱导血管细胞黏附分子在宿主-病原体相互作用中发挥作用[19,23]。
本项研究中显示活动性梅毒患者中免疫印迹梅毒特异性抗体TPN15,TPN17,TPN45和TPN47抗体均具反应性且EUROLineScan软件判读结果着色强度数值高反应性,与梅毒活动进展呈正相关性;CMIA检测S/CO值>15时,梅毒抗体单阳者中免疫印迹梅毒特异性抗体TPN15,TPN17,TPN45和TPN47阳性率均减少,其中TPN17和TPN47抗体阳性率显著降低(P<0.05);CMIA检测S/CO值在1~9之间反应性结果时,通过免疫印迹检测确认显示阳性及可疑患者中TPN15,TPN17,TPN45和TPN47抗体的表达明显减少且反应曲线着色强度均呈低水平。CMIA,TPPA与WB-Tp之间检测结果不一致,其阳性符合率仅为29.2%,并且临床最终判定结果阳性占20%(6/30),可疑阳性结果占80%(24/30)。
综上所述,基于重组脂蛋白技术的密螺旋体特异度检测显著改善了梅毒的诊断,为临床实验室提供血清学检测确证的依据。本研究结果显示,梅毒患者分期处于不同的阶段时,梅毒特异性抗体TPN15,TPN17,TPN45和TPN47抗体表达存在差异。当梅毒血清初筛检测结果弱反应性以TPPA复核时,TPPA检测结果并不能作为临床确证的诊断,实验室血清学确证方法应首选梅毒免疫印迹法进行确证。
