HDAC2与乙酰化P53k320在胃癌细胞中的表达及对其疗效的评价
2020-01-03
(临沂市中心医院,山东 沂水 276400)
研究证实,肿瘤的发生和发展是多个信号通路和多基因共同参与的结果[1]。其中,细胞组蛋白乙酰化受到组蛋白去乙酰化酶(HDACs)和组蛋白乙酰化转移酶的共同调控,当HDACs呈现为病理活性和异常表达后会引发机体免疫紊乱、肌营养不良以及癌症的发生。有研究表明[2],HDAC2的目标蛋白为抑癌基因P53,其过度表达与恶性肿瘤发生相关,其表达的高低可作为临床上独立的预后指标,也可作为组蛋白去乙酰化酶抑制剂(HDACi)疗效的标志。本研究分析HDAC2、乙酰化P53k320在胃癌组织和癌旁组织细胞中的表达,探讨其对疗效的评价作用。
1 资料与方法
1.1临床资料 选取2018年1月—2019年1月本院收治的胃癌患者130例,其中男86例,女44例;年龄35~75岁,平均(55.5±2.6)岁;肿瘤直径:>5 cm者29例,≤5 cm者101例;Lauren分型:弥漫型35例,肠型82例,混合型13例;分化程度:高分化67例,中分化34例,低分化29例;TNM分期:Ⅰ~Ⅱ期68例,Ⅲ~Ⅳ期62例;淋巴结转移:有59例,无71例。所有患者或家属均签署了知情同意书。所有患者经临床治疗后,完全缓解(CR)65例,部分缓解(PR)26例,稳定(SD)19例,进展(PD)20例。
1.2方法
1.2.1组织采集 取所有患者手术切除的癌组织和癌旁组织,其中50%组织在10%中性甲醛中固定,24 h后行常规石蜡包埋,制作组织切片,厚度为4 μm,用于后续免疫组化染色。另外50%组织作后续细胞分离。
1.2.2免疫组化 将所制备的癌组织和癌旁组织石蜡切片在二甲苯中重复脱蜡10 min,行梯度酒精水化,将蛋白酶修复液加入37℃的恒温冰箱中行孵化处理30 min,去除抗原修复液,将所制备的切片转移至内含3% H2O2的湿盒中,密封(去过氧化物酶封闭液),在37℃的恒温冰箱中行孵化处理10 min,使用PBS清洗。清洗完成后将山羊血清加入,在室温下封闭处理30 min,将封闭液吸除(滤纸),加入一抗,放入至适合后加入二抗,在室温下孵育处理1 h,运用PBS清洗,行DAB显色10 min,采用梯度乙醇进行脱水,采用二甲苯冲洗片3次直到透明,采用中性树脂封片处理,显微镜下观察免疫组化染色情况。每份标本在镜头下随机选择5个视野,所有病理切片均由2位以上经验丰富的医师采用双盲法进行诊断。根据染色程度和染色细胞百分比进行评分:不着色0分,淡黄色1分,黄色2分,棕黄色3分;着色细胞数≤5% 0分,6%~25% 1分,26%~50% 2分,≥51% 3分。阴性(-)得分≤1分,弱阳性(+)得2~3分;中度阳性(++)得4~5分;强阳性(+++)得分≥6分。
1.2.3细胞分离 取备用的癌组织和癌旁组织,去除结缔组织后洗净剪碎,使用0.1%的胰酶、0.025%的Ⅰ型胶原酶在37℃环境下消化30 min,使用滤网滤渣,在4℃环境下500×g离心5 min,弃去上清液;在DMEM-E培养基(5 ml,内含20%人血浆)中孵育5 min,细胞重悬后将20%的Percoll细胞分离液在4℃环境下500×g离心15 min,收集含有细胞的沉淀,经DMEM-E反复洗涤2次,每次均在4℃环境下500×g离心5 min,将所获得的细胞转移至培养瓶中,使用10% FBS、牛脑抽提物(100 g/ml)、谷氨酰胺(2 mmol/L)、青霉素(100 U/ml)、链霉素(100 mg/ml)的DMEM-E培养基中培养48 h,弃去上清液,将未贴壁的细胞洗掉后继续培养,在培养1周后挑选多个形成的集落,混合均匀,转移至新培养瓶中培养。
1.2.4癌细胞中HDAC2 mRNA检测 采用荧光定量RT-PCR检测,取对数生长期的胃癌细胞、癌旁细胞按照制备试剂盒说明书提取胎盘组织中总RNA,之后对RNA纯度、含量进行检测,使用Takara逆转录试剂盒行逆转录处理后获得cDNA,之后使用Primer5.0软件对引物序列进行设计,使用RT-PCR方法检测胃癌细胞中HDAC2 mRNA表达量,采用2-△△Ct方法计算出需要检测的表达量。HDAC2引物序列:上游:5’-TGACATTGTGCTTGCTGTCC-3’,下游:5’-CCCTCAAGTCTCCTGTTCCA-3’;内参基因GAPDH引物序列:上游:5’-AACAGCCTCAAGATCATCAGCAA-3’,下游:5’-GACTGTGGTCATGAGTCCTTCCA-3’。
1.2.5癌细胞中HDAC2及乙酰化P53k320蛋白表达的检测 取对数生长期的胃癌细胞、癌旁细胞,将培养液去除,反复使用PBS冲洗2遍,0.25%胰蛋白酶消化处理后离心,再次使用PBS反复冲洗2遍,将细胞收集至1.5 mL的离心管中,将200μL预冷的RIPA细胞裂解液在冰上采用超声仪对细胞进行超声裂解,2 s/次,共5次,在4℃环境下500×g离心5 min,将上清液转移至新离心管中,蛋白定量分装采用Bradford方法,采用Western blot法检测胃癌细胞、癌旁细胞中HDAC2蛋白及乙酰化P53k320蛋白表达量。
2 结果
2.1HDAC2及乙酰化P53k320中阳性细胞的表达胃癌组织HDAC2阳性表达率高于癌旁组织,乙酰化P53k320阳性率低于癌旁组织。见表1、封二图1。
2.2HDAC2 mRNA HDAC2蛋白及乙酰化P53k320蛋白的表达 胃癌细胞中HDAC2 mRNA、HDAC2蛋白表达量均高于癌旁细胞,乙酰化P53k320蛋白表达量低于癌旁细胞。如表2、封二图2。
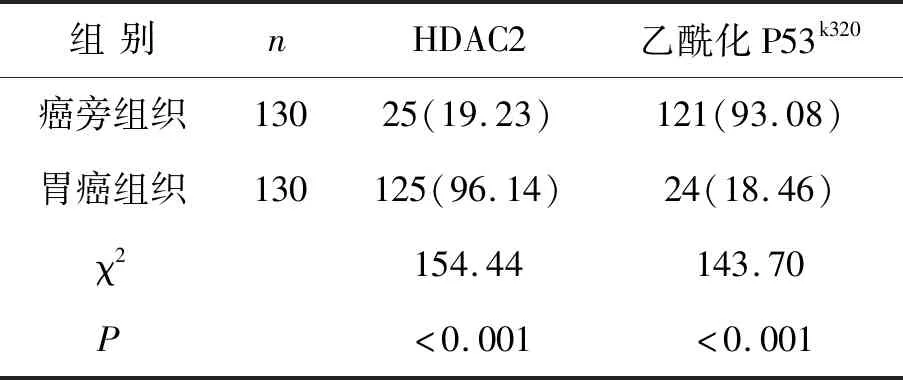
表1 两种组织HDAC2及乙酰化P53k320中阳性表达情况比较[n(%)]

表2 两种细胞中HDAC2 mRNA、HDAC2蛋白及乙酰化P53k320蛋白表达情况
2.3HDAC2及乙酰化P53k320对疗效的评价作用 CR、PR、SD、PD组患者癌组织中HDAC2蛋白表达量呈增高趋势,乙酰化P53k320蛋白表达量呈降低趋势;两两比较显示,各组之间均有统计学意义(q=5.75~54.76,P<0.05)。见表3、封二图3。

表3 HDAC2及乙酰化P53k320蛋白表达与疗效的关系
3 讨论
目前发现抑癌基因P53与人类肿瘤发生关系最为密切。临床推测,胃癌的发生和进展可能与野生型P53功能受到抑制有关[3],这种抑制可能与表观遗传学组蛋白去乙酰化酶相关[4]。组蛋白乙酰基转移酶具有催化乙酰基的作用,使其转移至组蛋白乙酰基转移酶;而HDACs作用与其相反,可逆转赖氨酸残基乙酰化。可逆的乙酰化会调控非组蛋白,包括P53、NF-κB、STATs等。因此,乙酰化的依赖通路与其他转录后修饰具有一定的相关性,可维持机体动态平衡。正常P53需部分乙酰化,HDAC2是通过去乙酰化调控P53。
k320是位于P53DNA连接域/四聚化结构域,P53信号通路与k320乙酰化相关。Brandl等[5]研究显示,结肠癌细胞中HDAC2和P53之间的作用可抑制P53k320乙酰化,进而影响靶基因的转录调控。目前,随着对HDAC2的研究深入,发现其在多数恶性肿瘤中均呈现高表达,包括卵巢癌、胰腺癌、肾癌、肾癌、肝癌等。Masoud等[6]研究发现HDAC抑制因子或者RNA抑制剂均会抑制肾癌细胞中HDAC2的高表达。在乳腺癌的研究中表明,抑制HDAC2表达会增强P53靶基因Bax的表达,细胞增殖加速[7-8]。有学者通过分析HDAC2与P53k320乙酰化之间的相关性[9-10],认为当P53k320乙酰化降低后会增加P53靶基因的表达,且HDAC2会逆转P53k320乙酰化,促进细胞增殖。本研究结果显示,胃癌细胞中HDAC2高表达,乙酰化P53k320低表达,表明在胃癌发生过程中,HDAC2表达升高可能抑制P53k320乙酰化。此外,本研究结果还显示,患者治疗效果越好者其HDAC2蛋白表达量越低,乙酰化P53k320蛋白表达量越高,这可能与胃癌患者治疗后,HDAC2的高表达受抑制,P53k320乙酰化增加,最终促进癌细胞凋亡相关。提示,HDAC2、乙酰化P53k320可作为评估胃癌患者治疗效果的指标。
