酪蛋白酶解反应过程的近红外光谱在线监测技术研究
2020-01-02李云亮王禹程黄姗芬马海乐
杨 雪 孔 娜 李云亮 王禹程 黄姗芬 马海乐*
(1 承德医学院基础医学院 河北承德 067000
2 江苏大学食品与生物工程学院 江苏镇江 212013)
酪蛋白是牛乳中最主要的蛋白质成分,约占牛奶总蛋白含量的80%以上[1]。酪蛋白经酶解后的酶解产物具有免疫调节[2]、抗菌[3]、降血压[4]和抗氧化[5]等生物学活性。酪蛋白酶解产物经胃模拟消化后,其活性会有显著的变化[6]。传统的酶解过程中酶解产物及其模拟消化产物的活性检测时间长、费用高、无法实现在线监测等,有必要引入一些新的检测方法来实现快速、在线监测酶解反应过程。
近红外光谱在线监测系统由于速度快、样品信息完整,操作简单,稳定性好,效率高等优势,已广泛应用于监测食品加工过程中组成的变化。近红外光谱反映物质中主要与含氢基团有关的内部信息。物质的近红外光谱图反映物质的成分、浓度等与化学结构有关的性质。Petiot等[7]通过在线检测水分含量的变化来控制烤制食品的质量;Muresa n等[8]使用近红外光谱结合化学计量学方法对含油食品 (以向日葵为例)中的脂质氧化进行在线分析;Morgan等[9]在啤酒生产线上,监测发酵过程中酒精及糖分含量变化。上述研究结果都达到相应的监测及预测的效果。近红外光谱在线监测技术已广泛用于监测和预测食品加工过程[10-11],为实现食品加工过程的自动化控制奠定了基础[12-13]。然而,近红外用于酶解反应过程的监测及其胃肠模拟消化产物的预测的相关研究鲜有报道。
本文探讨近红外光谱技术在线监测酪蛋白酶解反应过程,为酶解反应终点的判断提供技术支持,也为酶解产物胃肠模拟消化后的活性预测提供模型。
1 材料和方法
1.1 材料
酪蛋白,sigma公司;中性蛋白酶 (酶活2.0118×105U/mL,最适温度 50℃,pH 7.0),购于诺维信(中国)生物技术有限公司;血管紧张素转化酶 (Angiotensin-I-converting enzyme,ACE),根据 Maruyama等[14]方法制备;N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(N-[3-(2-fury lacryloyl)]-L-phenyalanyl-glycyl-glycine,FAPGG),购于Sigma公司;其余试剂均为分析纯。
1.2 设备与仪器
Tecan Infinite PRO TWIN 200多功能酶标仪,瑞士帝肯(TECAN)集团公司;IKA-Dancing 自动混匀器,德国IKA集团有限公司;NIRQUEST256-2.5近红外光谱仪,美国海洋光学;TP300浸入式光纤探头,美国海洋光学;DH-2000-BAL UV-VIS-NIR光源,美国海洋光学。
2 试验方法
2.1 酪蛋白的酶解方法
称取酪蛋白加入蒸馏水,配制成蛋白质量浓度为5 g/L,50℃的水浴中搅拌平衡10 min,随后加入5%(E/S)的中性蛋白酶开始酶解,整个酶解过程中保持pH和温度恒定,酶解反应300 min,每间隔5 min取样1 mL(3份,其中一份用于酶解液直接测定ACE抑制活性,另两份用于胃肠模拟消化),取样后迅速用沸水浴灭酶10 min,冷却后12 000 g离心10 min,收集上清液储存于4℃下待测。取样的同时,在反应池中进行在线光谱的采集。
2.2 胃、肠模拟消化
胃、肠模拟消化试验参照Ketnawa等[15]的方法略有修改,酶解结束后调节酶解液的pH为1.5,按照酶底比为2%(E/S)加入胃蛋白酶后,于37℃条件下模拟胃消化反应2 h,然后取出于沸水浴条件下灭酶10 min,冷却至室温后调节pH至7.0,离心取上清液待测。同时以同样的方法模拟胃消化,反应2 h结束后迅速调节其pH至7.5,按照酶底比为2%(E/S)加入胰酶后,于37℃反应4 h模拟肠消化,反应结束后于沸水中灭酶10 min,冷却至室温,离心取上清液待测。
2.3 酪蛋白水解度和酶解产物ACE抑制率的测定
2.3.1 水解度(DH)的测定 酪蛋白酶解过程中DH的计算采用pH-stat方法[16],其计算公式如下:

式中:h——被裂解的肽键数;htot——常数,即每个底物中蛋白中含有的肽键总数,酪蛋白为8.2 mmol/g[17];B——消耗的碱液的体积,mL;N——碱液的浓度,mol/L;α——酪蛋白平均解离度[18];m——底物中蛋白质总含量,g。
2.3.2 蛋白酶解产物ACE抑制率的测定 ACE抑制活性的测定方法采用酶标仪法[19]。将蛋白水解物用 HEPES 缓冲液 (80 mmol/L,pH 8.3,300 mmol/L NaCl)稀释200倍。加样顺序为 50 μL ACE,100 μL样品稀释液和 50 μL FAPPG(1.0 mmol/L)。加样结束后迅速于340 nm处测定混合物吸光值。然后在37℃下孵育30 min后于340 nm再次测定样品的吸光值。由HEPES缓冲液取代的样品作为对照。ACE抑制活性通过以下公式计算:

式中,A——0 min时样品的吸光值;B——30 min时样品的吸光值。
2.4 酶解过程中在线光谱的采集及模型建立
以50℃蒸馏水为背景,每个样品连续采集3次光谱,取其平均值作为该样本的原始光谱,光谱图见图1。并采用标准正态变换(SNV)预处理方法对酶解过程中采集的原始光谱进行预处理。酪蛋白的DH、酶解液及其胃肠模拟消化产物的ACE抑制率的60个样品离位化学值,分别分成校正集和预测集两个部分。采用偏最小二乘算法(PLS)、区间偏最小二乘法(iPLS)和联合区间偏最小二乘法(si-PLS)建立酶解过程中酪蛋白的DH、酶解液及其胃肠模拟消化产物的ACE抑制活性之间的定量模型。

图1 酪蛋白酶解反应的原始近红外光谱图Fig.1 Raw NIR spectra of casein during enzymatic reaction
3 试验结果与分析
3.1 酪蛋白DH、酶解产物及其胃肠模拟消化产物ACE抑制活性
酪蛋白DH、酶解产物及其胃肠模拟消化产物ACE抑制活性如图2所示。随着酶解时间的延长,酪蛋白DH逐渐增大。随着酶解时间的延长,酶解液的ACE抑制率均增加,且经过胃肠模拟消化以后的酶解液的ACE抑制活性显著高于酶解液,说明胃肠道内的消化酶也是制备ACE抑制肽的常用蛋白酶[20]。酶解液的ACE抑制率经过胃消化后,活性均提高,而经过肠消化后,在短时间内ACE抑制活性提高,随着酶解时间的延长,ACE抑制活性反而降低,可能是因为肠道内的蛋白酶对胃酶解产物进行过度酶解所致。胃肠模拟消化更能体现酶解液进入胃肠道内的ACE抑制活性。经过近红外光谱的在线监测技术可以实现酶解过程终点的判断,也可以预测酶解液进入胃肠道内的活性的变化。
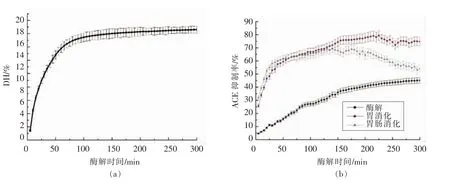
图2 酪蛋白DH(a)、酶解液及其胃肠模拟消化产物ACE抑制活性(b)Fig.2 The changes of DH of casein (a) and ACE inhibitory activity of its hydrolysate and gastrointestinal simulated digestion products (b)
3.2 酪蛋白DH的校正模型和预测模型的建立
酪蛋白DH的校正模型和预测模型的建立结果如图3所示。利用PLS方法建立的定量模型如图3a、图3b,校正模型的相关系数为0.5781,RMSECV为2.45%,预测模型的相关系数为0.961,RMSEP为1.64%。利用iPLS方法建立的定量模型如图3c、图3d、图3e,校正模型的相关系数为0.6701,RMSECV为2.09%,预测模型的相关系数为0.8316,RMSEP为2.31%。利用siPL方法建立的定量模型如图3f、图3g、图3h,校正模型的相关系数为0.9028,RMSECV为1.23%,预测模型的相关系数为0.9513,RMSEP为1.94%。由结果可知,siPLS方法所建立的模型可良好地预测酪蛋白的DH。
3.3 酪蛋白酶解液的ACE抑制率校正模型和预测模型的建立

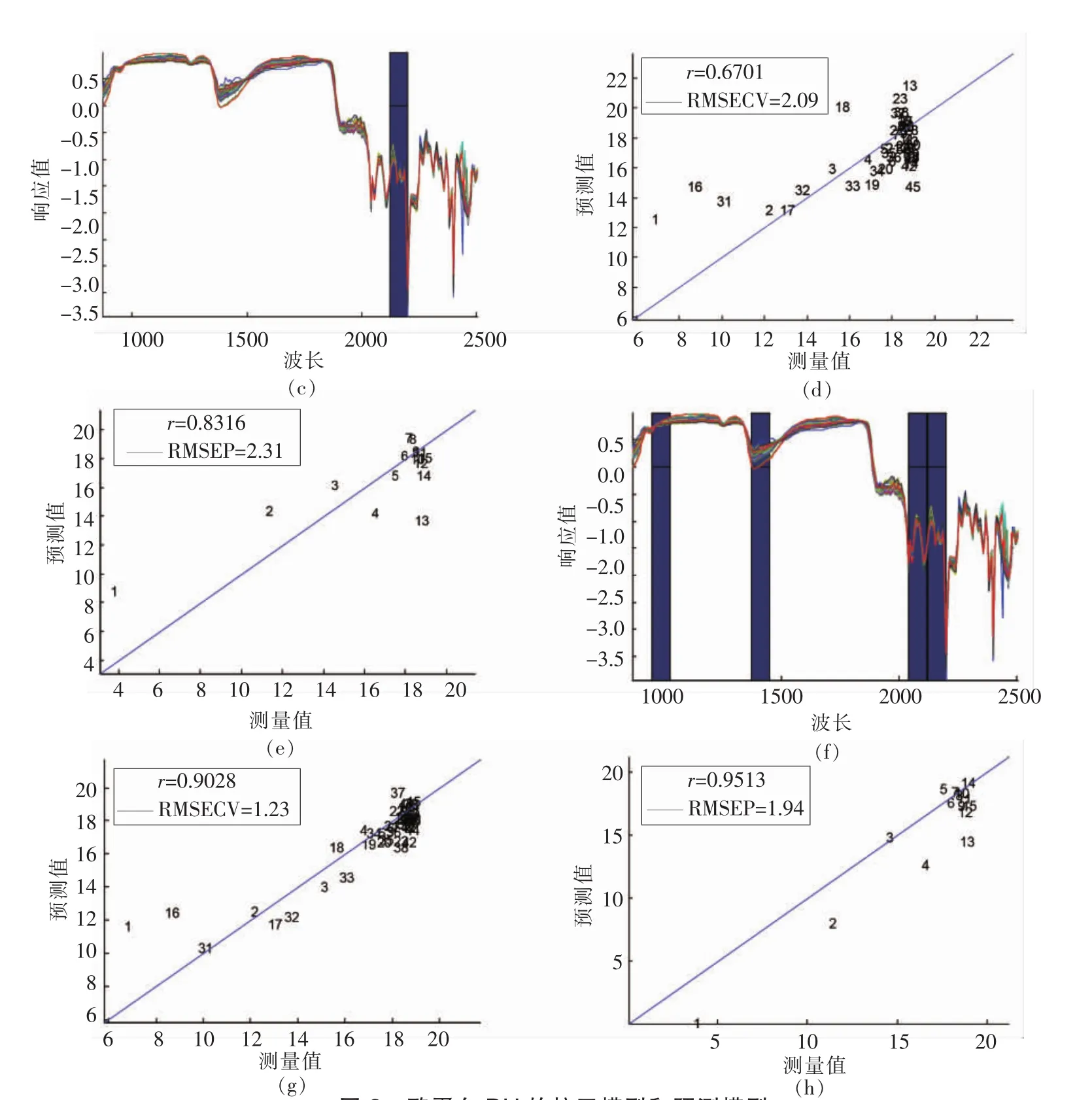
图3 酪蛋白DH的校正模型和预测模型Fig.3 Calibration and prediction model of DH of casein
酪蛋白酶解液的ACE抑制率的校正模型和预测模型的建立结果如图4所示。利用PLS方法建立的定量模型如图4a、图4b,校正模型的相关系数为0.771,RMSECV为3.6%,预测模型的相关系数为0.8233,RMSEP为3.95%。利用iPLS方法建立的定量模型如图4c、图4d、图4e,校正模型的相关系数为0.7616,RMSECV为5.65%,预测模型的相关系数为 0.807,RMSEP为 5.2%。利用siPLS方法建立的定量模型如图4f、图4g、图4h,校正模型的相关系数为 0.9493,RMSECV为2.73%,预测模型的相关系数为0.9656,RMSEP为2.4%。由结果可知,siPLS方法所建立的模型可良好地预测酪蛋白酶解物的ACE抑制率。


图4 酪蛋白酶解液的ACE抑制率校正模型和预测模型Fig.4 Calibration and prediction model of ACE inhibitory activity of casein-hydrolysate
3.4 酪蛋白酶解液经胃消化后的ACE抑制率校正模型和预测模型的建立
酪蛋白酶解液经胃消化后的ACE抑制率的校正模型和预测模型的建立结果如图5所示。利用PLS方法建立的定量模型如图5a、图5b,校正模型的相关系数为0.4409,RMSECV为9.37%,预测模型的相关系数为0.7464,RMSEP为9.6%。利用iPLS方法建立的定量模型如图5c、图5d、图5e,校正模型的相关系数为 0.693,RMSECV为7.57%,预测模型的相关系数为0.8478,RMSEP为7.99%。利用siPLS方法建立的定量模型如图5f、图5g、图5h。对于ACE,校正模型的相关系数为0.9483,RMSECV为3.32%,预测模型的相关系数为0.9717,RMSEP为3.37%。由结果可知,siPLS方法所建立的模型可良好地预测酪蛋白酶解物经胃模拟消化后的ACE抑制率。
3.5 酪蛋白酶解液经胃肠消化后的ACE抑制率校正模型和预测模型的建立

图5 酪蛋白酶解液经胃模拟消化后的ACE抑制率校正模型和预测模型Fig.5 Calibration and prediction model of ACE inhibitory activity of casein-hydrolysate after gastric simulated digestion
酪蛋白酶解液经胃肠消化后的ACE抑制率的校正模型和预测模型的建立结果如图6所示。利用PLS方法建立的定量模型如图6a、图6b,校正模型的相关系数为0.4909,RMSECV为5.8%,预测模型的相关系数为0.9095,RMSEP为5.92%。利用iPLS方法建立的定量模型如图6c、图6d、图6e,校正模型的相关系数为0.6909,RMSECV为4.64%,预测模型的相关系数为0.9079,RMSEP为4.82%。利用siPLS方法建立的定量模型如图6f、图6g、图6h,校正模型的相关系数为0.9292,RMSECV为2.42%,预测模型的相关系数为0.9728,RMSEP为3.25%。由结果可知,siPLS方法所建立的模型可良好地预测酪蛋白酶解物经胃肠模拟消化后的ACE抑制率。

图6 酪蛋白酶解液经胃肠模拟消化后的ACE抑制率校正模型和预测模型Fig.6 Calibration and prediction model of ACE inhibitory activity of casein-hydrolysate after gastrointestinal simulated digestion
4 结论
1)酪蛋白的水解度和酶解液的ACE抑制率均随着酶解时间的延长逐渐增加,酶解液经胃、肠模拟消化后ACE抑制率显著升高。
2)采用si-PLS方法建立的模型具有很高的预测能力,可以实现酪蛋白酶解反应过程的在线监测,以及酶解液及其胃、肠模拟消化产物ACE抑制率的预测,为酶解反应终点的判断提供理论依据。
