大豆蛋白和豌豆蛋白对体外发酵特性及合成微生物蛋白的影响
2020-01-02梁婷婷佟立涛耿栋辉王丽丽蒲华寅周闲容黄峻榕周素梅
梁婷婷 佟立涛 耿栋辉 王丽丽 蒲华寅 周闲容 黄峻榕 周素梅*
(1 中国农业科学院农产品加工研究所 农业部农产品加工综合性重点实验室 北京 100193
2 陕西科技大学 食品与生物工程学院 西安 710021)
人类胃肠道中复杂而动态平衡的微生物区系对宿主的健康和营养物质的消化吸收起着重要的作用[1-2]。蛋白质作为最重要的营养物质之一,对肠道健康的影响愈来愈受到人们的关注。目前,一些研究发现不同水平蛋白对肠道内微生物的组成和数量会有影响[3]。Pieper等[4]认为,在饲粮中增加蛋白质水平,不改变猪粪便中pH值。Geypens等[5]研究发现饲粮中蛋白质的添加可显著增加粪便中氨态氮(Ammonia Nitrogen,NH3-N)浓度。Le等[6]将饲粮蛋白质水平从18%降至12%,显著降低了猪粪便中短链脂肪酸 (Short chain fatty acid,SCFA)和支链脂肪酸 (Branched chain fatty acid,BCFA)浓度,且不同水平蛋白质底物对猪结肠微生物体外发酵特性和菌体蛋白合成(Microbial Crude Protein,MCP)能力都有一定的影响[7]。目前有关不同来源的蛋白质底物对微生物体外发酵代谢产物的影响研究报道甚少。
哈佛医学院和马萨诸塞州总医院的研究人员对超过13万人的追踪调查显示,食用较多来自植物的蛋白质,有助于降低死亡率。如果摄入较多来自动物的蛋白质,就会使死亡风险上升[8]。《中国糖尿病医学营养治疗指南》指出:植物来源的蛋白质,尤其是大豆蛋白,相比动物蛋白更有助于降低血脂水平[9]。邓士贤[10]称豌豆蛋白所含的氨基酸组成与大豆蛋白相近,接近人体的需要,其中豌豆中含有谷类食物中较为缺乏的赖氨酸,豌豆蛋白具有较高的营养价值。大豆蛋白与豌豆蛋白作为植物蛋白中的优质蛋白,其消化与吸收也受到很多研究者的密切关注。此外,酪蛋白与植物蛋白和其它动物蛋白相比,其消化、吸收、利用率很高,通常作为评定其它蛋白生物学价值的标准蛋白。本文旨在体外厌氧培养的条件下,研究比较大豆蛋白、豌豆蛋白与酪蛋白对人体粪便微生物发酵主要代谢产物 (挥发性脂肪酸 (Volatile Fatty Acid,VFA))以及合成菌体蛋白(MCP)能力的影响,旨在为进一步探讨大豆蛋白和豌豆蛋白对人体肠道健康的影响提供理论参考。
1 材料与方法
1.1 材料与试剂
大豆蛋白,豌豆蛋白由烟台东方蛋白科技有限公司提供;酪蛋白由北京诺康源生物科技有限公司提供;胃蛋白酶(474 U/mg)、胰酶(4×USP)均由Sigma公司提供;氢氧化钠、氯化钾、氯化钠等均为分析纯,由国药集团提供。
1.2 试验方法
1.2.1 体外消化 体外消化过程参照Wendy等[11]的方法,并略作修改。将1 g原料蛋白中加入20 mL的蒸馏水配制成质量分数为5%的溶液,煮沸2 min,冷却后,用1 mol/L的HCl调 pH 至 2.0,加入0.04 g胃蛋白酶(占底物质量的4%),37℃恒温反应1 h;用0.9 mol/L的NaHCO3将溶液的pH调至 5.3,再用 1 mol/L的NaOH 调 pH 至 7.0,加入0.04 g胰蛋白酶(占底物质量的4%),37℃恒温反应2 h,沸水浴10 min终止反应,分别在消化过程中(0,30,60,90,120,180 min)取样用于水解度的测定。最后将样品冷冻干燥,保存用于体外模拟肠道发酵试验。
1.2.2 水解度 (DH)的测定 采用邻苯二甲醛(OPA)法[12],将 5 mL试管中加入 3.00 mL OPA 溶液,再加入400 μL稀释至一定倍数的水解上清液,室温下反应2 min后在340 nm处测定吸光值。同时用丝氨酸(Serine)标准溶液(0.9516 mmol/L)做参考,用水做空白试验。计算公式如下:

式中:Serine NH2——每克蛋白质中含serine NH2的质量;X——样品质量(g);P——样品中的蛋白含量(%);N——稀释倍数;V——上清液体积(L)。

式中:htot、β、α——常数;htot——每克原料蛋白的肽键的物质的量(mmol/g)。大豆蛋白,豌豆蛋白β、α分别以0.342和0.970表示,htot=7.8;酪蛋白β、α分别以0.40和1.00表示,htot=7.6。
1.2.3 模拟肠道发酵 培养液配制:参照Theodorou等[13]的方法,并略作修改。需要预先配制A、B、C、D和E 5种溶液。其配制方法如表1。模拟肠道发酵参照Olano-Martin等[14]的方法,并略作修改。无菌发酵瓶中加入36 mL基础培养基,调节其pH值至7.0,收集健康志愿者的新鲜粪便,志愿者为23~24岁的健康男性,3个月内未接受抗生素治疗,取样前未摄入益生元或益生素,并且无肠道疾病史,收集过程尽量保持无菌状态。粪便收集后立即用预还原的磷酸盐缓冲液(PBS,1 mmol/L,pH 7.0)按照质量分数为20%比例稀释。
取4 mL粪便稀释液加入到基础培养基中,随后按照质量浓度为0.25 g/L的比例加入体外消化后的冻干样品,将样品加入混匀后在37℃厌氧工作站中发酵,空白组中仅加入相同体积粪浆。在发酵的第0,24,48 h取样用于pH值,氨态氮,微生物蛋白,挥发性脂肪酸的测定。从粪便采集至样品加入在30 min内完成,每个样品重复2次。
1.2.4 pH的测定 将发酵液在9 000 r/min下离心10 min,取其上清液装入离心管中,pH计测定发酵上清液的pH值。
1.2.5 氨态氮测定 参照Weathbum等[15]和Broderick等[16]方法,并略作修改,测定NH3-N浓度,将发酵液与0.2 mol/L盐酸等体积混合,于-20℃保存。测定前解冻,于4℃条件下,10 000 r/min离心10 min,取上清液采用比色法进行测定分析。
1.2.6 微生物蛋白测定 考马斯亮蓝比色法测定MCP浓度[17],-20℃冻存的发酵液样品室温下解冻,取3 mL样品1 000 r/min离心,然后取2 mL上清液15 000 r/min离心30 min。100 μL上清液加入到5 mL考马斯亮蓝溶液中,在595 nm波长下读取吸光度值。以结晶牛血清白蛋白为标准品,制作标准曲线。
1.2.7 挥发性脂肪酸测定 采用气相色谱方法测定挥发性脂肪酸(VFA)[18]:取发酵液样品1 mL加0.2 mL 25%偏磷酸1 mL,-20℃冰箱保存。测定前解冻,12 000 r/min离心10 min,取上清液0.5 mL测定。柱温110℃,进样器温度180℃。检测器温度180℃。配制乙酸、丙酸、丁酸、戊酸、异丁酸、异戊酸混标,梯度稀释,绘制标准曲线。根据保留时间和峰面积进行定性定量分析。
1.3 统计分析
试验数据经Excel 2013初步处理,用SPSS19.0单因子方差分析(one-way ANOVA)进行差异显著性分析,P<0.05为差异显著,用Origin进行作图。

表1 培养基配制方法Table1 The method of preparation of culture medium
2 结果与分析
2.1 不同来源蛋白体外模拟胃肠消化产物的水解度(DH)的变化
蛋白质的水解度(degree of hydrolysis,DH),即测定生成的有效蛋白肽。图1a为酪蛋白、大豆蛋白和豌豆蛋白被胃蛋白酶、胰蛋白酶消化水解的进程曲线。前60 min为胃蛋白酶水解阶段,60~180 min为胰蛋白酶水解阶段,蛋白消化液的水解度随消化时间的增加而增加,到120 min左右,3种蛋白消化产物基本达到最高水解度,之后变化较缓慢。这是因为随着消化反应的进行,消化产物浓度增大,底物浓度减小,蛋白酶的活性受到抑制等综合因素所致[19]。Gilbert等[20]称来源于动物的蛋白质 (如乳品和动物蛋白)其消化率可能高达90%,高于植物蛋白,这说明酪蛋白更易被水解。蔡立志等[21]又称大豆蛋白饮品比牛奶容易消化吸收,植物蛋白中,大豆蛋白最接近于动物蛋白和“全价蛋白”,且没有动物蛋白的一些副作用[22],这说明大豆蛋白也容易被水解。由图1(b)显示可知,3种蛋白经过体外消化最终水解度有一定的差别,大豆蛋白和酪蛋白水解度显著高于豌豆蛋白(P<0.01),大豆蛋白水解度与酪蛋白差异不显著(P>0.05),本试验结果与上述研究结果一致。
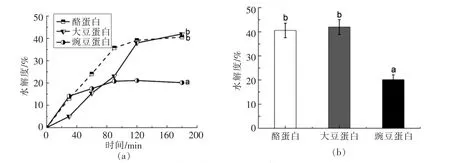
图1 体外模拟胃肠消化酶解3种蛋白的水解度变化Fig.1 The changes in degree of hydrolysis of casein,soybean,pea after stimulated in vitro gastrointestinal digestion
2.2 不同来源蛋白对人体粪便微生物发酵液中pH的影响
夏楠等[23]报道称微生物适宜生活的pH为6~7之间,在这范围内最有利于蛋白质的降解。由图2a可知,本试验pH介于6.43~6.87,基本处于中性环境,在适宜微生物生活的范围内,且对照组在发酵期间pH基本保持不变,蛋白质底物添加组的发酵液中pH整体呈现先下降后增长的趋势。短链脂肪酸是细菌在人的结肠发酵产生的主要代谢物,由于产酸会降低pH值,因此pH值的变化常用来监测发酵情况[24]。由图2b可知,在0 h时,对照组与蛋白质底物添加组发酵液中pH组间差异不显著(P>0.05)。在24 h时,蛋白质底物添加组pH显著低于对照组(P<0.05),其中大豆蛋白组显著低于酪蛋白组和豌豆蛋白组(P<0.05),酪蛋白与豌豆蛋白组间差异不显著,这是因为蛋白质发酵产生短链脂肪酸的缘故,且说明大豆蛋白产生了更高浓度的短链脂肪酸。至48 h时,蛋白质底物添加组pH上升至对照组水平,组间无显著差异(P>0.05),这提示,蛋白质的添加显著影响微生物发酵,进而降低pH,影响肠道内环境,但是随着时间延长,发酵体系趋于稳态,继而稳定环境,使pH恢复至正常水平。

图2 体外发酵中各时间点pH变化Fig.2 Changes of pH at each time point during in vitro fermentation
2.3 不同来源蛋白质对人体粪便微生物发酵液中NH3-N浓度的影响
氨态氮是微生物生长的重要氮源,其浓度在一定程度上可以反映出发酵液中蛋白质降解与合成之间的平衡状态[25]。由图3a可知,对照组在发酵期间NH3-N浓度基本保持不变,蛋白质底物添加组的发酵液中NH3-N浓度整体呈现增加的趋势,在 24 h显著高于 0 h (P<0.05),48 h显著高于24 h(P<0.05),这说明随着发酵时间的延长,蛋白质降解的速度高于微生物合成自身蛋白的速度。葛婷等[26]报道称蛋白添加组随着发酵时间的增加,氨态氮浓度逐渐上升,本试验结果与其观点一致。由图3b可知,在0 h时,对照组与蛋白质底物添加组发酵液中NH3-N浓度组间差异不显著。在24 h时,蛋白质底物添加组发酵液中NH3-N浓度显著高于对照组 (P<0.05),其中大豆蛋白组显著高于酪蛋白组和豌豆蛋白组(P<0.05),酪蛋白与豌豆蛋白组间差异不显著(P>0.05)。至48 h时,蛋白质底物添加组NH3-N浓度继续升高,大豆蛋白组显著高于酪蛋白组和豌豆蛋白组 (P<0.05),且豌豆蛋白组显著高于酪蛋白组(P<0.05)。牟晓玲等[27]报道称大豆黄酮能够提高培养液中氨态氮浓度,从而提高粗饲料蛋白质在瘤胃液中的降解速度,对于蛋白质在瘤胃中的消化和吸收是有益的。本试验结果说明大豆蛋白和豌豆蛋白能够产生更高浓度的NH3-N,更有利于蛋白质的消化和吸收。
2.4 不同来源蛋白质对人体粪便微生物发酵液中MCP浓度的影响
MCP浓度反映着微生物利用底物为自身合成蛋白质的需要。由图4a可知,对照组在发酵期间,MCP浓度略有升高,蛋白质底物添加组的发酵液中MCP浓度整体呈现上升的趋势,在24 h显著高于 0 h (P<0.05),48 h 显著高于 24 h (P<0.05)。Dehority等[28]指出,日饲1次的绵羊和牛犊在饲喂后1~4 h内,MCP浓度呈下降趋势,随后逐渐上升,在12~20 h内MCP浓度达最高值,随后下降直至下一次饲喂,与本试验结果不一致,可能是研究手段和采样时间点不同造成的差别,原因有待进一步探讨。由图4b可见,在0 h时,对照组与蛋白质底物添加组发酵液中MCP浓度组间差异不显著。在后期的整个发酵期间,蛋白质底物添加组MCP浓度显著高于对照组(P<0.05),其中大豆蛋白和豌豆蛋白组显著高于酪蛋白组(P<0.05)。随着发酵时间的延长,发酵液中的MCP浓度显著增加,且大豆蛋白和豌豆蛋白组显著高于酪蛋白组,这可能预示着,添加大豆蛋白和豌豆蛋白后更有利于提高微生物利用氨基酸合成自身所需蛋白质的能力。此外,NH3-N是蛋白质降解和微生物合成MCP的中间产物[25],由于大豆蛋白和豌豆蛋白高的NH3-N浓度,导致产生更高浓度的MCP。

图3 体外发酵期间氨态氮浓度变化Fig.3 Changes of NH3-N concentration during in vitro fermentation
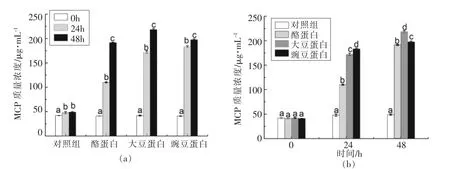
图4 体外发酵期间MCP浓度变化Fig.4 Changes of MCP concentration during in vitro fermentation
2.5 不同来源蛋白质对人体粪便微生物发酵液中VFA浓度的影响
微生物利用宿主未消化吸收的营养物质产生VFA,其中微生物利用碳水化合物及蛋白质水解产物生成SCFA,会为人体提供约10%的热量[29]。张逢生等[30]报道称乙酸具有促进胃液分泌,帮助消化,降血脂,降低胆固醇,扩张血管,延缓血管硬化等功能;丙酸作为肝脏代谢的能源并能够抑制胆固醇的合成[31];丁酸被认为是结肠细胞所需的最重要的能量来源,有助于结肠细胞的分化及增殖等[32-34]。由图5a、c、e、g 可见,发酵期间,对照组和蛋白质底物添加组的SCFA浓度都有不同程度的增加,但蛋白质底物添加组增加的更多。SCFA浓度在 24 h显著高于 0 h (P<0.05),48 h时持续增加。由图5b、d、f、g可见,不同来源蛋白质对人体粪便发酵液中短链脂肪酸浓度有一定的影响。乙酸、丙酸、丁酸和总短链脂肪酸在0 h时,对照组与蛋白质底物添加组组间差异不显著(P>0.05)。在24 h时,蛋白质底物添加组显著高于对照组(P<0.05)。其中,总短链脂肪酸、乙酸:整个发酵期间,大豆蛋白组显著高于酪蛋白和豌豆蛋白组(P<0.05),48 h时,酪蛋白组与豌豆蛋白组差异不显著(P>0.05);丙酸:24 h时,大豆蛋白组显著高于酪蛋白组和豌豆蛋白组(P<0.05);丁酸:24 h 时,大豆蛋白组显著高于酪蛋白组和豌豆蛋白组(P<0.05),48 h时,三组之间没有显著性差异(P>0.05)。说明大豆蛋白经体外发酵24 h时,产生了更高浓度的SCFA,为人体提供能量,有利于肠道益生菌的增殖,从而有益肠道健康。

图5 体外发酵期间各时间点SCFA浓度变化Fig.5 Changes of SCFA concentration at each time point during in vitro fermentation
与SCFA相比,BCFA仅仅是由支链氨基酸所发酵产生的,例如,异丁酸、异戊酸,分别是由缬氨酸、亮氨酸发酵产生[35],所以BCFA可以作为微生物利用蛋白质的标记[36]。图6a、c、e比较可见,发酵期间,对照组和蛋白质底物添加组的BCFA浓度都有不同程度的增加。其中,对照组的BCFA浓度增加,说明粪便中还残留有部分未消化的蛋白质;蛋白质底物添加组的BCFA浓度增加,说明微生物在不断的利用蛋白质产生BCFA。沈冰蕾等[37]报道称支链脂肪酸是瘤胃微生物生长、繁衍的必需物质,可促进瘤胃纤维素分解菌的生长和微生物蛋白的合成。图6b、d、f比较可见,3种蛋白质对人体粪便发酵液中支链脂肪酸浓度均有一定的影响。在整个发酵期间,大豆蛋白和豌豆蛋白组显著高于酪蛋白组(P<0.05),说明大豆蛋白和豌豆蛋白产生的高浓度的MCP可能是因为代谢产物异丁酸和异戊酸的产生。

图6 体外发酵期间各时间点BCFA浓度变化Fig.6 Changes of BCFA concentration at each time point during in vitro fermentation
3 结论
在体外发酵体系中,蛋白质的添加提高了MCP的合成能力,并且大豆蛋白发酵液中高浓度的NH3-N和BCFA以及豌豆蛋白发酵液中高浓度的BCFA,使得其合成了更高浓度的MCP。
在体外发酵体系中,蛋白质的添加降低了pH,提高了SCFA浓度,并且大豆蛋白产生了更高浓度的SCFA,说明氮源不同的发酵底物影响SCFA的类型和数量,且由于不同的SCFA有各自特定的生理作用,可能会导致不同的代谢结果。
综上所述,大豆蛋白和豌豆蛋白有很好的发酵效果,其降低pH值、提高VFA产量、提高MCP浓度均显著优于酪蛋白,更有利于肠道健康。
