突出“宏观辨识与微观探析”的化学教学
2019-12-20闰银权
闰银权


摘要:分析了宏观辨识与微观探析的内涵和目标。不同的知识内容承载的核心素养不同,以化学键的单元教学为例,从宏观、微观、宏微结合的层次认识化学键和物质的性质,建立了化学键认识模型。重点发展了学生“宏观辨识与微观探析”的化学学科核心素养。
关键词:宏观辨识;微观探析;化学键;静电作用;核心素养
文章编号:1008-0546(2019)11-0021-04
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j.issn. 1008-0546.2019.11.006
化学学科核心素养是化学学科育人价值的集中体现,是学生通过化学学习而形成的正确价值观念、必备品格和关键能力。化学学科核心素养包括5个方面,各有侧重,不同的知识内容承载的核心素养不同,教学中要根据知识内容重点突出某些核心素养的培育,而不是生搬硬套核心素养的5个方面。
一、宏观辨识与微观探析的内涵与目标
宏观辨识与微观探析作为化学学科核心素养,是化学学科区别于其他学科的重要特征。该核心素养反映了学习化学是从宏观角度研究、认识物质及其变化规律,从微观层面解释物质及其变化规律的本质的过程。宏观辨识与微观探析的内涵与目标[1]如表1所示。
其内涵表明对物质认识的层次和阶段,即宏观一微观一宏微结合,达到对物质组成、结构、性质、变化、应用及其关系的本质认识。其目标解决了“怎么学”和“学到什么程度”的问题,指明了学习行为和评价依据。教学中结合宏观辨识与微观探析的内涵与目标的关联性,构建具有可操作性的学习行为与评价依据,具体见图1“学习行为与目标达成评价指向”[2]。
本文以化学键[3]单元教学为例,突出宏观辨识与微观探析核心素养的培育。查阅中国知网有关化学键的教学[4-7],从不同角度对化学键教学进行深入地研究、设计,不同角度各有优点,本文旨在突出2点:
1.突出“宏观辨识与微观探析”核心素养的培育。从“宏-微-宏微”三层次认识化学键的形成与本质,以及对物质性质、应用的决定作用,形成结构决定性质的科学观念。
2.突出认识化学键的本质——静电作用,建立离子键、非极性共价键、极性共价键的认识模型。用模型辨别物质所含化学键类型,判断离子化合物和共价化合物及其性质,体会化学知识的应用价值。
二、教学过程
任务1:再探(宏观辨识)电解质
教师:我们知道电解质是指在水溶液中或熔融状态下能够导电的化合物,那么哪些化合物在水溶液中导电?哪些化合物在熔融状态下导电?哪些化合物既能在水溶液中导电又能在熔融状态下导电呢?其导电性与什么有关呢?我们通过实验再探电解质。
学生分组实验:NaCl溶液、熔融NaCl、NaCl固体、盐酸的导电性实验。
问题1、电解质导电的条件是什么?你觉得液态HCl导电吗?
问题2、为什么同样是电解质,NaCl在熔融状态和水溶液中都能导电,而HCl却只在水溶液中能导电呢?
学生:电解质导电的条件是有自由移动的带电粒子——离子,固态NaCl中离子不能自由移动,故不导电。NaCl熔化后或NaCl溶液中离子可以自由移动,故能导电。同样的原因盐酸可以导电,但我觉得液态的HCl不导电,因为HCl在液态时没有自由移动的离子,应该是分子形式存在。
导电性实验提供证据,学生从宏观现象认识不同物质在不同条件下的导电性存在差异,形成认知冲突:为什么NaCl熔融状态有自由移动的带电粒子,而HCl却没有自由移动的带电粒子?
任务2:探究(微观)原子构成物质的过程和本质、建立化学键的认识模型
(1)离子键和共价键的形成
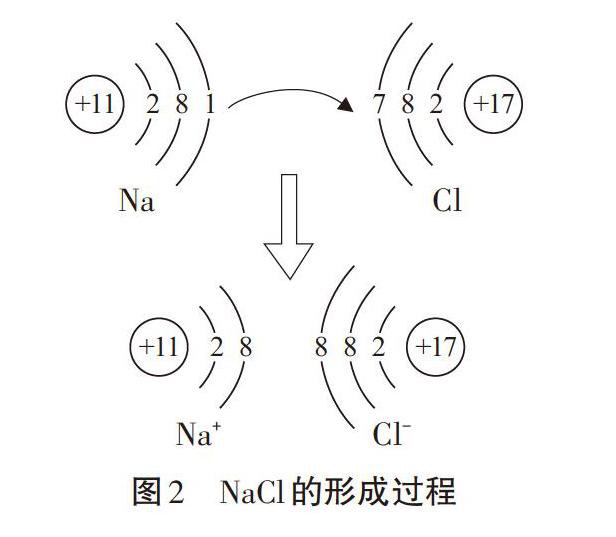
我们知道电荷之间存在静电作用,同种电荷相互排斥,异种电荷相互吸引。根据原子结构,猜想当Na原子和Cl原子相互靠近碰撞时会发生什么呢?试用原子结构示意图表示。
学生根据Na原子和Cl原子结构特点,在黑板上用原子结构示意图表示出Na原子和Cl原子靠近时的电子转移过程(图2)。认识到Na会失去1个电子而形成阳离子,Cl得到这个电子形成阴离子,并且相互吸引。
问题3:随着原子的靠近,它们之间只存在吸引力吗?在什么位置形成稳定的化合物?
學生讨论:阴、阳离子也存在彼此之间电子与电子、质子与质子的排斥力,当吸引力与排斥力平衡时,形成化合物。
问题4:NaCl形成过程中能量与离子间距离关系图如图3所示[8],表示了随着Na+和Cl-间距离大小变化过程中能量的变化,R0有何意义?
学生:Na+和cl-间距离为R0时表示体系能量最低,静电吸引力等于静电排斥力,形成稳定的化合物,R。为Na+和cl-的核间距。
【小结】:像氯化钠这样带相反电荷离子(阴、阳离子)之间的相互作用称为离子键。
教师:那Na+和Cl-又是怎么形成NaCl固体的呢?你能简单描述吗?
学生认为形成一个一个的NaCl结合体堆积在一起。教师引导带电粒子应该如何排列,以“带电”的乒乓球为例进行堆积,再结合多媒体帮助学生建立NaCl堆积模型,如图4所示。
问题5:请模仿NaCl的形成过程,描述HCl的形成过程,形成阴、阳离子了吗?
学生讨论:根据H原子和Cl原子的原子结构特点,可知原子核对电子的吸引力较强,它们都不易失去电子,而是都想得到电子,所以当它们靠近碰撞时,不会有电子的得失,只有原子的质子与另一原子的电子存在相互静电引力,当靠近到一定距离时,两原子的电子与电子、质子与质子间的斥力增大,当引力与斥力达到平衡时,能量最低,形成稳定的HCl分子。故HCl中没有阴、阳离子。
【小结】H原子和Cl原子之间不会有电子的得失,它们通过共用电子而达到稳定结构,形成HCl分子。这种原子间通过共用电子对形成的相互作用叫做共价键。
我们把这种相邻原子间强烈的相互作用称为化学键,分为离子键、共价键等。
(2)认识化学键的本质,建立化学键的认识模型
问题6:讨论离子键和共价键的本质是什么?它们之间是什么关系?
学生讨论:根据离子键和共价键的形成过程,不管是阴、阳离子还是原子共用电子都是由于静电作用而形成作用力,故化学键的本质是成键原子间的静电作用。由于原子吸引电子的能力不同,故共用电子在成键原子间的偏移程度不同。活泼金属元素与活泼非金属元素原子易发生电子的得失,故形成离子键;而非金属元素与非金属元素原子都不易失电子,都想得电子,故形成共价键。
师生共同讨论:离子键与共价键之间并没有严格的界限,就像金属元素与非金属元素没有严格的界限一样,离子键与共价键都涉及电子对的共用[9]。成键原子得失电子的能力(金属性与非金属性强弱差异)决定了共用电子的偏移程度,纯粹的离子键是共用电子的极端偏移(得失)形成的,可以看做共用电子从一个成键原子完全转移到另一个成键原子上。共价键则是共用电子未发生极端偏移而形成的,根据共用电子偏移程度可将共价键分为非极性共价键和极性共价键,非极性共价键是由于共用电子被平均共用而形成的,极性共价键则是共用电子发生偏移而形成的。成键电子对偏移程度越大则离子性越强,反之则共价性越强,大多数化合物中的键介于两者之间。随着成键原子得失电子能力相差从小到大变化,化学键依次为非极性键→极性键→离子键。化学键认识模型如图5所示。
问题7:请同学们依据化学键认识模型讨论怎样判断化学键类型?
学生:由活泼的金属元素与活泼的非金属元素形成的化合物含离子键,如NaCl、MgBr2等。而非金属元素与非金属元素或不活泼的金属元素与非金属元素原子间易形成共价键,如HCl、H2O等。同种原子则形成非极性共价键,如H2、N2等。
教师:回答很好!我们对化合物的认识又多了一个角度,即从化学键的角度认识化合物,我们把含离子键的化合物称作离子化合物,只含共价键的化合物称作共价化合物。
任务3:符号表示化学键及其形成过程
我们如何用化学符号表示不同类型的化学键及物质的形成过程呢?
资料1:电子式:为方便起见,我们在元素符号周围用“×”或“·”来表示原子的最外层电子(价电子),这种式子叫做电子式。如H·,·Mg·等。请结合课本用电子式表示下列物质的形成过程:NaCl、K20、N2、H20、CO2等。
学生板演,互评。
任务4:宏微结合解决问题
(1)我们知道,常压下,冰(H2O)在O℃融化,水在1OO℃沸腾,这是为什么?而在2000℃以上分解为H2和02,这又是什么原因呢?
①对比与比较:融化、沸腾属于什么变化?分解呢?
②推断:为什么分解温度与沸腾温度相差如此之大?是什么决定的?
③得出结论:你认为该如何解释这种决定因素呢?
3个问题层层递进,考查与评价学生对知识的理解与应用能力。“对比与比较”从宏观分析变化过程的本质即物理变化和化学变化;“推断”则从微观角度,推理得出是微观粒子间的作用力大小决定的。冰融化、水沸腾是水分子与水分子间距增大,破坏的是水分子之间的作用力,而水分解破坏的是水分子内氧原子和氢原子之间的共价键,可见两者之间作用力相差很大,前者很微弱。“得出结论”则要找出作用力之间的差异,即本质区别。我们把分子与分子之间的作用力叫做分子间作用力,与化学键是不同的作用力,分子间作用力较小,只影响物质的物理性质。
(2)问题8:工业冶炼钠、镁、铝三种金属的原料选择有何不同?结合资料2分析为什么?
学生:冶炼钠和镁的原料是氯化物,而冶炼铝的原料是氧化物,因为氯化物的熔点低,节省能源,成本低。
学生:熔融状态能够导电的化合物才可用于电解冶炼金属,根据化合物的熔点推断化合物的类型,从钠、镁、铝的氧化物和氯化物的熔点可知AICl3是共价化合物,熔融状态不导电,所以只能选择Al203作为原料。
教师:可见,物质的结构决定性质及应用,物质所含化学键的类型决定着物质的性质及应用。
(3)问题9:初中我们就知道化学反应是原子的重新组合,那么通过本节课的学习,你觉得化学反应的本质是什么呢?举例说明。
學生讨论:化学反应的本质就是反应物中化学键发生断裂,形成生成物中新的化学键,即旧键断裂新键形成。如H2和Cl2生成HCl,H-H键和Cl-Cl发生断裂,形成H-Cl键。
【小结】化学键是原子结合构成物质的作用力,其本质是原子间通过共用电子形成的静电作用,由于成键原子的金属性和非金属性(得失电子的能力)不同,从而使成键原子间共用电子对发生偏移,根据偏移的程度,化学键可分为离子键和共价键,共价键又分为极性键和非极性键(参照化学键认识模型)。化学键的断裂与形成是化学反应的本质,决定化学反应发生的难易程度,决定了化学反应发生的条件。所以物质所含化学键的类型决定了物质的性质和用途,即结构决定性质,性质决定用途。
三、总结
化学键的知识内容对于发展学生“宏观辨识与微观探析”核心素养非常切合,具有独特的价值。化学键单元教学为2课时,学生在问题引领下,积极参与学习活动。学生通过完成前述4项任务,从宏观-微观-宏微结合的三个层次深入认识了化学键的本质、分类及物质的性质、应用,建立了化学键认识模型,深刻认识了化学键对物质性质的决定作用。同时,学生在探究知识的过程巾发展了宏观辨识与微观探析方面的化学核心素养。
参考文献
[1] 中华人民共和国教育部.普通高中化学课程标准(2017年版)[M].北京:人民教育出版社,2018:3-5
[2]顾建辛.关于化学核心素养培育的微观思考——“宏观辨识与微观探析”素养培育中的目标与行为分析[J].化学教学,2019(1):3-7+37
[3] 宋心琦主编.普通高中课程标准实验教科书化学2必修[M].北京:人民教育出版社,2007:19-23
[4]马欣怡,沈甸.从静电作用探讨化学键的本质及其教学实践[J].化学教育(中英文),2019,40(5):37-39
[5]孙翠萍.姜箐.基于化学三重表征的教学设计——以“化学键与化学反应”为例[J].化学教与学,2018(1):64-65+24
[6] 曾应超.“素养为本”的化学教学设计研究——以必修模块“化学键”的教学设计为例[J].化学教学,2018(4):36-39
[7]杭伟华.“观念建构”视角下的“化学键”教学设计[J].化学教学,2016(12):45-47
[8] 王新文,龚颖潮.对化学键教学基于文献审视的实践[J].中学化学教学参考,2018(7):20-23
[9] 菲利普(Phillips,J.S.)等.科学发现者.化学概念与应用.中册[M].王祖浩等译.杭州:浙江教育出版社,2008:323
