比较转录组分析揭示花生种皮花青素积累的分子调控机制
2019-12-09赵钰涵付春朱琳马俊杰周希萌李长生李爱芹厉广辉夏晗王兴军赵传志
赵钰涵 付春 朱琳 马俊杰 周希萌 李长生 李爱芹 厉广辉 夏晗 王兴军 赵传志

摘要:花青素作為一种抗氧化物质,具有多种保健功效。与其他颜色花生相比,黑种皮花生具有良好的感官品质,且花青素含量更高。为了揭示花生黑种皮花青素形成和调控的分子机理,本研究以黑种皮花生(YH29)和粉红种皮花生(WH10)为研究对象,通过RNA-seq技术比较其转录组的差异。结果表明,与粉红种皮花生相比,黑种皮花生中1 539个基因表达上调,1 275个基因表达下调。KEGG分析发现花青素生物合成、苯丙素生物合成、类黄酮生物合成等多个与色素积累相关的通路在黑色种皮花生中富集。在黑种皮花生中,苯丙氨酸解氨酶、查尔酮合成酶等5个与花青素合成相关的关键酶基因表达上调,而与花青素生物合成途径竞争同一底物的一些关键酶基因,如柚皮素和甘草素基因,则表达下调,这使得有更多的底物流向花青素合成途径,这些基因的协同表达可能是黑种皮花青素高水平积累的关键。另外,两个R2R3-MYB转录因子在黑种皮花生中也表达上调,可能是引起花青素合成关键基因表达差异的关键因素。我们的研究结果为深入研究花生种皮花青素合成的分子机理及培育高花青素含量的花生新品种提供了参考。
关键词:黑花生;转录组分析;花青素;种皮颜色
中图分类号:S565.2:Q78文献标识号:A文章编号:1001-4942(2019)09-0001-08
Comparative Transcriptome Analysis Reveals Transcriptional
Regulation in Accumulating Anthocyanins in Peanut Testa
Zhao Yuhan , Fu Chun3, Zhu Lin , Ma Junjie2, Zhou Ximeng , Li Changsheng2,
Li Aiqin2, Li Guanghui2, Xia Han , Wang Xingjun , Zhao Chuanzhi
(1. College of Life Sciences, Shandong Normal University, Jinan 250014, China;
2. Biotechnology Research Center, Shandong Academy of Agricultural Sciences/Shandong Provincial
Key Laboratory of Crop Genetic Improvement, Ecology and Physiology, Jinan 250100, China;
3. Weifang Academy of Agricultural Sciences, Weifang 261071, China)
Abstract Anthocyanin is an antioxidant with health benefits to human. In comparison with peanut with other colors, black or dark purple peanut cultivars were enriched in anthocyanin and showed better organoleptic quality. To reveal the molecular mechanism of synthesis and regulation of anthocyanins in peanut, the RNA-seq technology was performed to investigate the transcriptome variation between the black testa (YH29) and pink testa (WH10) cultivars. In comparison with WH10, a total of 1 539 up-regulated and 1 275 down-regulated genes were identified in YH29. Among them, five genes encoding key enzymes of anthocyanin synthesis were up-regulated, while some genes related with competing for the same substrates with anthocyanin synthesis were down-regulated. The different expression of these genes led to more substrates used for anthocyanin synthesis pathway, suggesting that the co-expression of these genes might be the key factor of high anthocyanin accumulation in black testa cultivar. In addition, two R2R3-MYB transcription factors were found up-regulated in YH29, which might play important roles in regulating the differential expression of key genes in anthocyanin synthesis pathway. In conclusion, this study provided a reference for further studying the molecular mechanism of anthocyanin synthesis in peanut and breeding new peanut varieties with high anthocyanin content.
Keywords Black testa peanut; Transcriptome analysis; Anthocyanin; Testa color
花生是一种口感好、营养丰富的油料作物,在世界范围内广泛种植[1]。我国传统的花生品种种皮颜色以粉红色和红色为主,黑色(或深紫色)种皮颜色的花生品种较少。与常规花生品种相比,黑色花生含有更多的花青素。
花青素是植物体内广泛存在的一种黄酮类化合物,具有多种生物学功能。花青素有利于植物传粉,种子传播,同时在预防紫外损伤和防止病原体攻击中具有重要作用[2,3]。在观赏植物中,花青素、类胡萝卜素或甜菜色素决定其五彩缤纷的花色[4,5]。对于很多果实和花卉来说,花青素是形成其重要品质特征的因素之一[6]。花青素能够清除细胞内产生的超氧自由基,具有较强的抗氧化活性。花青素还有预防癌症、炎症和心脏病的功能,如紫色番茄富含花青素,可显著抑制人结肠癌和卵巢癌细胞系的增殖[7,8]。茄科蔬菜中大量花青素可减少血管炎症和预防血栓的形成[9]。
花青素的生物合成途径主要包括以下步骤:①首先,苯丙氨酸在苯丙氨酸解氨酶(PAL)作用下生成4-香豆酰-CoA。PAL是苯丙烷代谢途径的第一个关键酶,决定了花青素合成的关键一步。②4-香豆酰-CoA和丙二酰-CoA在查尔酮合成酶(CHS)催化下合成查尔酮。CHS是花青素代谢途径的关键限速酶,催化花青素合成途径的第一步反应,是一类多基因家族编码的酶[10,11]。目前,已经在葡萄[11]等多种植物中克隆鉴定出该类基因,该类基因具有一定的保守性。降低 CHS 基因的表达水平,会导致植物花色变淡[12]。③查尔酮异构酶(CHI)将查尔酮异构化为柚皮素。CHI是最早研究的类黄酮合成途径的关键酶。④柚皮素在黄烷酮3-羟化酶(F3H)催化下转化为二氢山奈酚。⑤二氢山奈酚在类黄酮3′-羟化酶(F3′H)和类黄酮3′5′-羟化酶(F3′5′H)催化下分别转化为二氢槲皮素和二氢杨梅素。⑥二氢槲皮素和二氢杨梅素经二氢黄酮醇还原酶(DFR)催化分别转化为无色矢车菊素和无色天竺葵素,DFR也可以直接催化二氢山奈酚为无色飞燕草素。⑦无色矢车菊素、无色天竺葵素和无色飞燕草素经隐色花青素双加氧酶(LDOX/ANS)催化,转化为矢车菊素、天竺葵素和飞燕草素。ANS 基因的表达直接影响植物花青素的积累,降低ANS的表达水平,会导致花青素合成水平明显下降从而产生白色花[13];而过表达ANS可以增加花青素的积累[14]。⑧最后,在类黄酮3-O-葡糖基转移酶(UFGT)的作用下形成花青素。在苹果中CHS、F3H、DFR、LDOX/ANS、UFGT等酶的结构基因协同表达决定果皮花青素含量,而葡萄中UFGT表达在花青素积累过程中起着非常关键的作用[15]。
花青素的合成不仅与CHS、DFR、LDOX/ANS等结构基因的表达密切相关,同时还受转录因子如R2R3-MYB、bHLH、WD40和HY5的调控[16]。虽然对花青素生物合成中的MBW(MYB-bHLH-WD40)络合物已有丰富的认识,但MYB转录因子仍是人们关注的焦点,而bHLH转录因子可单独或通过与MYB结合成为二聚体来结合DNA[17],从而启动基因的表达[18]。紫娟茶紫色叶片MYB-bHLH-WDR复合物通过激活F3H、DFR和ANS基因表达来调控花青素的积累[19]。柿子中WD40蛋白与Myb2和Myb4相互作用共同调节原花色素的合成[20]。玉米中MYB蛋白的激活可分为bHLH非依赖性和bHLH依赖性两种模式,如调节玉米中花青素途径的R2R3-MYB C1蛋白通过与bHLH转录因子相互作用以结合到启动子上,启动基因转录;而调节玉米中吡咯烷途径的R2R3-MYB蛋白可以在没有bHLH转录因子的情况下激活相同的启动子[21]。有些MYB转录因子不需要依赖WD40蛋白而参与调控花青素的合成,如拟南芥MYB11、MYB12和MYB111[22]。这些结果表明,一部分MYB需要同时表达bHLH和WD40才能发挥作用,而其他MYB可以单独诱导花青素合成[23]。HY5是多种光感受器家族的下游因子,促进光形态发生[24],其在花青素合成中也可直接与相关酶基因启动子区结合,调控基因表达[25];还可通过诱导拟南芥MYB75/PAP1转录因子的转录来调控花青素的生物合成[26]。
随着研究的深入,拟南芥、葡萄、苹果等植物中花青素合成和调控的机理逐渐清晰,为研究其他植物花青素的合成和调控奠定了基础。本研究利用RNA-Seq分析方法,研究了WH10(粉红种皮)和YH29(黑种皮)两种种皮颜色差异较大的花生品种的差异表达基因,并对不同种皮颜色品种的花青素生物合成和调控基因的表达水平进行分析。该项工作有助于加深我们对黑花生种皮中花青素在代谢和分子水平上的特异性积累的理解。
1 材料与方法
1.1 试验材料
所用花生材料分别为黑种皮花生YH29和粉红种皮花生WH10。YH29由开封市农林科学院邓丽老师提供;WH10是出口型大花生品种,由潍坊市农业科学院付春老师提供。
1.2 花青素含量的测定
参照Serrano等[27]的方法进行花生花青素含量的测定,具体步骤如下:称取50 mg 花生叶和茎分别置于1.5 mL 离心管中,在液氮中将其研成粉末;加入700 μL酸性甲醇(甲醇与HCl体积比为99∶1),于4℃过夜提取;然后于4℃、12 000 r/min离心1 min,取600 μL上清液置于新的离心管中,加入1 mL三氯甲烷,再加400 μL蒸馏水,于4℃、12 000 r/min离心10 min,上清液用于花青素含量测定;利用分光光度仪(U-3000,HITACHI)分别在530 nm与657 nm处测定吸光值。计算公式如下:花青素含量=(OD530-0.25OD657)/m,式中,OD530為花青素在530 nm波长下的光密度,OD657为叶绿素在657 nm波长下的光密度,m为样品质量(g)。设置3组生物学重复,每组重复测量3次。
1.3 转录组文库的构建和高通量测序
采用RNAiso试剂(Takara,中国)从不同花生材料新鲜叶片中分离总RNA,经DNase I (Takara,中国)处理,去除污染的基因组DNA。用1.0%琼脂糖凝胶和NanoDrop电泳检测RNA质量。mRNA被富集并分裂成短片段(约200 nt )。以mRNA片段为模板,利用随机六聚体引物合成第一链cDNA。第一链cDNA与DNA聚合酶Ⅰ、缓冲液、dNTPs、RNase H进一步合成第二链cDNA。在每一个片段之后加入一个核苷酸(腺嘌呤),完成末端修复,然后将测序接头连接到片段上。最后,通过PCR扩增纯化片段并进行富集,构建cDNA文库。每个样品设置3个生物学重复。
构建好的转录组文库由深圳华大基因科技有限公司进行高通量测序,测序使用BGISEQ-500平台。测序所得的raw reads需进行质控(QC)处理,获得clean reads用于后续分析。
1.4 生物信息学分析
从Peanutbase(https://peanutbase.org/)下载栽培花生Tifrunner的基因组序列。将clean reads比对到花生参考基因组上,通过统计比对率、reads在参考序列上的分布情况等,判断比对结果是否通过第二次质控(QC)。然后进行基因定量分析、基于基因表达水平的各项分析,对筛选出的差异表达基因进行GO功能显著性富集分析、pathway显著性富集分析、聚类、蛋白互作网络和转录因子等分析。
基因的表达量采用FPKM(Fragments Per Kilobase Million)进行均一化处理,使用Log2(YH29/WH10)计算基因的相对表达量。差异倍数为两倍以上并且Q-value≤0.001的基因为表达显著差异基因。
2 结果与分析
2.1 花生色素积累的表型鉴定
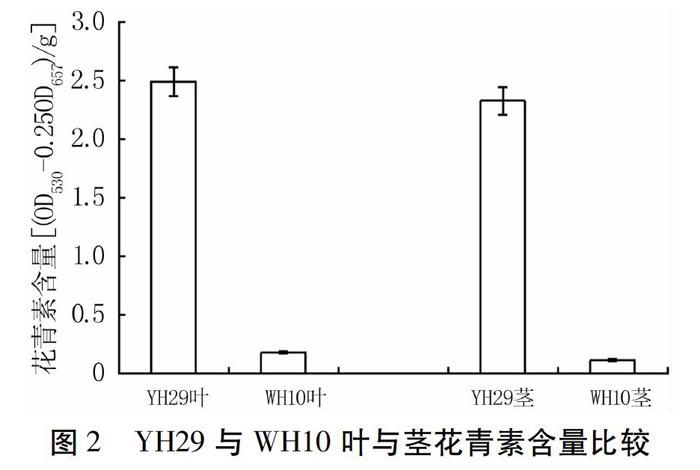
为了研究黑色花生种皮中色素的积累特性,本研究选取了具有典型种皮颜色的代表性品种YH29和WH10。YH29种皮呈黑色,叶、花颜色与WH10相比较深,特别是叶柄,但两个品种胚的颜色没有差异(图1)。同时,对叶和茎中花青素含量进行测定,YH29叶和茎中花青素含量都显著高于WH10(图2)。
2.2 高通量测序和基因表达谱
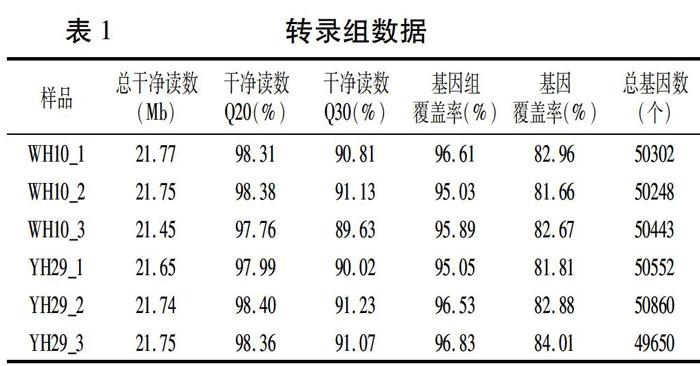
为了获得不同种皮颜色基因表达谱,利用YH29和WH10构建了6个cDNA文库,利用BGISEQ-500平台对cDNA文库进行测序,每个样品平均产出21.69 Mb数据,消除低质量序列后共获得130.11 Mb的clean reads(干净读数),平均读取率为99.36%(表1)。使用HISAT将clean reads比对到参考基因组序列,YH29平均有96.14%匹配到参考基因组,WH10平均有95.84%匹配到参考基因组。大部分的转录本被完整覆盖,reads均匀分布在转录本的各个区域。
2.3 差异表达基因的鉴定和功能分析
使用Bowtie2将clean reads比对到参考基因组序列上,然后使用RSEM计算各个样品的基因表达水平,在两个样品中鉴定出2 814个差异基因,与WH10相比,YH29中1 539个表达上调,1 275个表达下调。对差异基因进行GO分类(图3),分类在生物过程、细胞成分和分子功能三个部分中。在生物过程中,“代谢过程”中差异基因的数目最多,“细胞过程”差异基因数目次之,其次是“生物调节”、“定位”和“刺激反应”。在细胞成分中,“细胞”、“膜”、“细胞器”中差异基因数目较多。在分子功能中,“催化活性”和“结合”的差异基因数目明显多于其他功能,其中含有多个MYB、bHLH、WRKY等转录因子(表2)。
为了获得更多的生物学信息,深入了解花生花青素积累机制,我们对KEGG富集途径进行分析,结果(表3)表明,有20条途径被富集,其中,花青素生物合成途径排在首位。表4列出了与花青素合成通路相关的基因及其表达量,14个相关基因中有12个在YH29中表达上调,2个表达下调。另外,类黄酮生物合成、异黄酮生物合成等途径均被富集,以往的研究表明,这些途径的代谢变化都与花青素的积累相关。
3 讨论
3.1 花青素生物合成关键酶结构基因的调控
植物中花青素生物合成途径已经相对比较清楚,在本研究中花青素合成过程中的关键酶PAL、CHS、DFR、LDOX/ANS、UFGT基因表达均上调(图4)。其中,PAL作为苯丙烷代谢途径的第一个关键酶,其两个编码基因(5H4H17、FI9C9D)表达上调,使4-香豆酰-CoA大量积累,为花青素的积累提供更多底物。CHS作为花青素代谢途径的关键限速酶,其7个编码基因(GQLW6A、95I963、QZN0LQ、BCQ67I、0FI6RG、UDJX6I、BDJ8VI)表达上调十分明显,会产生大量的查尔酮。2个DFR基因(7JZ58T、X8EVF3)表达上调,可以使更多的二氢山奈酚流入花青素合成途径,从而产生更多的无色花色素。LDOX/ANS是花青素合成的最后一个关键酶,在本研究中,编码LDOX/ANS的7个基因(UQ0Z3E、AQ6B1J、FYP25E、9KNF1J、KX8RC4、36PEC4、N5X18U)表達均上调,直接影响花青素的积累[28]。UFGT是花青素生物合成途径中的最后一种酶,本研究中,编码UFGT的一个基因(31BJ59)也是表达上调的。上述结果表明,PAL、CHS、DFR、LDOX/ANS、UFGT酶的结构基因协同表达共同促进了花青素积累。
3.2 花青素合成积累过程中支链途径的调控
花青素生物合成途径的中间体也可用于合成其他次生物质,例如,4-香豆酰-CoA是木质素、生物碱的主要前体[30],三个合成途径共同竞争底物4-香豆酰-CoA。在木质素和生物碱合成过程中,4-香豆酸-CoA连接酶(4CL)长期以来被认为是该途径中的一个重要调控点[31]。本研究(表5)发现,黑花生中编码4CL的基因显著下调,使木质素合成途径的中间体减少;同时编码咖啡酸3-O-甲基转移酶(COMT)的基因也显著下调,编码F5H的基因也是下调的,COMT和F5H在木质素合成的多个过程中起催化作用,编码这两个酶的基因下调使木质素积累减少,更多的底物进入花青素途径。综上所述,在木质素合成过程中,编码相关酶的基因都显著下调,其结果是使更多的底物流向花青素合成途径。
異黄酮是豆科植物次生代谢产物[32],异黄酮生物合成途径与花青素生物合成途径共同竞争底物柚皮素和甘草素。本研究结果表明,黑花生编码此过程相关酶的基因也存在下调现象,其结果也使更多的底物流向花青素合成途径从而增加花青素的积累。
3.3 花青素合成积累过程中转录因子的调控
花青素代谢途径受MYB-bHLH-WD40转录复合物在转录水平上的调控,在本研究中,差异表达基因中有MYB转录因子31个,bHLH转录因子30个(表2),表达量在黑皮花生中上调最明显的两个MYB转录因子是与花青素合成相关的R2R3-MYB,其中一个MYB3R-3转录因子。早期研究发现它决定器官大小,参与细胞增殖的时间和空间调控,是产生具有特定大小和形态器官的关键因子[33]。表达下调最明显的一个MYB转录因子是MYB124,研究发现它在拟南芥中有控制叶片上气孔数量的功能[34]。在黑花生中表达上调最明显的bHLH转录因子属于bHLH96。一个HY5蛋白在黑花生中也是表达上调的,这些转录因子可能也参与黑花生中花青素的积累。
4 结论
本研究发现花生品种YH29和WH10种皮、叶、花、茎花青素含量不同,并造成了其颜色的差异。通过比较转录组分析发现,YH29花青素生物合成途径中5种关键酶的编码基因均上调表达,而在与花青素生物合成相竞争的其他代谢途径中编码相关酶的基因表达下调,其结果使更多的底物流向花青素代谢途径。另外, MYB等转录因子的差异表达也可能是调控YH29中花青素积累的重要因素。本研究结果可为深入研究花生种皮花青素合成的分子机理及培育高花青素含量的花生新品种提供参考。
参 考 文 献:
[1]Huang J, Xing M, Li Y, et al. Comparative transcriptome analysis of the skin-specific accumulation of anthocyanins in black peanut (Arachis hypogaea L.)[J].J. Agric. Food Chem., 2019, 67(4): 1312-1324.
[2]Regan B C, Julliot C, Simmen B, et al. Fruits, foliage and the evolution of primate colour vision[J].Philos. Trans. R Soc. Lond B Biol. Sci., 2001, 356(1407): 229-283.
[3]Howe G A, Jander G. Plant immunity to insect herbivores[J].Annu. Rev. Plant Biol., 2008, 59: 41-66.
[4]Xu W, Dubos C, Lepiniec L. Transcriptional control of flavonoid biosynthesis by MYB-bHLH-WDR complexes[J].Trends Plant Sci., 2015, 20(3): 176-185.
[5]Hsu C C, Chen Y Y, Tsai W C, et al. Three R2R3-MYB transcription factors regulate distinct floral pigmentation patterning in Phalaenopsis spp.[J].Plant Physiol., 2015, 168(1): 175-191.
[6]Pavel S, Jurgita P, Kazanaviiūt V, et al. Expression and anthocyanin biosynthesis-modulating potential of sweet cherry (Prunus avium L.) MYB10 and bHLH genes[J].PLoS ONE, 2015, 10(5): e0126991.
[7]Gallus S, Talamini R, Giacosa A, et al. Does an apple a day keep the oncologist away?[J].Ann. Oncol., 2005, 16(11): 1841-1844.
[8]Mazzucato A, Willems D, Bernini R, et al. Novel phenotypes related to the breeding of purple-fruited tomatoes and effect of peel extracts on human cancer cell proliferation[J].Plant Physiol. Biochem., 2013, 72: 125-133.
[9]Watson R R, Schnlau F. Nutraceutical and antioxidant effects of a delphinidin-rich maqui berry extract Delphinol: a review[J].Minerva Cardioangiol, 2015, 63(2 Suppl 1): 1-12.
[10]Durbin M L, McCaig B, Clegg M T. Molecular evolution of the chalcone synthase multigene family in the morning glory genome[J].Plant Mol. Biol., 2000, 42(1): 79-92.
[11]Koes R E, Spelt C E, van den Elzen P J M, et al. Cloning and molecular characterization of the chalcone synthase multigene family of Petunia hybrida[J].Gene, 1989, 81(2): 245-257.
[12]Sparvoli F, Martin C, Scienza A, et al. Cloning and molecular analysis of structural genes involved in flavonoid and stilbene biosynthesis in grape (Vitis vinifera L.)[J].Plant Mol. Biol., 1994, 24(5): 743-755.
[13]Nakamura N, Fukuchi-Mizutani M, Miyazaki K, et al. RNAi suppression of the anthocyanidin synthase gene in Torenia hybrida yields white flowers with higher frequency and better stability than antisense and sense suppression[J].Plant Biotechnology, 2006, 23: 13-17.
[14]Reddy A M, Reddy V S, Scheffler B E, et al. Novel transgenic rice overexpressing anthocyanidin synthase accumulates a mixture of flavonoids leading to an increased antioxidant potential[J].Metabolic Engineering, 2007, 9(1): 95-111.
[15]Boss P K, Robinson D S P. Analysis of the expression of anthocyanin pathway genes in developing Vitis vinifera L. cv. Shiraz grape berries and the implications for pathway regulation[J].Plant Physiol., 1996, 111(4): 1059-1066.
[16]Lu Y Z M, Meng X, Wan H, et al. Photoperiod and shading regulate coloration and anthocyanin accumulation in the leaves of malus crabapples[J].Plant Cell Tissue Organ Cult., 2015, 121: 619-632.
[17]Liu X F, Yin X R, Andrew C,et al. The role of MrbHLH1 and MrMYB1 in regulating anthocyanin biosynthetic genes in tobacco and Chinese bayberry (Myrica rubra) during anthocyanin biosynthesis[J].Plant Cell,Tissue and Organ Culture, 2013, 115: 285-298.
[18]Feller A, Machemer K, Braun E L, et al. Evolutionary and comparative analysis of MYB and bHLH plant transcription factors[J].Plant J., 2011, 66: 94-116.
[19]Sun B, Zhu Z, Cao P, et al. Purple foliage coloration in tea (Camellia sinensis L.) arises from activation of the R2R3-MYB transcription factor CsAN1[J].Sci. Rep., 2016, 6: 32534.
[20]Naval M D M, GIL-Munoz F, Lloret A, et al. A WD40-repeat protein from persimmon interacts with the regulators of proanthocyanidin biosynthesis DkMYB2 and DkMYB4[J].Tree Genetics & Genomes, 2016, 12(1): 13.
[21]Sainz M B, Grotewold E, Chandler V L. Evidence for direct activation of an anthocyanin promoter by the maize C1 protein and comparison of DNA binding by related Myb domain proteins[J].Plant Cell, 1997, 9(4): 611-625.
[22]Abe H, Urao T, Ito T, et al. Arabidopsis AtMYC2 (bHLH) and AtMYB2 (MYB) function as transcriptional activators in abscisic acid signaling[J].Plant Cell, 2003, 15(1): 63-78.
[23]Dasgupta K, Thilmony R, Stover E, et al. Novel R2R3-MYB transcription factors from Prunus americana regulate differential patterns of anthocyanin accumulation in tobacco and citrus[J].GM Crops Food, 2017, 8(2): 85-105.
[24]Lee J, He K, Stolc V, et al. Analysis of transcription factor HY5 genomic binding sites revealed its hierarchical role in light regulation of development[J].Plant Cell, 2007, 19: 731-749.
[25]Zhang H Y, He H, Wang X C, et al. Genome-wide mapping of the HY5-mediated genenetworks in Arabidopsis that involve both transcriptional and post-translational regulation[J].Plant J., 2011, 65: 346-358.
[26]Shin D H, Choi M, Kim K, et al. HY5 regulates anthocyanin biosynthesis by inducing the transcriptional activation of the MYB75/PAP1 transcription factor in Arabidopsis[J].FEBS Lett., 2013, 587: 1543-1547.
[27]Serrano M, Kanehara K, Torres M, et al. Repression of sucrose/ultraviolet B light-induced flavonoid accumulation in microbe-associated molecular pattern-triggered immunity in Arabidopsis[J].Plant Physiology, 2012, 158(1):408-422.
[28]Shin D H, Choi M, Kim K, et al. Novel transgenic rice overexpressing anthocyanidin synthase accumulates a mixture of flavonoids leading to an increased antioxidant potential[J].Metab. Eng., 2007, 9(1): 95-111.
[29]Koes R, Verweij W, Quattrocchio F. Flavonoids: a colorful model for the regulation and evolution of biochemical pathways[J]Trends Plant Sci., 2005, 10(5): 236-242.
[30]Wang L, Pan D, Liang M, et al. Regulation of anthocyanin biosynthesis in purple leaves of Zijuan tea (Camellia sinensis var. kitamura)[J].Int. J. Mol. Sci., 2017, 18(4): 833.
[31]Knobloch K H, Hahlbrock K. Isoenzymes of p-coumarate: CoA ligase from cell suspension cultures of Glycine max[J].Eur. J. Biochem., 1975, 52(2): 311-320.
[32]Kim H K, Jang Y H, Baek I S, et al. Polymorphism and expression of isoflavone synthase genes from soybean cultivars[J].Mol. Cells, 2005, 19(1): 67-73.
[33]Kobayashi K, Suzuki T, Iwata E, et al. Transcriptional repression by MYB3R proteins regulates plant organ growth[J].The EMBO Journal, 2015, 34(15): 1992-2007.
[34]Yang M. The FOUR LIPS (FLP) and MYB88 genes conditionally suppress the production of nonstomatal epidermal cells in Arabidopsis cotyledons[J].American Journal of Botany, 2016, 103(9):1559-1566.
收稿日期:2019-09-05
基金項目:山东省良种工程课题(2016LZGC025, 2017LZN032);山东省重点研发计划项目(2019GNC106026, 2019GSF107008, 2018GSF121032);山东省自然科学基金项目(ZR2017MC005);山东省泰山学者项目;山东省农业科学院农业科技创新工程项目(CXGC2018E13, CXGC2016B02);山东省农业科学院青年英才培养计划项目
作者简介:赵钰涵(1992—),女,硕士研究生,主要从事花生基因组学和遗传育种研究。E-mail:zyh685119@163.com
通讯作者:王兴军(1966—),男,博士,研究员,主要从事花生基因组学和遗传育种研究。E-mail:xingjunw@htomail.com
赵传志(1981—),男,博士,副研究员,主要从事花生基因组学和遗传育种研究。E-mail:chuanzhiz@126.com
