高效液相色谱-荧光法测定油炸型膨化食品中4种多环芳烃
2019-11-28,*
,*
(1.山东省食品药品检验研究院,山东济南 250101;2.中国检验检疫科学研究院,北京 100176)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是一类广泛存在的致癌、致畸、致突变的环境污染物,包含两个或两个以上的苯环,主要来源于有机物的不完全燃烧[1-2]。空气中的PAHs主要通过呼吸道进入人体,而水体、食品中的PAHs则通过饮食进入人体[3-4]。PAHs具有亲脂性的特点,在食用油、熏烧烤肉及水产品等食品中均有检出。苯并[a]蒽(BaA)、(CHR)、苯并[b]荧蒽(BbF)和苯并[a]芘(BaP)是毒性较强的4种PAHs[5-6],其中BaP被国际癌症研究机构归为1类致癌物,其余三种归为2B类致癌物[7]。因此,国内和国际上对PAHs规定了限量要求。我国《食品安全安全国家标准 食品中污染物限量》(GB 2762-2017)中规定了谷物及其制品、熏烧烤肉类和熏烤水产品中BaP的限量为5.0 μg/kg,油脂及其制品中BaP的限量为10 μg/kg。2015年欧盟委员会规定出口欧盟的部分食品中4种PAHs的总量不得超过50 μg/kg[8]。因此,建立能够快速同时测定4种PAHs含量的方法具有重要意义。
目前报道的PAHs的检测方法主要有高效液相色谱法[9-13]和气相色谱串联质谱法[14-17]。高效液相色谱-荧光检测法灵敏度高,稳定性好,但是对样品的净化效果要求比较高。食品基质比较复杂,易受杂质干扰,因此必须对样品进行前处理。常见的前处理方法主要有索式提取法[18]、液-液萃取法[9]、超声提取法[19]、固相萃取法[11-12]和凝胶渗透色谱[20]。其中,固相萃取法由于简单、节约溶剂、重现性好得到广泛的应用。
油炸型膨化食品由于食用方便、香酥可口、口味多样受到众多消费者的欢迎,其主要成分包括碳水化合物、脂肪、蛋白质等。因膨化食品属于高油脂、高热量的食品,而多环芳烃属于环境污染物,具有亲脂性的特点,有可能会迁移到食品中。油炸型膨化食品在加工过程中会有煎炸工艺,有研究[21]表明油脂煎炸过程中会引起多环芳烃的变化,因此,2017年国家食品药品监管总局将油炸型膨化食品中BaA、CHR、BbF和BaP列入食品安全风险监测计划。目前对膨化食品中多环芳烃的检测少有报道。
本文采用高效液相色谱法,系统考察了提取方式、提取溶剂种类、提取次数、净化方式等对油炸型膨化食品中BaA、CHR、BbF、BaP提取和分离的影响,并考察了流动相及色谱柱种类对分离的影响,以期建立油炸型膨化食品中4种多环芳烃的检测方法。
1 材料与方法
1.1 材料与仪器
乙腈、正己烷、二氯甲烷 色谱纯,德国Merck公司;乙醚、石油醚、氯化钠 分析纯,国药集团化学试剂有限公司;标准品(纯度99.9%,浓度100 mg/L)、苯并[a]蒽(纯度99.0%,浓度100 mg/L)、苯并[b]荧蒽(纯度99.1%,浓度100 mg/L)、苯并[a]芘(纯度99.5%,浓度100 mg/L) 美国o2si公司;Cleanert BAP-3固相萃取柱(500 mg/6 mL) 艾杰尔;色谱柱PAH C18(250 mm×4.6 mm,5 μm) 美国Waters公司;实验用膨化食品(薯片、虾条、锅巴) 购自济南市当地超市。
Waters 2695型高效液相色谱仪(配备2475荧光检测器) 美国Waters公司;3-18K台式高速离心机 德国Sigma公司;BT 125D电子天平 德国Sartorius公司;MS3型旋涡混合器 德国IKA公司;SB-800DTD超声清洗仪 宁波新芝生物科技股份有限公司;HGC-24型氮吹仪 恒奥科技有限公司;GM-300型粉碎机 德国莱驰公司;Milli-Q超纯水系统 美国Millipore公司。
1.2 实验方法
1.2.1 标准溶液的配制 准确移取4种多环芳烃标准溶液各0.1 mL于同一10 mL容量瓶中,用乙腈定容至刻度,配制成浓度为1 mg/L的多环芳烃混合标准溶液。根据实际需要移取适量的混合标准溶液液用乙腈进行稀释,得到浓度分别为0.5、1、4、20、40 μg/L的系列标准工作溶液。
1.2.2 样品制备 将实验所用薯片、虾条、锅巴分别于粉碎机中以10000 r/min转速下粉碎,充分混匀,储存于洁净的容器中,4 ℃保存。
1.2.3 样品前处理 提取:准确称取1.2.2中制备的样品2 g(精确至0.01 g)于50 mL具塞离心管A中,加入5 mL饱和氯化钠溶液分散均匀,再加入10 mL正己烷,涡旋混合3 min,40 kHz频率下常温超声提取15 min,室温下8000 r/min离心5 min,取上层正己烷层于50 mL具塞离心管B中,离心管A中的溶液用10 mL正己烷重复提取一次,正己烷层合并于50 mL离心管B中,取10 mL于15 mL离心管中,作为待净化液。净化:依次用5 mL二氯甲烷、5 mL正己烷活化BAP-3固相萃取柱,将待净化液全部转移至SPE柱,5 mL正己烷淋洗,7 mL二氯甲烷洗脱,40 ℃下将洗脱液氮吹浓缩至干,最后用1 mL乙腈复溶,过0.22 μm有机滤膜,待HPLC-FLD检测。同时做试剂空白实验。
1.2.4 样品前处理条件的优化
1.2.4.1 提取方式的选择 考察了索式提取、超声提取和液液萃取-超声提取三种提取方式对目标物的提取效率。
索式提取:称取1.2.2中制备的样品2 g于索式提取器中,加入120 mL乙醚/石油醚混合液(体积比1∶1),连续提取4 h,经浓缩后,用5 mL正己烷复溶,作为待净化液。净化方法同1.2.3中的净化方法。
超声提取:除不加饱和氯化钠溶液外,其余步骤同1.2.3。
液液萃取-超声提取:步骤同1.2.3。
1.2.4.2 提取溶剂种类的选择 根据多环芳烃亲脂性特点,本研究考察了正己烷、乙醚、乙腈三种提取溶剂目标物的提取效率,其它步骤和条件同1.2.3。
1.2.4.3 提取次数的优化 考察了正己烷为萃取溶剂,对样品分别提取1、2、3次时,4种多环芳烃的回收率,其它步骤和条件同1.2.3。
1.2.4.4 净化条件的选择 考察了中性Al2O3柱(22 g/60 mL,艾杰尔)、Cleanert BAP-3固相萃取柱(500 mg/6 mL,艾杰尔)和Florisil固相萃取柱(500 mg/3 mL,艾杰尔)对样品的净化效果。样品提取步骤和条件同1.2.3。
1.2.5 液相色谱条件 色谱柱:Waters PAH C18反相键合固定相色谱柱(250 mm×4.6 mm,5 μm);柱温35 ℃;进样量20 μL;流速:1.5 mL/min;流动相:乙腈和水;检测器:荧光检测器,检测波长见表1;梯度洗脱程序见表2。

表1 4种多环芳烃的荧光检测参数Table 1 Fluorescence detection program of 4 PAHs

表2 HPLC梯度洗脱程序Table 2 Gradient elution program for HPLC separation
1.3 数据处理
通过与仪器配套的Empower 3色谱数据处理软件完成数据采集与处理,以及Microsoft Excel进行绘图。
2 结果与分析
2.1 前处理方法的优化分析
2.1.1 提取条件的选择
2.1.1.1 提取方式 针对食品基质中PAHs的提取方式主要有液液萃取(Liquid-liquid Extraction,LLE)[9]、索式提取(Soxhlet Extraction,SE)[18]和超声萃取(Ultrasonic Extraction,UE)[19]和超临界流体萃取(Supercritical Fluid Extraction,SFE)[22]。实验中考察了SE、UE、LLE-UE三种萃取方式对加标量为25 μg/kg的薯片样品中4种PAHs提取效率的影响(见图1)。结果表明,以上三种提取方式的回收率均在80%以上,满足实验要求,但SE耗时、溶剂消耗量大,因此不是资源节约、环境友好型方法的首选。LLE-UE相对于UE多了液液萃取步骤,能更好地分散样品,起到一定程度的除杂效果,综合考虑选择LLE-UE作为样品萃取处理方式。
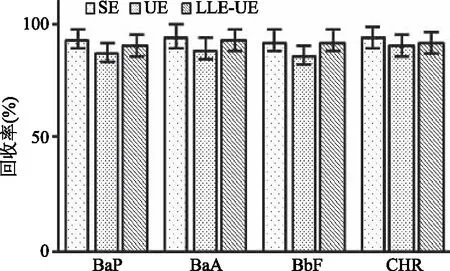
图1 提取方式对4种PAHs回收率的影响Fig.1 Effects of different extraction methodson the recoveries of the four kinds of PAHs
2.1.1.2 提取溶剂种类 本研究比较了正己烷、乙醚、乙腈三种提取溶剂对薯片中4种PAHs提取效率的影响(见图2)。乙醚和正己烷的提取效率相当,乙腈的提取效率稍低,这主要归因于物质间的相似相溶原理。PAHs组分为非极性或弱极性物质,分散到溶液中的PAHs更容易被弱极性的乙醚或正己烷萃取出来。乙醚属于易制毒试剂且极易挥发,正己烷属于低毒试剂,因此选择正己烷为提取溶剂。本实验同时考察了水和饱和氯化钠溶液分别作为分散剂时对目标物回收率的影响。实验发现以水为分散剂时,用正己烷萃取易产生乳化层,导致回收率偏低;以饱和氯化钠溶液为分散剂时可避免乳化层的产生。因此,本实验选择了饱和氯化钠溶液为分散剂。
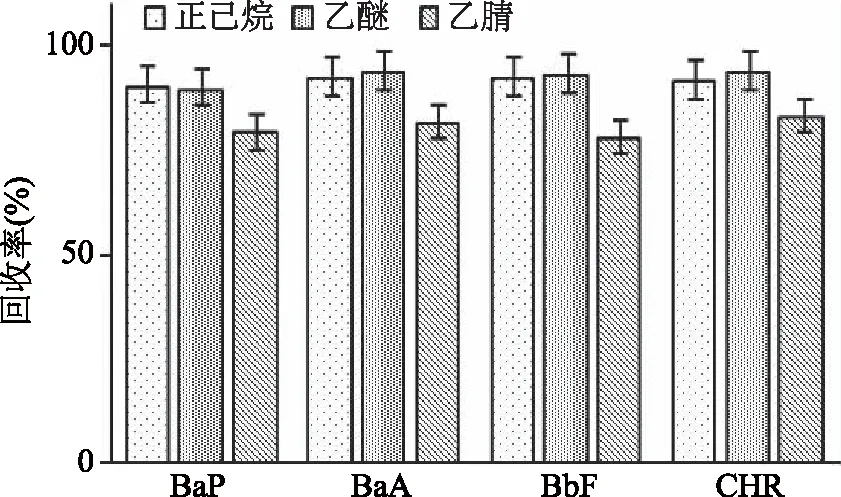
图2 提取溶剂对4种PAHs回收率的影响Fig.2 Effects of different extraction solventson the recoveries of the four kinds of PAHs
2.1.1.3 提取次数 提取次数对4种PAHs回收率的影响见图3。对样品只提取1次,各目标物的回收率在71.0%~76.7%之间;提取2次,回收率在90.6%~96.2%之间;之后再增加提取次数,回收率没有明显增加,因此,选择提取次数为2次。
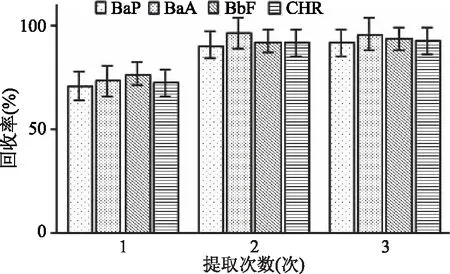
图3 提取次数对4种PAHs回收率的影响Fig.3 Effects of different extraction numberson the recoveries of the four kinds of PAHs
2.1.2 净化条件的选择 油炸型膨化食品基质比较复杂,含有大量的油脂等干扰物,而目标物含量较低,因此需要在前处理过程中对目标物进行净化和富集。文献报道的常见的净化方式有皂化反应[13]、凝胶渗透色谱[20]和固相萃取[11-12]等。皂化反应往往需要较高的温度和长时间的反应,且皂化后需要进一步富集;凝胶渗透色谱法仪器成本高,且溶剂使用量大。固相萃取由于简单、快速、节约溶剂等特点被广泛应用于PAHs的净化。

表3 3种小柱净化样品的条件及4种PAHs的回收率Table 3 SPE conditions and recoveries of four PAHs in samples
本实验考察了中性Al2O3柱(22 g/60 mL,艾杰尔)、Cleanert BAP-3固相萃取柱(500 mg/6 mL,艾杰尔)和Florisil固相萃取柱(500 mg/3 mL,艾杰尔)对薯片样品的净化效果。3种小柱的净化方法及化合物的回收率见表3,净化后的色谱图见图4。结果表明,样品经过三种固相萃取柱净化后,回收率无明显差异,但是经过中性氧化铝柱和弗罗里硅土柱净化后,仍有杂质峰影响的分离,而经过BAP-3净化后,杂质峰消失。这主要是因为BAP-3固相萃取柱是苯并芘分子印迹柱,对结构相近的、苯并[a]蒽、苯并[b]荧蒽、苯并[a]芘等重质PAHs可以选择性的保留。另外,中性氧化铝柱需要80 mL洗脱溶剂,溶剂消耗量较大;弗罗里硅土柱需要在上样时开始接液,氮吹时间较长。综合考虑,选择BAP-3固相萃取柱作为净化柱。
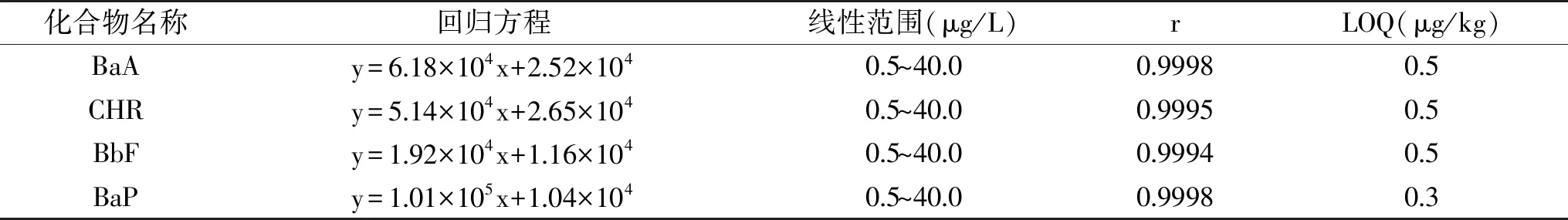
表4 4种PAHs的回归方程、线性范围、r及LOQTable 4 Linear equations,linearity range,r and LOQ of 4 PAHs
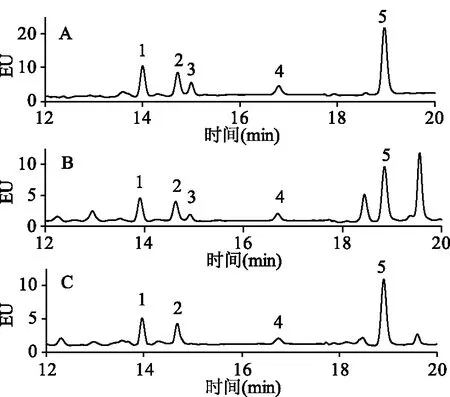
图4 加标样品经过净化柱后的色谱图Fig.4 Chromatograms of spiked samplesunder different clean-up condition注:A:Al2O3柱;B:Florisil柱;C:BAP-3;1:BaA;2:CHR;3:杂质峰;4:BbF;5:BaP。
2.2 色谱条件的优化
2.2.1 色谱柱的选择 BaA与CHR结构相近,互为同分异构体,分离较为困难。本实验比较了Waters XBridge C18(150 mm×4.6 mm,3.5 μm)、Waters Symmetry C18(250 mm×4.6 mm,5 μm)和Waters PAH C18(250 mm×4.6 mm,5 μm)三种不同的色谱柱对目标物的分离效果。在Waters XBridge C18和Symmetry C18色谱柱上BAP与CHR完全重合,无法实现分离,而在Waters PAH C18柱上两种组分可以得到完全分离,分离度为1.81(见图5)。因此本实验采用了Waters PAH C18色谱柱进行分离分析。
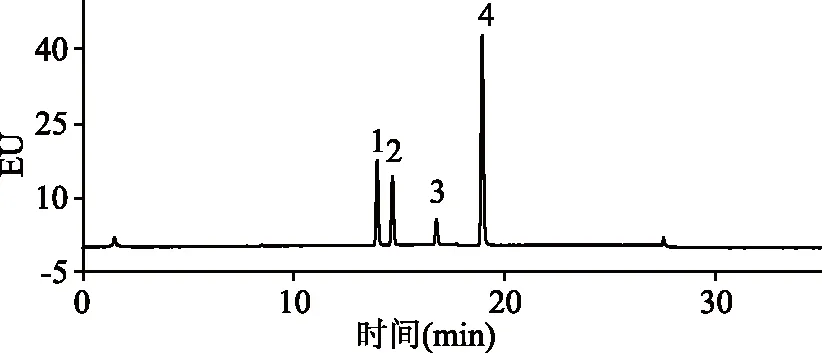
图5 4种多环芳烃标准品的色谱图Fig.5 The HPLC chromatogram of four standards of PAHs注:1:BaA;2:CHR;3:BbF;4:BaP。图6同。
2.2.2 流动相与流速的选择 本实验考察了甲醇-水和乙腈-水分别作为流动相时对目标物的色谱保留行为的影响。当流动相为甲醇-水时峰形展宽,出峰时间较晚,分离度较差;而用乙腈-水为流动相时峰宽变窄,峰形变好,出峰时间适中,这主要归因于反相色谱中乙腈的洗脱能力大于甲醇的洗脱能力。当流速为1.0 mL/min时,BAP的出峰时间在25 min之后,出峰时间较晚;当流速为2.0 mL/min时,柱压升高,影响色谱柱的使用寿命,综合考虑选择1.5 mL/min的流速为本次实验的最终流速。
2.3 方法学验证
2.3.1 线性关系与检出限 将浓度分别为0.5、1.0、4.0、20.0、40.0 μg/L的PAHs混合标准工作液注入液相色谱仪,按仪器设定的条件进行测定,以各物质的峰面积(y,微伏*秒)为纵坐标,以质量浓度(x,μg/L)为横坐标,绘制标准曲线,求得线性回归方程和线性相关系数(r)(见表4)。以10倍基线噪音确定方法的定量限(LOQ),方法的LOQ为0.3~0.5 μg/kg。空白薯片样品和加标样品(1 μg/kg)谱图见图6。
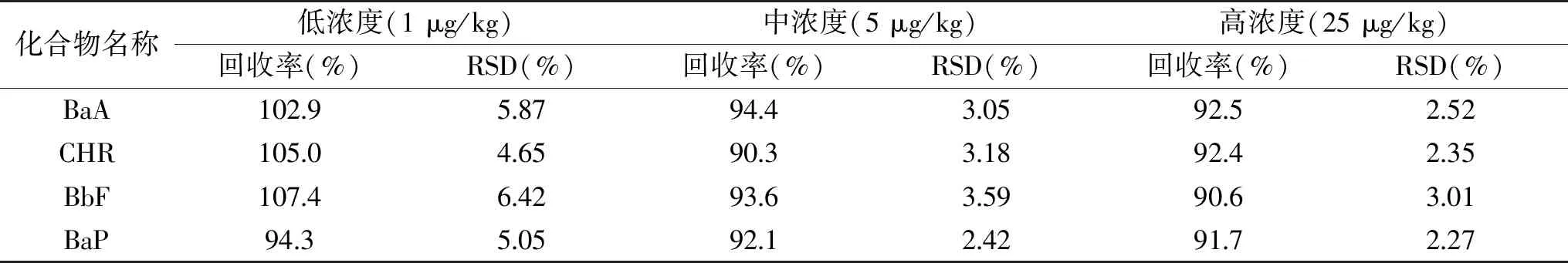
表5 4种PAHs的回收率和精密度(n=6)Table 5 Recovery and relative standard deviation of 4 PAHs(n=6)
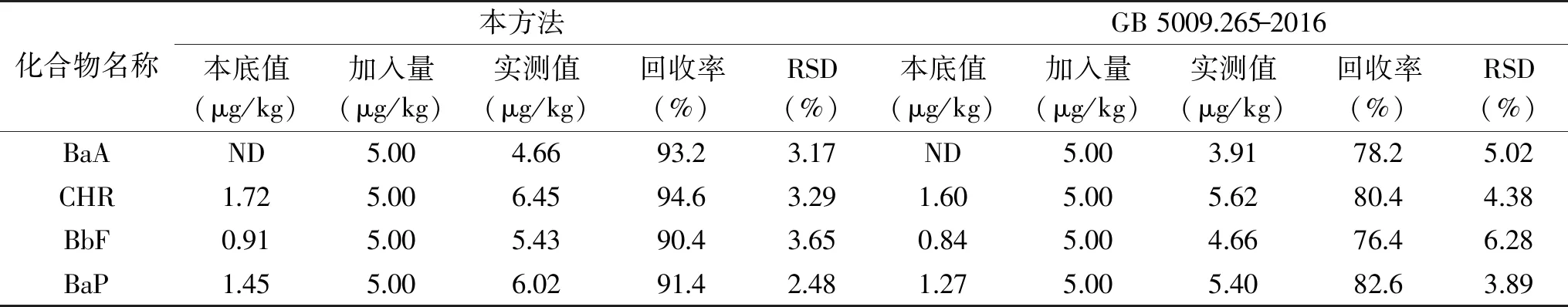
表6 本方法与GB 5009.265-2016在实际样品检测中获得4 种PAHs结果的比较(n=6)Table 6 Comparison of results of 4 PAHs obtained by GB 5009.265-2016 and the method in this paper in actual sample
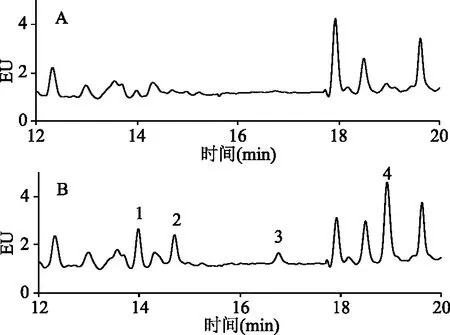
图6 空白样品(A)和加标样品(B)的4种PAHs色谱图Fig.6 Chromatograms showing the blank sample(A)and spiked sample(B)for four kinds of PAHs
2.3.2 回收率与精密度 向空白样品中分别进行低(1 μg/kg)、中(5 μg/kg)、高(25 μg/kg)三水平的加标,每种加标样品平行测定6份,考察方法的回收率与精密度。方法的平均回收率在90.3%~107.4%之间,精密度在6.5%以下,符合GB/T 27404-2008《实验室质量控制规范 食品理化检验》中检验方法确认对回收率和精密度的要求,具体数据见表5。
2.4 方法对比
将样品按优化好的方法进行测定,结果与现有标准GB 5009.265-2016高效液相色谱法测定PAHs的结果比较,如表6所示。GB 5009.265-2016高效液相色谱法对油脂含量较高的食品采用乙腈提取目标物,正己烷除脂后旋蒸浓缩,再过弗罗里硅土柱净化,样品处理复杂,效率低,不适用于大批量样品的处理。本方法前处理步骤简单,重现性好,适合BaA、CHR、BbF和BaP的检测。
2.5 实际样品分析
按照实验选择的最优条件对济南市各大超市采购的25批次油炸型膨化食品进行分析,检测结果见表7。实际样品中检出的BaP的最高含量为3.1 μg/kg,4种PAHs含量之和最高为4.2 μg/kg。参照我国和欧盟的限量标准,膨化食品中的4种PAHs的含量均满足限量要求。
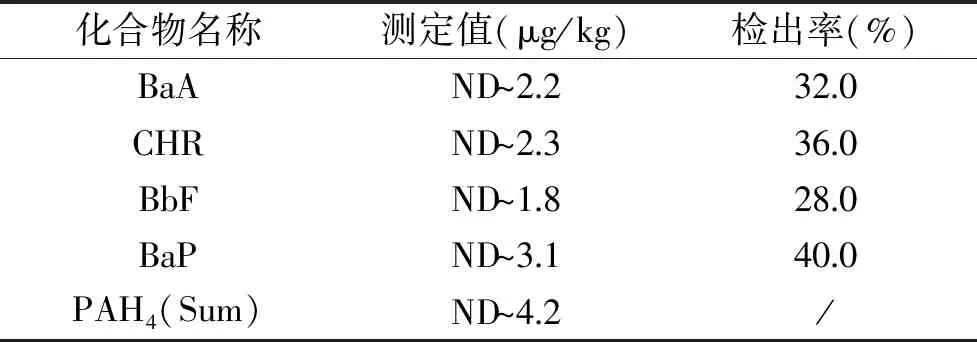
表7 膨化食品中4种PAHs的含量Table 7 The test results of fourkinds of PAHs in expanded foods
注:ND:未检出。
3 结论
本文建立了高效液相色谱-荧光法测定油炸型膨化食品中4种多环芳烃的分析方法。通过提取条件和净化条件的优化,有效地去除了基质干扰。通过色谱条件的优化,实现了4种PAHs的基线分离,且方法的回收率和精密度均满足GB/T 27404-2008《实验室质量控制规范 食品理化检验》中检验方法确认要求。该方法简单、快速、准确度高、精密度好,可应用于油炸型膨化食品中多环芳烃的日常分析检测。
